基于双启动引物特异性检测单核细胞增生李斯特氏菌的P C R方法
徐义刚,李丹丹,张柏棋,刘忠梅,魏冬旭,刘新亮,李苏龙,*
(1.黑龙江出入境检验检疫局检验检疫技术中心,黑龙江哈尔滨150001;2.海南出入境检验检疫局检验检疫技术中心,海南海口570125;3.辽宁出入境检验检疫局,辽宁大连116001)
基于双启动引物特异性检测单核细胞增生李斯特氏菌的P C R方法
徐义刚1,李丹丹2,张柏棋3,刘忠梅1,魏冬旭1,刘新亮1,李苏龙1,*
(1.黑龙江出入境检验检疫局检验检疫技术中心,黑龙江哈尔滨150001;2.海南出入境检验检疫局检验检疫技术中心,海南海口570125;3.辽宁出入境检验检疫局,辽宁大连116001)
以单核细胞增生李斯特氏菌iap基因为靶基因,利用一新型PCR引物设计方法--双启动引物(Dual-priming oligonucleotide,DPO),建立了特异性检测单核细胞增生李斯特氏菌的DPO-PCR方法,测试了DPO-PCR方法退火温度不敏感性、特异性及灵敏度,并在实践检测中进行了初步应用。结果显示:该方法检测单核细胞增生李斯特氏菌的灵敏度为1.51×102CFU/mL;退火温度不敏感性测试中,与常规PCR引物相比,DPO引物在48~68℃退火温度范围内均能够高效率地扩增靶基因;特异性测试中,DPO-PCR方法能特异地检测出目标菌,与其他菌株无非特异性扩增反应,比常规PCR方法显示出更强的特异性。实践应用证明,利用DPO-PCR方法对130份样本进行检测,共计检出9份单核细胞增生李斯特氏菌阳性样本,经国标法(GB/T 4789.30-2008)复检,两者检测结果一致,显示出良好的实用性,为单核细胞增生李斯特氏菌的快速准确检测提供了新方法。
单核细胞增生李斯特氏菌,iap基因,DPO-PCR方法
LM的常规检测方法,操作比较繁琐,包括细菌分离培养、系列生化反应、动力、溶血及毒力实验等步骤,完成鉴定工作一般需要7~10d,严重影响了检测鉴定周期。全自动免疫荧光检测方法[5]、PCR方法[6-7]、显色培养基快速检测方法[8]和脉冲场凝胶电泳技术[9]的应用促进了LM检测技术的发展。特别是PCR方法,凭借其快速、灵敏、特异性强的优点,在LM日常检测工作中发挥着重要作用,极大地缩短了检测周期,提高了检测效率。在PCR技术基础上,又发展了Real-time PCR方法[10]和LAMP方法[11]。然而,常规引物设计不仅要反复优化引物的各项参数,尤其是退火温度,而且要反复BLAST比对引物自身的特异性,以防止非特异性扩增,费时费力,当设计多重扩增引物时,更需要大量工作来优化引物退火温度及其特异性。
本研究引入了一种新型的PCR引物设计方法——双启动寡核苷酸引物(Dual-Priming Oligonucleotide,DPO),DPO引物与常规引物相比,具有设计简单、退火温度范围宽、特异性强等优点。设计DPO引物时,不需要反复优化引物的各项参数和反应条件,特别是退火温度,也不需要BLAST反复比对其特异性,有效地简化了PCR引物设计流程和实验步骤,更增强了检测特异性[12-15]。本研究选择LM高度保守的invasion associated protein(iap)基因为靶基因,基于DPO引物建立了特异性检测LM的DPO-PCR方法。
1 材料与方法
1.1 材料与仪器
单核细胞增生李斯特氏菌(ATCC 19111,ATCC 7644)、绵羊李斯特氏菌(ATCC 19119)、英诺克李斯特氏菌(ATCC 33090)、威尔斯李斯特氏菌(ATCC 35897)、西尔李斯特氏菌(ATCC 35967)、肠出血性大肠杆菌O157∶H7(ATCC 35150)、沙门氏菌(ATCC 10708)、志贺氏菌(ATCC 12022)、空肠弯曲菌(ATCC 33560)、霍乱弧菌(ATCC 14035)、副溶血弧菌(ATCC 27519)、金黄色葡萄球菌(ATCC 29213)、溶藻弧菌(ATCC 33839)、创伤弧菌(ATCC 33149)、阪崎肠杆菌(ATCC 51329)、嗜水气单胞菌(ATCC 7966)、小肠结肠炎耶尔森氏菌(ATCC 9610)、变形杆菌(ATCC 49027)、粘质沙雷菌(ATCC 14756)、溶血性链球菌(CMCC 32121)、细菌DNA提取试剂盒 购自TIANGEN公司;增菌培养基BPW 购自北京兰伯瑞公司;Taq DNA聚合酶、dNTP、MgCl2购自TaKaRa公司;引物 由上海生工合成。
梯度PCR仪 德国Eppendorf公司。
1.2 引物的设计
选择LM保守基因iap为靶基因,设计DPO引物(见表1)。
1.3 细菌基因组DNA的提取
试剂盒提取法,主要用于灵敏度检测,具体操作详见说明书。煮沸提取法,主要用于特异性和实践检测,方法:取1mL培养菌液,10000r/min离心5min,弃上清,加入150μL无菌水,混匀,沸水浴10min,10000r/min离心5min,取上清液,-20℃保存备用。
1.4 DPO-PCR反应体系与条件
25μL反应体系:10×PCR Buffer(Mg2+free)2.5μL,dNTP(2.5mmol/L)1.5μL,Taq DNA聚合酶(5U/μL)0.1μL,Mg2+(25mmol/L)1.5μL,上/下游DPO引物(10μmol/L)各1.0μL,DNA模板0.5μL,ddH2O 16.9μL。反应条件:95℃5min;95℃30s,58℃ 45s,72℃ 45s,30个循环;72℃终延伸10min。
1.5 DPO-PCR退火温度不敏感性实验
退火温度范围设为48~68℃,与常规PCR引物进行比较,利用设计的DPO引物扩增靶基因,经琼脂糖凝胶电泳检测扩增效果。
1.6 DPO-PCR灵敏度实验
将菌体浓度约为1.51×107CFU/mL的LM进行10倍梯度稀释,使用试剂盒提取每个稀释度细菌DNA,以此作为模板进行DPO-PCR扩增,经琼脂糖凝胶电泳检测以确定该方法的灵敏度。
1.7 DPO-PCR特异性实验
利用建立的DPO-PCR方法检测1.1中所示菌株,以验证该方法的特异性。
1.8 方法的实践验证
将建立的单核细胞增生李斯特氏菌DPO-PCR检测方法用于实际检测工作中,并与国标检测法(GB/T 4789.30-2008食品卫生微生物学检验-单核细胞增生李斯特氏菌检验)进行比较,以验证该方法的可行性。
2 结果与分析
2.1 DPO-PCR检测方法的建立
以单核细胞增生李斯特氏菌iap基因为靶基因,设计DPO引物,建立了单核细胞增生李斯特氏菌DPOPCR检测方法(图1)。
2.2 DPO-PCR退火温度不敏感性
结果显示,在48~68℃退火温度范围内,利用DPO引物均能够高效扩增出靶基因且无非特异性条带产生(图2-B),说明DPO引物退火温度范围较宽,而常规PCR引物则存在最适退火温度(图2-A)。
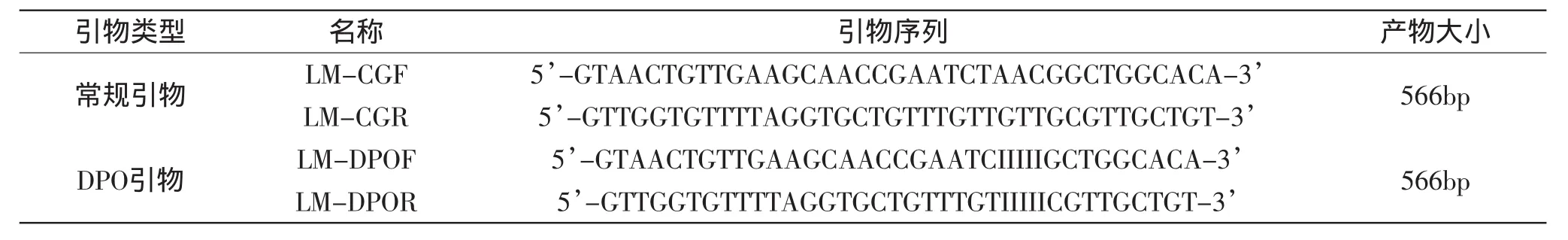
表1 引物序列Table 1 Primers used in this work
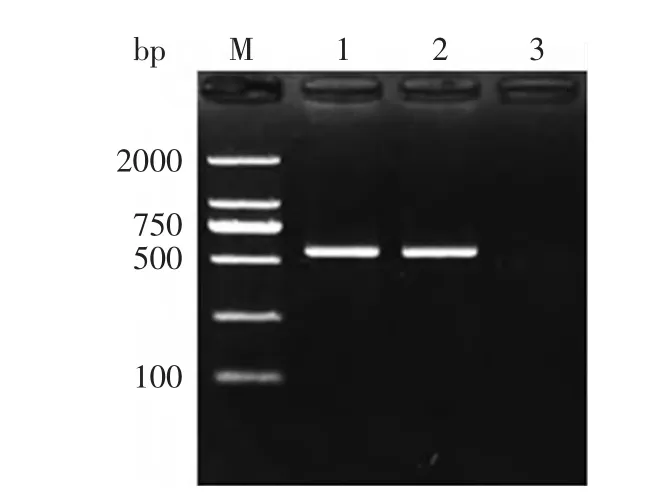
图1 单核细胞增生李斯特氏菌DPO-PCR检测方法的建立Fig.1 Development of DPO-PCR method for LM注:M:DNA marker 2000;1,2:DPO-PCR阳性结果;3:阴性对照。
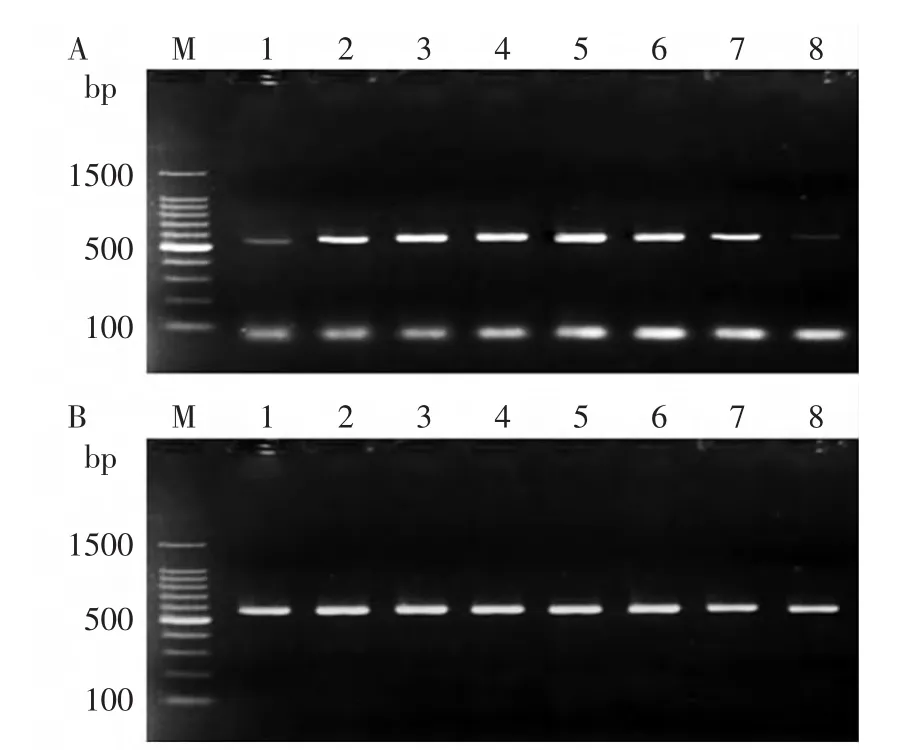
图2 DPO-PCR方法退火温度不敏感性Fig.2 Annealing temperature insensitivity of DPO-PCR method注:A:常规PCR结果;B:DPO-PCR结果;M:DNA marker 100 ladder;1~8:48.3、51.4、53.7、56.4、59.1、61.7、66.1、68.0℃。
2.3 DPO-PCR方法的灵敏度
结果显示,所建立的DPO-PCR方法能够有效检测出浓度为1.51×102CFU/mL的单核细胞增生李斯特氏菌,说明该方法的检测灵敏度为151CFU/mL。
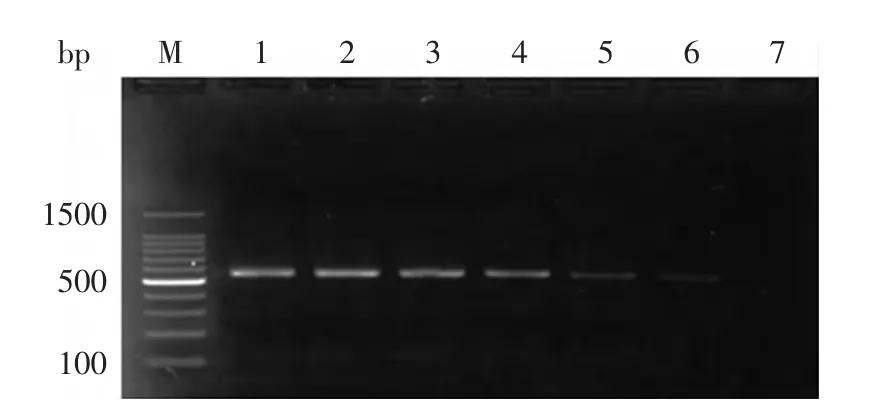
图3 单核细胞增生李斯特氏菌DPO-PCR检测方法灵敏度Fig.3 Detection sensitivity of DPO-PCR method for LM注:M:DNA marker 2000;1:1.51×107CFU/mL;2:1.51×106CFU/mL;3:1.51×105CFU/mL;4:1.51×104CFU/mL;5:1.51×103CFU/mL;6:1.51×102CFU/mL;7:1.51×101CFU/mL。
2.4 DPO-PCR方法的特异性
结果显示,利用建立的DPO-PCR方法检测1.1所示菌株,仅单核细胞增生李斯特氏菌为阳性结果,其他菌株为阴性结果,且无非特异性反应(图4-B,C),而常规PCR方法存在非特异性反应(图4-A),说明DPO-PCR方法的特异性较强。
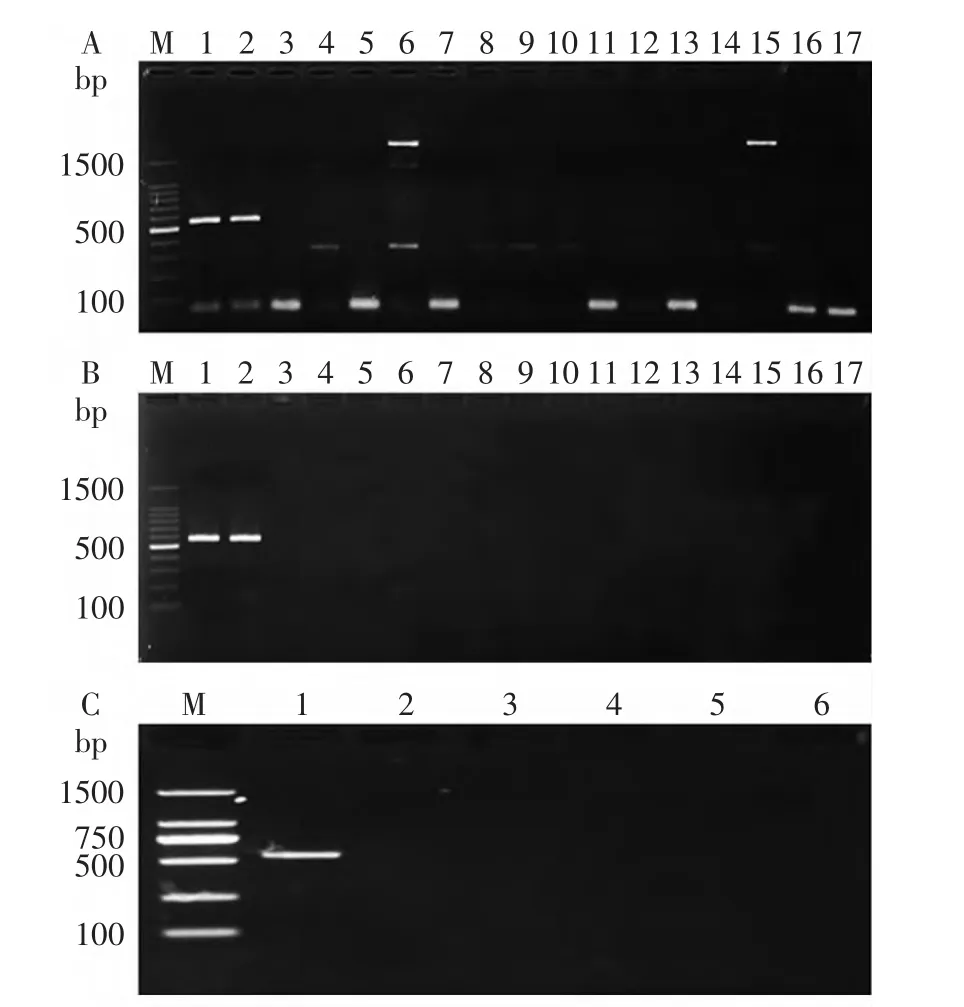
图4 单核细胞增生李斯特氏菌DPO-PCR检测方法特异性Fig.4 Specificity of DPO-PCR method for LM注:A:常规PCR方法特异性结果;B:DPO-PCR方法特异性结果;M:DNA marker 2000;1~17为:单核细胞增生李斯特氏菌(ATCC 19111),单核细胞增生李斯特氏菌(ATCC 7644),肠出血性大肠杆菌O157∶H7(ATCC 35150),嗜水气单胞菌(ATCC 7966),空肠弯曲菌(ATCC 33560),阪崎肠杆菌(ATCC 51329),沙门氏菌(ATCC 10708),霍乱弧菌(ATCC 14035),副溶血弧菌(ATCC 27519),溶藻弧菌(ATCC 33839),创伤弧菌(ATCC 33149),志贺氏菌(ATCC12022),金黄色葡萄球菌(ATCC29213),粘质沙雷菌(ATCC 14756),变形杆菌(ATCC 49027),溶血性链球菌(CMCC 32121),小肠结肠炎耶尔森氏菌(ATCC 9610);C:DPO-PCR特异性结果;M:DNA marker 2000;1~6为:阳性对照,阴性对照,英诺克李斯特氏菌(ATCC 33090),绵羊李斯特氏菌(ATCC 19119),西尔李斯特氏菌(ATCC 35967),威尔斯李斯特氏菌(ATCC 35897)。
2.5 方法的实践验证
利用建立的DPO-PCR检测方法对130份涉及进出口食品样品、市场流通食品样品和人工样本进行了检测,共检出9份单核细胞增生李斯特氏菌阳性样本,经国标法(GB/T 4789.30-2008)验证符合率为100%(见表2),而常规PCR法出现了3份假阳性结果,显示出所建立的DPO-PCR方法具有良好的可靠性和实用性。
3 结论与讨论
以PCR技术为代表的核酸检测方法,引物设计是保证结果准确、可靠的前提条件。在设计常规PCR引物时,需要反复优化引物的各项参数以及在实验中优化PCR反应的退火温度,以实现靶基因的高效率扩增。此外,为确保扩增反应的特异性,对引物序列还需要反复BLAST分析,操作较繁琐,特别是在设计多重PCR检测方法时,为获得较理想的PCR引物组和反应条件,需要的工作量则更大。
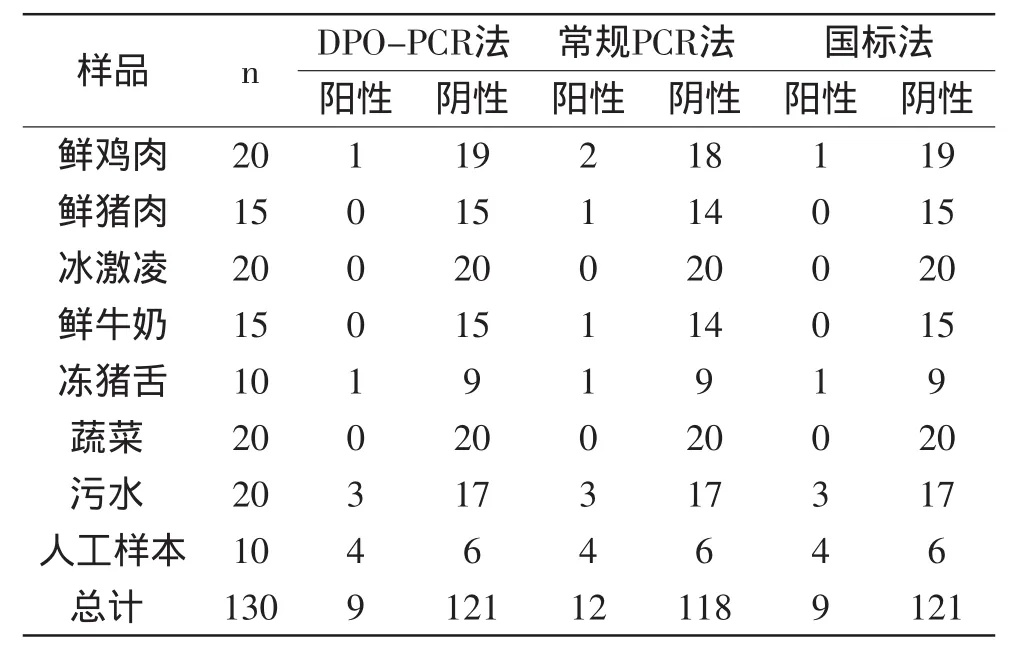
表2 DPO-PCR检测方法的实践应用Table 2 Application of the DPO-PCR method in practice
本研究引入了一种新型的PCR引物设计方法,即双启动寡核苷酸引物(Dual-Priming Oligonucleotide,DPO),建立了单核细胞增生李斯特氏菌DPO-PCR检测方法。与常规PCR引物相比,DPO引物设计相对简单,实验中只需先确定DPO引物的短3’-端,长度在6~15bp,保证其GC含量在40%~80%范围内,然后反相延伸18~25bp,使其Tm值大于65℃,形成DPO引物的长5’-端,中间用多聚次黄嘌呤(poly I)连接,即完成DPO引物设计,不需要优化引物的各项参数,简化了PCR引物设计步骤。与常规PCR引物存在最适退火温度相比,DPO引物的特殊结构赋予了其较宽的退火温度范围,实验中,DPO引物在48~68℃退火温度内均可获得靶基因序列的高效率扩增且无非特异性扩增反应,所以不需要对退火温度进行优化,省时省力。DPO引物也为建立多重PCR方法提供了更佳便捷的途径。
此外,DPO引物的特异性比常规PCR引物更强。由于DPO引物中poly I的氢键结合力弱,扩增时,如果DPO引物5’-端或3’-端有3个以上碱基错配,引物就会与模板脱离,而终止反应,有效地阻断了非特异性扩增,而引物自身以及引物间难形成二级结构,更提高了扩增效率[15]。特异性实验结果显示,利用DPOPCR方法能够准确地鉴别出目标菌,与其他菌株无交叉反应及非特异性扩增,常规PCR方法的特异性表现相对较差。实践应用证明,建立的DPO-PCR方法的检测结果更加准确,显示了良好的可靠性和实用性,为单核细胞增生李斯特氏菌的检测提供了更加可靠的手段。
[1]Vázquez-Boland JA,Kuhn M,Berche P,et al.Listeria pathogenesisand molecularvirulence determinants[J].Clin Microbiol Rev,2001,14(3):584-640.
[2]Rebagliati V,Philippi R,Rossi M,et al.Prevention of foodborne listeriosis[J].Indian J Pathol Microbiol,2009,52:145-149.
[3]吴晓薇,徐成刚,马保华,等.广州地区禽产品单核细胞增生性李斯特菌污染情况调查[J].中国家禽,2011,33(20):65-66.
[4]赵薇,刘桂华,王艳秋,等.食品中单核细胞增生李斯特菌污染及耐药状况调查[J].中国卫生检验杂志,2012,22(6):1394-1395.
[5]王刚,邱阳,王秋艳,等.食品中单核细胞增生李斯特氏菌快速检验的进展[J].检验检疫科学,2007,17(S):87-89.
[6]Liu DY,Ainsworth AJ,Austin FW,et al.Use of PCR primers derived from a putative transcriptionalregulatorgene for species-specific determination of Listeria monocytogenes[J].Int J Food Microbiol,2004,91:297-304.
[7]刘海泉,赵强,孙晓红,等.多重PCR快速检测食品中的单核细胞增生性李斯特菌[J].中国农业科学,2010,43(23):4893-4900.
[8]NotermansSH,DufrenneJ,LeimeisterW,etal. Phosphatidylinositol-specific phospholipase C activity as a marker to distinguish between pathogenic and nonpathogenic Listeria species[J].Appl Environ Microbiol,1991,57:2666-2670.
[9]Revazishvili T,Kotetishvili M,Stine OC,et al.Comparative analysis ofmultilocus sequence typing and pulsed field gelelectrophoresis for haracterizing Listeria monocytogenes strains isolated from environmental and clinical sources[J].J Clin Microbiol,2004,42(1):276-285.
[10]Long F,Zhu XN,Zhang ZM,et al.Development of a quantitative polymerase chain reaction method using a live bacterium as internal control for the detection of Listeria monocytogenes[J].Diagn Microbiol Infect Dis,2008,62:374-381.
[11]徐义刚,崔丽春,李丹丹,等.食品中单核细胞增生李斯特菌DNA环介导恒温扩增快速检测方法的建立[J].食品科学,2012,33(16):137-141.
[12]Chun J Y,Kim K J,Hwang I T,et al.Dual priming oligonucleotide system for the multiplex detection of respiratory viruses and SNP genotyping of CYP2C19 gene[J].Nucleic Acids Res,2007,35(6):e40.
[13]刘梅,黄新,马占鸿,等.应用DPO引物检测马铃薯病毒的多重RT-PCR技术研究[J].植物病理学报,2009,39(4):431-434.
[14]Woo H Y,Park H,Kim B I,et al.Evaluation of dual priming oligonucleotide(DPO)-based multiplex PCR for detection of HBV YMDD mutants[J].Arch Virol,2008,153(11):2019-2025.
[15]徐焕洲,平芮巾,季汝武,等.应用DPO引物技术同时检测5种蚊媒病毒的多重RT-PCR方法[J].中国国境卫生检疫杂志,2012,35(2):73-75.
Dual-priming primers-based PCR method for specific detection of Listeria monocytogenes
XU Yi-gang1,LI Dan-dan2,ZHANG Bai-qi3,LIU Zhong-mei1,WEI Dong-xu1,LIU Xin-liang1,LI Su-long1,*
(1.Technical Centre of Heilongjiang Entry-exit Inspection and Quarantine Bureau,Harbin 150001,China;2.Technical Centre of Hainan Entry-exit Inspection and Quarantine Bureau,Haikou 570125,China;3.Liaoning Entry-exit Inspection and Quarantine Bureau,Dalian 116001,China)
In this study,a Dual-priming oligonucleotide(DPO)-based PCR method for specific detection of L.monocytogenes was developed with iap gene as target.Annealing temperature insensitivity,specificity and detection sensitivity of the DPO-PCR method were tested and its preliminary application was carried out in practice.Results showed that the detection sensitivity of the DPO-PCR method was 151CFU/mL.In the annealing temperature insensitivity test,compared with conventional PCR primers,DPO primers were able to efficiently amplify target gene in the annealing temperature range of 48~68℃.In the specificity test,the DPOPCR method showed a higher specificity for the target bacteria than conventional PCR method and no nonspecific amplification reactions were observed in DPO-PCR.In practice,9 L.monocytogenes positive samples from 130 samples were detected by the DPO-PCR method,which was in accordance with the testing results according to GB/T 4789.30-2008,showing a better practicability.The DPO-PCR provided a new method for fast and accurate detection of L.monocytogenes.
Listeria monocytogenes;iap gene;DPO-PCR method
TS207.4
A
1002-0306(2014)10-0086-04
10.13386/j.issn1002-0306.2014.10.010
单核细胞增生李斯特氏菌(Listeria monocytogenes,LM)是一种人畜共患病病原菌,可引起败血症、脑膜炎和单核细胞增多等临床症状[1-2]。LM在自然界中广泛存在,常见于地表水、污水、土壤、青储饲料和腐败蔬菜中。LM也是一种食源性致病菌,主要通过食入被污染的鸡肉、鲜奶、冰激凌、色拉、冻猪舌、生牛排、蔬菜而感染[3-4]。该菌在4℃环境中仍可生长繁殖,是冷藏食品威胁人类健康的主要病原菌之一。因此,快速而准确的检测方法是预防LM感染和保障食品安全的重要手段。
2013-09-26 *通讯联系人
徐义刚(1978-),男,博士,高级兽医师,研究方向:微生物检测技术。
国家质检总局科技计划项目(2012IK157);质检公益性行业科研专项(201310126)。

