不同生长条件对铜绿微囊藻生长的影响
张 艳,马 放,李圭白
(哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 150090)
大规模的蓝藻水华现象严重破坏生态平衡,降低水源水质[1],造成巨大的经济损失,同时也使水处理工艺面临严峻的考验。无论是传统的混凝、沉淀和高级氧化工艺[2,3],还是新兴的膜 分 离技术[4,5],处理效果均与藻细胞个数及其胞外分泌物(extracellular organic matter,EOM)浓度有着紧密的联系[6]。为了增强出水效果,通常会采取适当措施调整相关运行参数,如水温、流速等[7-9]。然而,对于含藻水而言,上述调整因子不仅会改变处理过程中细胞表面官能团、分子间作用力和水体动力学特征,而且会干扰了藻细胞本身的生长代谢,并最终可能对处理效果带来严重的负面影响[10-12]。
因此,本文以铜绿微囊藻作为试验对象,选择部分水处理工艺中的运行参数(包括温度、光照强度和振动等),研究其对藻细胞数量和胞外分泌物浓度的影响。以期掌握水温、光照条件和水流条件对藻细胞生长代谢的影响。考察其对不同环境条件的适应性,为含藻水处理工艺的研究奠定理论依据,对研究相关处理方法具有十分重要的理论价值和指导意义。
1 材料及方法
本试验使用的铜绿微囊藻藻种购自中国科学院水生生物研究所。采用BG-11培养基在锥形瓶内对铜绿微囊藻进行连续培养30 d,定期观察藻细胞生长情况并利用溶解性有机物浓度(dissolved organic matter,DOC)评价EOM的浓度变化。在无特殊标注的情况下,所有试验的初始藻细胞浓度均约1×105个/L,培养温度为20~24℃,培养液pH约8,全程光照为3000 lux并处于静态培养状态。在每个具体试验周期内,会改变相应的试验参数,而其他条件不变。
试验中采用平板计数法记录藻细胞浓度变化。对于藻细胞胞外分泌物浓度,会先将水样在测定前先经过0.45μm滤膜过滤,之后采用总有机碳分析仪(TOC-VCPN,SHIMADZU,JAPAN)进行测定。
2 试验结果与讨论
2.1 温度对藻细胞生长的影响
由图1可知当水温从10℃升至30℃时,在生长稳定期可达到的最高浓度随温度的升高而迅速增加。当水温为30℃时,在培养的第16 d藻细胞数量达到2.6×1010个/L,是10℃时的20倍,同时前者在衰亡期的下降速率也呈现相对缓慢的趋势。然而进一步增加水温至35℃时,不仅藻细胞生长速率变慢,而且生长衰亡期提前(几乎从第15 d开始细胞浓度迅速下降)。分析认为在此温度条件下,藻细胞内的某些代谢过程由于高温受到抑制,其最高藻细胞浓度仅为1.3×1010个/L。
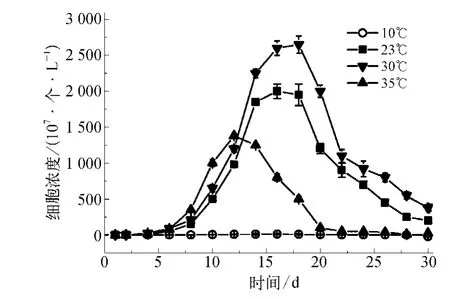
图1 不同水温条件下藻细胞的生长曲线Fig.1 Growth Curves of Algal Cells at Different Temperature
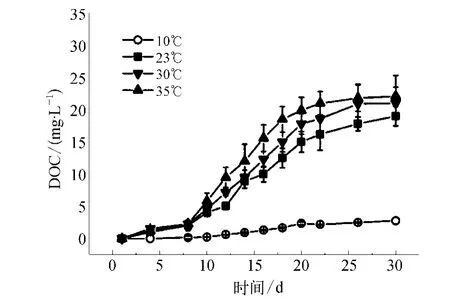
图2 不同水温条件下胞外分泌物浓度变化规律Fig.2 Changes of EOM at Different Temperature
图2证实EOM的增加速率随温度的增加而逐渐增大。当水温在10~30℃时,随着藻细胞个数的增加,胞外分泌物的浓度也随之升高。与图1相反,当温度升至35℃时,相比30℃时胞外分泌物的浓度进一步增加。分析认为过高的温度改变了藻细胞正常的代谢速率。高温在藻细胞培养的初始阶段促进了藻细胞的生长,同时也加速了藻细胞的破裂,导致更多的胞内分泌物扩散到外部环境。因此在实际水处理工艺中,应注意原水水温变化,适时调整混凝药剂投加量,以便获得最佳处理效果。
2.2 光照对铜绿微囊藻细胞生长的影响
自养生活需要依靠光合作用合成有机物,因此光照是影响光合作用的最重要的因素之一[13]。由图3可知在光强为1000~5000 lux时,最高藻细胞浓度经历了一个快速上升的过程后很快趋于稳定,最佳光照条件在4000 lux附近。光强接近5000 lux时,在生长稳定期中藻细胞最大浓度与4000 lux时接近。当光强仅为1000 lux时,其生长稳定期的最大值亦达到4000 lux时的60%。这说明铜绿微囊藻细胞能相对有效利用弱光进行光合作用。
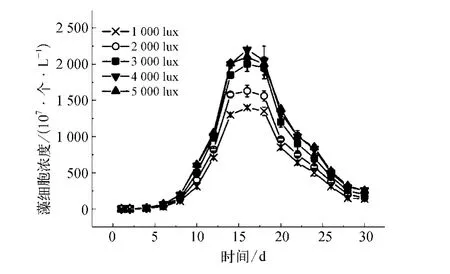
图3 不同光照强度下藻细胞的生长曲线Fig.3 Growth Curves of Algal Cells at Different Light Intensity
图4对比了当光照强度一定时(3000 lux),不同光照周期对藻细胞生长的影响。相比连续光照,适度降低光照时间(光照/黑暗比:18/6、12/12),藻细胞生长速率并无明显变化。进一步降低光照时间至6/18时,可观察到藻细胞生长速率明显下降的现象,且生长对数期推迟。对于光照浮游植物,光合作用有光反应和暗反应两个过程,一般连续光照会降低暗反应即酶促反应的速度,使得藻细胞生长速率变缓[14]。然而,过度降低光照时间,同样会降低光反应。在一些特殊水处理工艺中(比如投加粉末活性炭),反应器中光照强度会明显下降,这对细胞完整性的影响十分明显[15]。

图4 不同光照时间下藻细胞的生长曲线Fig.4 Growth Curves of Algal Cells at Different Lighting Time
水处理过程中一般不需要考虑光照因素的影响。但在某些特殊情况下(比如在浸没式膜反应器中一次性投加大量粉末活性炭做预处理工艺),反应器中光照强度会明显下降,此时需要考虑反应器内聚集的藻细胞出现大量死亡并破裂的可能性,因为这对反应器中有机物浓度变化有着十分重要的影响[16]。
2.3 振动对铜绿微囊藻细胞生长的影响
在实验室培养过程中,培养液一直处于静止状态;但在天然水体中,藻类的生长环境并不是静止不动的[17]。为了研究水体流动对藻细胞生长的影响,本试验中采用磁力搅拌器模拟扰动条件(转速分别为0、50、150、200r/min)以测定藻细胞的生长代谢情况。由图5和图6可知随着扰动频率的增加,细胞生长速率逐渐变缓。当扰动频率在50r/min时,相比未扰动,藻细胞的生长速率变慢,但随着培养时间的增加,藻细胞的繁殖速率逐渐增加,虽然其生长对数期延后,但其藻细胞能达到的最大浓度与空白试验的数据接近。说明在培养的初始阶段,扰动导致藻细胞生长出现延迟,但经过一定适应期后藻细胞生长状态恢复。但是当扰动频率达到150r/min时,藻细胞最高浓度降低(1.6×1010个/L)。进一步提高扰动频率达到200r/min时,在生长对数期最高藻细胞浓度仅为0.8×1010个/L。剧烈的扰动还影响了铜绿微囊藻细胞的代谢过程,降低了分泌物的产生(如图6)。分析认为,扰动一方面会通过影响藻细胞的光合作用以及对营养盐的吸收效率等代谢过程抑制藻细胞的增殖;另一方面,可能会直接造成细胞壁的破裂。
在膜过滤过程中,利用曝气或对膜组件进行竖直或水平方向的振动等方法均会使反应器内水体产生强烈的扰动[18,19],这对膜污染能起到很好的缓解效果。但是,在调整曝气强度或振动频率时需要考虑其对藻细胞活性的影响,避免部分藻细胞破裂带来污染物增多的现象出现。
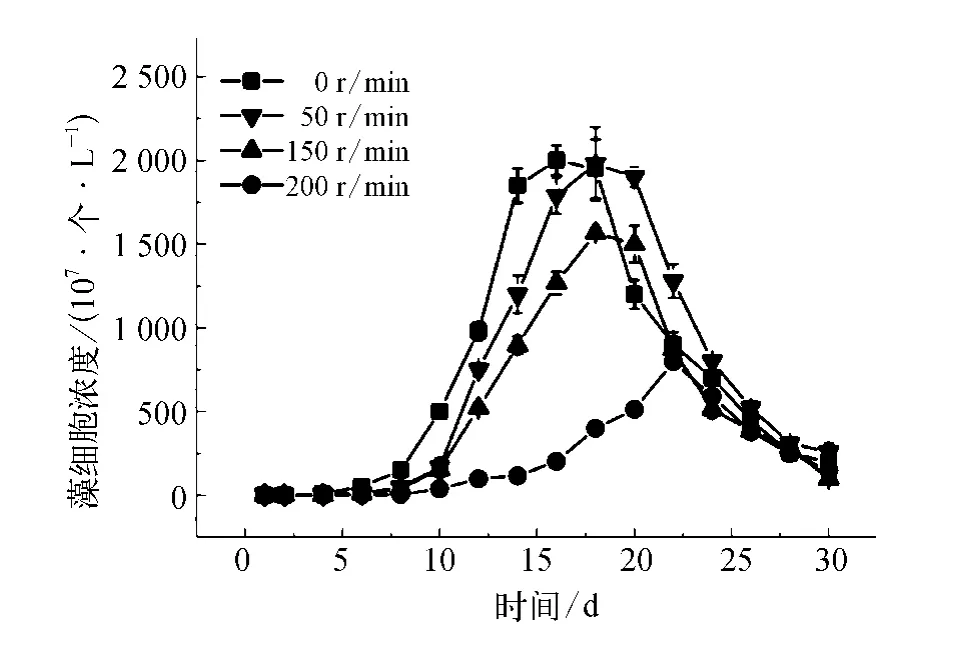
图5 不同振动频率下藻细胞的生长曲线Fig.5 Growth Curves of Algal Cells atDifferent Vibration Frequency
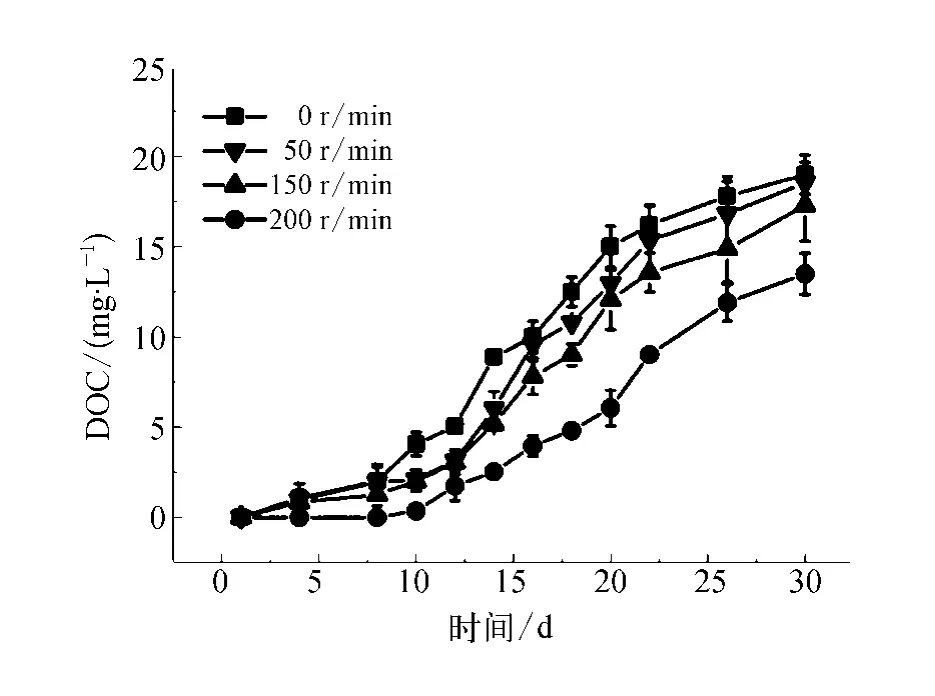
图6 不同振动频率下胞外分泌物浓度变化规律Fig.6 Changes of EOM at Different Vibration Frequency
3 结论
本文研究了不同生长条件下铜绿微囊藻细胞个数及其分泌物浓度变化规律,通过定量分析得到如下结论。
(1)水温的升高有助于加速藻细胞的生长代谢,但过高的温度(超过30℃)会在抑制藻细胞生长的同时破坏细胞壁完整性。
(2)试验中,铜绿微囊藻受光照影响并不十分敏感,能有效利用弱光进行光合作用。
(3)不剧烈的扰动对铜绿微囊藻的生长几乎没有影响,但在剧烈扰动(转速为200r/min)的情况下藻细胞的生长则会受到严重干扰。
[1]杨峰峰,何圣兵,戴鼎立,等.藻类混养生长机能与水华爆发的关系[J].净水技术,2012,31(1):4-8,15.
[2]Wachter J K,Andelman J B.Formation on Chlorination of Algal Extracellular Products [J]. Environmental Science and Technology,1984,18(11):811-817.
[3]Steynberg M C,Pieterse A J H,Geldenhuys J C.Improved Coagulation and Filtration as a Result of Morphological and Behavioural Changes Due to Pre-oxidation [J].Journal of Water Supply:ResearchandTechnology-AQUA, 1996,45(6):292-298.
[4]Zazouli M A,Nasseri S,Ulbricht M.Fouling Effects of Humic and Alginic Acids in Nanofiltration and Influence ofSolution Composition [J].Desalination,2010,250(2):688-692.
[5]Castaing J B,Masse A,Pontie M,et al.Investigating Submerged Ultrafiltration(UF)and Microfiltration(MF)Membranes for Seawater Pre-treatment Dedicated to Total Removal of Undesirable Micro-algae[J].Desalination,2010,253(1-3):71-77.
[6]Her N,Amy G,Park H R,et al.Characterizing Algogenic Organic Matter(AOM)and Evaluating Associated NF Membrane Fouling[J].Water Research,2004,38(6):1427-1438.
[7]Truax D D,Shindala A.A Filtration Technique for Algal Removal from Lagoon Effluents[J].Water Environment Research,1994,66(7):894-899.
[8]Fane A G,Fell C J D,Suki A.The Effect of pH and Ionic Environment on the Ultrafiltration of Protein Solution with Retentive Membranes [J].Journal of Membrane Science,1983,16:195-210.
[9]Susanto H,Arafat H,Janssen E M L,et al.Ultrafiltration of Polysaccharide-Protein Mixtures:Elucidation of Fouling Mechanisms and Fouling Control by Membrane Surface Modification [J].Separation and Purification Technology,2008,63(3):558-565.
[10]Chapman B R,Ferry B W,Ford T W.Phytoplankton communities in water bodies at Dungeness,U.K.:analysis of seasonal changes in response to environmental factors[J].Hydrobiologia,1998,362:161-170.
[11]Figueredo C C,Giani A.Seasonal variation in the diversity and species richness of phytoplankton in a tropical eutrophic reservoir[J].Hydrobiologia,2001,445:165-174.
[12]张艳.浸没式超滤膜处理含藻水及膜污染控制研究[D].哈尔滨:哈尔滨工业大学,2011.
[13]Steemann E N,Hansen V K,Jorgensen E G.The adaptation to different light intensities in Chlorella vulgaris and thetime dependenee on transfer to a new light intensity [J].Physiologia Plantarum,1962,15(3):505-517.
[14]吕晋.浅水湖泊浮游植物生长影响因子及修复评价指标体系研究[D].武汉:华中科技大学,2012.
[15]Zhang Yan,Tian Jia Yu,Nan Jun,et al.Effect of PAC addition on immersed ultrafiltration for the treatment of algal-rich water[J].JournalofHazardousMaterials, 2010,186(2-3):1415-1424.
[16]Zhang Y,Tian J Y,NAN J,et al.Effect of PAC addition on immersed ultrafiltration for the treatment of algal-rich water[J].Journal of Hazardous Materials,2010,186(2-3):1415-1424.
[17]Xie L Q,Xie P,Li S X,et al.The low TN∶TP ratio,a cause or a result of Microcystis blooms[J].Water Research,2003,37(9):2073-2080.
[18]Zhang Y,Tang C Y,Li G B.The role of hydrodynamic conditions and pH on algal-rich water fouling of ultrafiltration. Water Research,2012,46(15):4783-4789.
[19]Akoum O A,Jaffrin M Y,Ding L H,et al.An hydrodynamic investigation of microfiltration and ultrafiltration in a vibrating membrane module [J].Journal of Membrane Science,2002,197(1-2):37-52.

