COX多因素分析和ROC曲线综合评价DNA修复基因对鼻咽癌的预后价值
杨 姣,蒿艳蓉,冯国生,陈甲信,邓 珊,庞 强,秦 俭
(广西壮族自治区 人民医院 临床肿瘤中心,广西 南宁 530021)
研究论文
COX多因素分析和ROC曲线综合评价DNA修复基因对鼻咽癌的预后价值
杨 姣,蒿艳蓉*,冯国生,陈甲信,邓 珊,庞 强,秦 俭
(广西壮族自治区 人民医院 临床肿瘤中心,广西 南宁 530021)
目的应用COX多因素分析和ROC曲线探讨DNA修复基因对鼻咽癌的预后价值。方法收集2007年5月至2012年2月经广西壮族自治区人民医院病理科确诊为鼻咽癌且选择调强放射治疗的患者100例。筛选随访时间超过1年的患者共71例,用免疫组化SP法检测鼻咽癌组织中DNA修复基因DNA-PKcs及BRCA1的表达。用Spearman分析DNA-PKcs和BRCA1的表达水平与临床特征的相关性;ROC曲线法建立预后分组,用Kaplan-Meier生存曲线对DNA-PKcs、BRCA1的表达与预后关系进行单因素分析;Cox比例风险回归对预后进行多因素生存分析。结果1)DNA-PKcs的表达水平和患者的生存时间呈正相关(Plt;0.05)。2)DNA-PKcs高表达患者的生存时间长于低表达的患者(Plt;0.01)。3)多因素生存分析,DNA-PKcs表达水平是影响预后的独立因素(Plt;0.01),而BRCA1表达水平未能得出类似结果。结论DNA-PKcs表达状态是影响预后的独立因素。DNA-PKcs高表达可能作为预测鼻咽癌患者预后较好的一个指标。
鼻咽癌;COX多因素分析;ROC曲线;DNA修复基因;预后
鼻咽癌(nasopharyngeal carcinoma)是我国常见的恶性肿瘤之一,好发于中国南方各省,世界上80% 的鼻咽癌发生在中国,鼻咽癌发病率居头颈部肿瘤的首位,发病年龄以30~50岁最为多见[1]。放射治疗是鼻咽癌的主要治疗手段,放射线通过其生物学效应作用于受照射细胞的遗传物质,导致细胞无法修复而死亡。但其中一些没有死亡但又无法完全修复的DNA末端可能参与染色体转录过程中的某些位点从而影响基因的稳定性[2]。本研究通过检测DNA修复基因DNA-PKcs、BRCA1在鼻咽癌组织中的表达水平并结合临床资料,利用COX多因素分析和ROC曲线综合评价DNA修复基因对鼻咽癌的预后价值,以期为患者的个体化治疗提供实验依据。
1 材料与方法
1.1 试剂
DNA-PKcs和BRCA1兔抗人单克隆抗体浓缩型、SP免疫组化检测试剂盒(兔)(北京博奥森公司)。
1.2 临床资料
1.2.1 病例资料:本研究收集2007年5月至2012年2月经广西壮族自治区人民医院临床肿瘤中心确诊入院并采取调强放射治疗的鼻咽癌患者100例。入组标准:1)经病理检查证实为鼻咽癌且尚未进行任何肿瘤专科治疗的初治患者,确诊病例均有保存完好的鼻咽癌石蜡病理标本;2) 按照鼻咽癌 (AJCC sixth Edition 2002)分期为Ⅰ、Ⅱ、Ⅲ、Ⅳa及Ⅳb期的患者;3)所有患者治疗前均经鼻咽+颅底+颈部MRI平扫+增强的检查证实具有可测量的肿瘤病灶且无远处转移;4)年龄17~76岁,PS评分≤2分;治疗前血常规、肝、肾功能及心电图各项指标均无异常;5)无合并症及放化疗禁忌者,无其他肿瘤病史;6)所有患者均签署知情同意书。所有标本均由10% 中性甲醛固定,常规脱水,石蜡包埋。采用免疫组织化学SP法染色。从患者出院后开始定期随访,随访日期截至2012年10月,中位随访31月,100例患者随访超过12月者71例。71例患者的临床资料见表1。

表1 71例鼻咽癌患者临床特征分布表
WHO.World Health Organization; AJCC.American Joint Committee on Cancer.
1.2.2 治疗方法:Ⅰ和Ⅱ期患者接受单纯根治性调强放射治疗(intensity modulated radiation therapy,IMRT)。Ⅲ期、Ⅳa和Ⅳb期患者接受铂类为主同步放化疗。具体IMRT方案:所有患者均采用仰卧位、热塑面罩固定头颈肩部,以层厚2 mm行CT增强扫描定位,数据重建后传入CMS或Pinnacle计划系统。勾画靶区包括:大体肿瘤体积(gross tumor volume,GTV),临床靶区(clinical target volume,CTV)、计划靶区 (planning target volume,PTV)及危及器官,制定IMRT计划,鼻咽大体肿瘤体积(GTV-nx)处方剂量68~72 Gy/30~32 f;颈部转移淋巴结(GTV-nd)处方剂量68~72 Gy/30~32 f;临床靶体积1(CTV1)58~62 Gy/30~32 f;临床靶体积2(CTV2)50~6 Gy/30~32 f。 计划验证合适后进行治疗。所有患者均接收根治性IMRT。化疗方案:DDP 40 mg/m2,1次/周,放疗期间同步应用6~7周,放疗第1天同步开始。
1.2.3 疗效评价方法:完成调强放射治疗或者同步放化疗后1个月,经鼻咽+颅底+颈部 MRI平扫+增强复查与治疗前MRI对比,原发灶退缩的近期疗效评价参照国际上通用实体瘤的疗效评价标准(response evaluation criteria in solid tumors,RECIST)。
1.3 病理实验
1.3.1 病理标本:选取上述病例中随访超过12个月且首诊在广西壮族自治区人民医院患者的鼻咽癌组织病例标本共71例。
1.3.2 方法:采用免疫组织化学S-P法。免疫组化结果评定:DNA-PKcs和BRCA1阳性物质表达定位于细胞系。由有经验的病理科主治医师在不知道任何临床和病理资料的情况下,通过光学显微镜,每张切片选5个高倍视野,每个视野计数100个细胞,观察肿瘤细胞免疫组化染色的情况并进行评分。根据阳性细胞百分比进行分组,阳性细胞计数 ≥50%定义为BRCA1高表达组;阳性细胞计数lt;50%及不表达者分别定义为BRCA1低表达组。统计分析时记(-)为低表达,(+)为高表达。
1.4 统计学分析
SPSS19.0软件进行统计学处理。计数资料应用Spearman进行相关性分析,单向无序计数资料采用χ2检验。ROC曲线法建立预后分组,应用Kaplan-Meier生存曲线对DNA-PKcs、BRCA1的表达水平与预后关系进行单因素分析,log-rank检验分析生存曲线的差异;以Cox比例风险模型对预后进行多因素生存分析。
2 结果
2.1鼻咽癌组织中DNA修复基因免疫组化表达情况
71例鼻咽癌患者中DNA-PKcs高表达45例(59.2%),低表达26例(40.8%);BRCA1高表达31例(42.2%),低表达40例(57.8%)(表2;图1,2)。

表2 DNA-PKcs和BRCA1在鼻咽癌组织中表达情况
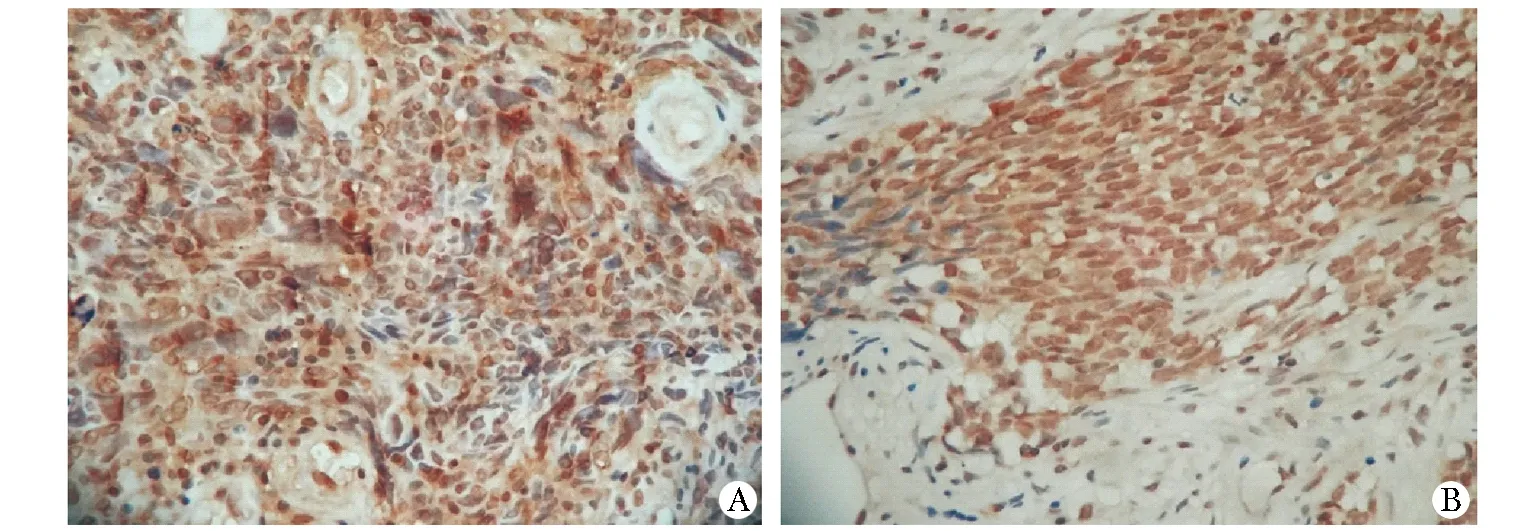
A.immunostaining for DNA-PKcs; B.BRCA1 in representative cases from the high DNA-PKcs groups and high BRCA1 groups; note the strong immunoreactivity predominantly in the nuclei of the tumor cells, magnification times
图1DNA-PKcs和BRCA1免疫组化结果
Fig1ImmunohistochemicalresultsofDNA-PKcsandBRCA1(×400)

图2 ROC曲线法建立患者预后分组示意图Fig 2 Using ROC curve to establish the prognosisof patients
2.271例DNA-PKcs与BRCA1蛋白表达与临床因素的相关性
2.2.1 DNA-PKcs、BRCA1表达情况与患者临床特征相关性分析:DNA-PKcs与BRCA1表达情况与患者的年龄、性别、病理分型、T分期、AJCC分期及近期疗效均无相关性(表3)。
2.2.2 根据ROC曲线法建立预后分组:根据ROC曲线把患者生存时间超过及等于32个月定义为预后较好组,生存时间小于32个月定义为预后较差组(Plt;0.05,图2),根据ROC曲线分组,DNA-PKcs的表达水平和患者的生存时间呈正相关(Plt;0.05)(表4)。
2.2.3 DNA-PKcs、BRCA1表达水平与预后单因素分析: 应用Kaplan-Meier生存曲线对DNA-PKcs、BRCA1表达水平与预后关系进行单因素分析,结果提示高表达患者的生存时间长于低表达的患者(Plt;0.01)(图3),不同BRCA1表达水平与患者生存时间关系无明显相关性(图4)。DNA-PKcs和BRCA1共同高表达组患者与非共同高表达组患者的生存曲线无明显相关性,但共同高表达组患者显示出生存时间更长的这种趋势(P=0.057)(图5)。
2.2.4 DNA-PKcs、BRCA1表达水平与预后多因素分析:应用Cox模型对预后进行多因素生存分析,结果显示DNA-PKcs表达水平是影响预后的独立因素,而BRCA1表达水平未能得出类似结果(表5)。
3 讨论
本研究首次报道了DNA修复基因DNA-PKcs和BRCA1在蛋白水平的表达情况和鼻咽癌远处转移的关系。通过单因素分析观察到:在鼻咽癌患者中,低表达DNA-PKcs者较高表达DNA-PKcs者更容易发生远处转移(图3)。DNA依赖蛋白激酶(DNA-dependent Protein kinas,DNA-PK),由3个亚基组成:Ku70、 Ku80以及DNA-PKcs,其中Ku70、 Ku80组成的二聚体是DNA-PK调节亚基, DNA-PKcs是DNA-PK催化亚基[3]。应用多因素分析最终得出DNA-PKcs高表达患者预后更好(表5)。但本课题假设的是:DNA-PKcs高表达患者应该具有更好的DNA修复能力,更容易产生放疗抵抗,最终导致预后更差。本研究结果显示,DNA-PKcs高表达者预后更好,这可能是因为DNA修复基因DNA-PKcs和BRCA1在维持基因稳定性方面也起着重要的作用[4],DNA修复基因高表达提示修复损伤的DNA能力较强,低表达则提示修复损伤的DNA能力较弱,未能修复的DNA末端可能参与染色体的转录过程中的某些位点从而影响基因的稳定性[5], 这种不可逆的损伤最终导致患者预后较差。同时DNA-PKcs的修复能力还与P53的表达水平密切相关,P53低表达但DNA-PKcs高表达者预后较好,P53高表达但DNA-PKcs低表达者预后较差[6]。不过产生这种现象的内在机制目前还不知道。再者,DNA-PKcs修复能力还受DNA-PK的活性调控,DNA-PK活性降低将会影响DNA修复能力,最终导致基因的不稳定以及染色体不可逆的损伤以及更高的远处转移发生率[7]。本研究得到和文献[8]相似的结果,其在胃癌中的研究表明,DNA-PKcs低表达患者,肿瘤进展快且预后较差。乳腺癌基因BRCA1(breast cancer gene 1) 最早被确定是在1990年[9]。本实验,没有观察到BRCA1的表达水平和临床结果的相关性(表4)。目前BRCA1在乳腺癌中的研究较多,但BRCA1的表达水平与乳腺癌的预后的关系尚未十分明确,BRCA1的表达水平与乳腺癌预后有关[10],BRCA1的表达水平与乳腺癌预后无关[11]。BRCA1蛋白参与许多不同而且复杂的细胞程序,而染色体对不同的诱变剂的敏感性不一样。因此,BRCA1的不同突变在DNA损伤的识别和处理上都会有不同。BRCA1在鼻咽癌中尚无相关研究,BRCA1与鼻咽癌患者预后的关系还需要继续研究。

表3 DNA-PKcs与BRCA1蛋白表达与临床因素的相关性
CR.complete response; Non-CR.non-complete response.

表4 DNA-PKcs及BRCA1表达水平与患者生存时间分析
*P﹤0.05 compared with DNA-PKcs(-).

图3 DNA-PKcs不同表达水平的鼻咽癌患者生存曲线Fig 3 Survival curves of different DNA-PKcs expressionlevels in patients with nasopharyngeal carcinoma

图4 BRCA1不同表达水平的鼻咽癌患者生存曲线Fig 4 Survival curves of different BRCA1 expressionlevels in patients with nasopharyngeal carcinoma

The upper and lower arm represent patients with overexpression of DNA-PKcs(+) and BRCA1(+)and the non-overexpression of them, respectively; the lower curves includes DNA-PKcs(+) /BRCA1(-), DNA-PKcs(-) /BRCA1(+) and DNA-PKcs(-) /BRCA1(-)图5 DNA-PKcs和BRCA1共同高表达组患者与非共同高表达组患者的生存曲线Fig 5 Survival curves in patients with nasopharyngealcarcinoma

表5 应用Cox模型对无转移生存率进行多因素生存分析Table 5 Using the Cox model for multi-factor survival analysis metastasis-free survival
总之,DNA-PKcs高表达患者的生存时间明显长于DNA-PKcs低表达患者,DNA-PKcs的表达水平可以作为预测鼻咽癌患者预后的一个生物指标。BRCA1暂未见BRCA1在鼻咽癌中的研究,BRCA1与鼻咽癌患者预后的关系还需要继续研究。
[1] Cho WC, Chen HY. Clinical efficacy of traditional Chinese medicine as a concomitant therapy for nasopharyngeal carcinoma: a systematic review and meta-analysis [J]. Cancer Invest, 2009, 27:334- 344.
[2] Someya M, Sakata K, Monobe M,etal. The association of DNA-dependent protein kinase activity with chromosomal instability and risk of cancer [J]. Carcinogenesis, 2006, 27:117- 122.
[3] Lieber MR, Gu J, Lu H,etal. Nonhomologous DNA end joining (NHEJ) and chromosomal translocations in humans[J]. Subcell Biochem. 2010;50:279- 296.
[4] Moraes MC, Neto JB, Menck CF. DNA repair mechanisms protect our genome from carcinogenesis[J]. Front Biosci, 2012, 1: 1362- 1388.
[5] Obe G, Durante M. DNA double strand breaks and chromosomal aberrations[J]. Cytogenet Genome Res, 2010, 128:8- 16.
[6] Friesland S, Kanter-Lewensohn L, Tell R,etal. Expression of Ku86 confers favorable outcome of tonsillar carcinoma treated with radiotherapy[J]. Head Neck, 2003, 25:313- 321.
[7] Someya M, Sakata KI, Matsumoto Y,etal. The association of DNA-dependent protein kinase activity of peripheral blood lymphocytes with prognosis of cancer[J]. Br J Cancer, 2011,104:1724- 1729.
[8] Lee HS, Choe G, Park KU,etal. Altered expression of DNA-dependent protein kinase catalytic subunit (DNA-PKcs) during gastric carcinogenesis and its clinical implications on gastric cancer[J]. Inter J Oncol, 2007,31: 859- 866.
[9] Hall JM, Lee MK, Newman B,etal. Linkage of early-onset familial breast cancer to chromosome 17q21[J]. Science, 1990, 250: 1684- 1689.
[10] Ruffner H, Joazeiro CA, Hemmati D,etal. Cancer PredisPosing mutations within the RING domain of BRCA1: loss of ubiquitin Protein ligase activity and Protection from radiation hyPersensitivity[J]. Proc Natl Acad Sci U S A, 2001, 98:5134- 5139.
[11] Baeyens A, Thierens H, Claes K,etal. Chromosomal radiosensitivity BRCA1 and BRCA2 mutation carriers[J]. Int J Radiat Biol, 2004,80:745- 756.
Combinating COX multivariate analysis with ROC curve to evaluatethe prognostic value of DNA repair gene in nasopharyneal carcinoma
YANG Jiao, HAO Yan-rong*, FENG Guo-sheng, CHEN Jia-xin, DENG Shan, PANG Qiang, QIN Jian
(Dept. of Chemotherapy, Clinical Cancer Center, People’s Hospital of Guangxi Zhuang Autonomous Region, Nanning 530021, China)
ObjectiveUsing COX multivariate analysis and ROC curve to evaluate the prognostic value of DNA repair gene in patients with nasopharyngeal carcinoma.MethodsFrom May 2007 to February 2012, all 100 untreated patients with NPC, who were planned to receive IMRT at the People’s Hospital of Guangxi Autonomous Region were enrolled into this study. Screening for more than 1 year follow-up of 71 cases, formalin-fixed tumor biopsy specimens from 71 untreated patients with NPC were analyzed by immunohistochemical methods. Spearman’s analysis was put into use in the correlation ofDNA-PKcsandBRCA1 expression level and clinical characteristics. Kaplan-Meier survival curves analyzed the relationship between expression ofDNA-PKcsandBRCA1 and prognostic groups which were established by ROC curves. And Cox proportional hazards regression multi-factor survival analysis was carried out on the prognosis at last.Results1)There was a significant positive correlation between the expression level of DNA-PKcs and survival time of patients (Plt;0.05). 2)Moreover, patients with high DNA-PKcs
expression survived longer than patients with low level of DNA-PKcs(Plt;0.01). 3) On multivariate analysis, only DNA-PKcs expression level was an independent prognostic factor(Plt;0.01). No significant association was found between the level ofBRCA1 expression and the clinical outcome.ConclusionsDNA-PKcs expression level is an independent factor in prognostic and the patients with high level had a longer survival.
nasopharyngeal carcinoma; COX multivariate analysis; ROC curve; DNA repair genes; prognosis
2013- 12- 27
2014- 04- 29
国家自然科学基金(81260348);广西卫生厅重点项目(桂卫重2010037)
*通信作者(correspondingauthor):yanronghao.2008@aliyun.com
1001-6325(2014)10-1333-06
R 739.62
A

