真蛸谷胱甘肽过氧化物酶和过氧化氢酶基因克隆、序列特性分析
洪婧妮,苏永全,毛 勇,孙田田,王 军
(厦门大学海洋与地球学院,福建 厦门361102)
真 蛸 (Octopus vulgaris)隶 属 于 软 体 动 物 门(Mollusca)、头足纲(Cephalopoda)、八腕目(Octopoda)、无须亚目(Incirrata)、蛸科(Octopodidae)、蛸属(Octopus),具有生活史短、生长速度快、食物转化率高、对饲养环境和人工运输具有较强的耐受力和适应力等诸多优良的养殖生物学特性[1-2].真蛸是暖温种,在26℃以上水温难于生存,有关其适宜生长温度已有所研究[3-4].
生物体在常态下保持体内活性氧的收支平衡,已有研究发现,高水温会使变温生物细胞吞噬活性增强,从而导致大量活性氧爆发[5-6],过量的自由基如未能及时清除,会对机体的脂质代谢、酶活性和DNA等造成严重损害[7].为了避免过剩的自由基对机体造成损伤,生物体内形成一套抗氧化系统,在清除过量自由基,保持机体活性氧动态平衡中起到了重要作用[8-10].
1957年Mills等在牛红细胞中发现谷胱甘肽(GSH)过 氧 化 物 酶 (glutathione peroxidase,GPX)[11],之后发现该基因为硒蛋 白,具 有催化 基团——硒代半胱氨酸(Selenocysteine,Sec U)[12-13].至今已发现了7种GPX种类,其中细胞内GPX1(cGPX)是第一个被发现的哺乳动物硒蛋白,也是目前克隆得到较多的类型.1863年首次发现一类具有分解过氧化氢作用的酶,1901年该酶被正式命名为过氧化氢酶(catalase,CAT),之后通过实验证实卟啉环是CAT的活性中心[14].这2个基因主要在抗氧化系统中起到了清除过氧化氢的作用,保护生物体免受过氧化氢过量积累所带来的损伤[15].
本文克隆了真蛸GPX(OvGPX)和真蛸CAT(OvCAT)基因全长,研究了2个基因氨基酸结构特性,以及其在高温条件下的表达特征,以期诠释真蛸抗氧化酶蛋白的功能,揭示环境胁迫下OvGPX和OvCAT蛋白对于真蛸的保护作用,为真蛸的良种选育和资源保护等方面提供基础资料和理论依据.
1 材料与方法
1.1 实验动物的暂养和取样
本文所用的真蛸来自福建省霞浦县北壁海区,带回实验室以活蟹和贝类喂食、蓄养1周(水温22~24℃,盐度26~27)后:1)选活泼正常的真蛸,取其消化腺置于由百泰克公司购买的RNA fixer保存液中,4℃过夜后移入-20℃冰柜保存、备用;2)选28只健康活泼的个体,经相应水温驯化恒定后,分别暂养在4个温度组(24,26,28,30℃)中,每个温度组7只个体,2h后各组随机取3只个体,分别取其消化腺和栉鳃,同上处理保存备用.
1.2 RNA提取、cDNA合成和基因全长的获得
总RNA提取利用Trizol方法,Trizol试剂购自TaKaRa公司,具体实验步骤按说明书进行.提取的RNA样品存放于-80℃冰箱中保存,采用ND1000微量紫外-可见分光光度计检测RNA的纯度和浓度;RNA第1链反转录采用TaKaRa公司的Reverse Transcriptase M-MLV 试 剂 盒 进 行,利 用 Oligo dT-RA为反转录引物,反转录实验根据说明书操作,所得cDNA用作3′RACE模板.
反转录后的第1链cDNA,用NEB公司的RNahase试剂在37℃降解1h,加入2倍体积乙醇于-20℃ 静置30min,4℃离心沉淀30min,加入超轻水(DDW)溶解,作为5′加尾的模板.5′加尾反应体系为:19μL cDNA溶液,依次加入5×TdT缓冲液10μL,TdT 酶 (15U/μL)1μL,dATP(0.5mmol/L)2.5 μL,0.1%(质量分数)牛血清白蛋白(BSA)5μL,加DDW补齐至50μL,试剂均购自TaKaRa公司,37℃温育30min,所得即为5′端模板.
利用cDNA 末端快速克隆(rapid amplification of cDNA ends,RACE)[16]的方法对 OvGPX 和 OvCAT基因全长进行克隆,基因片段序列源自本实验室构建的真蛸神经系统转录组文库[17],片段用于进一步扩增.设计参与3′RACE的特异性引物分别为GPX-F1、GPX-F2、CAT-F1、CAT-F2;5′RACE 的反应特异性引物为 GPX-R1、GPX-R2、CAT-R1、CAT-R2(引物序列详见表1).
PCR产物经琼脂糖凝胶电泳后,利用鹭隆公司的凝胶回收试剂盒进行胶回收;将纯化后的PCR产物利用TaKaRa公司的pMD19-T载体进行克隆,用DH5α感受态细胞进行转化,感受态细胞试剂盒购自鹭隆公司,具体操作步骤根据说明书进行.转化后氨苄培养基培养16h,随机挑选6个克隆,PCR反应和琼脂糖凝胶检测后送南京金斯瑞公司测序.
1.3 序列分析和多重序列比对
通过 Blast(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi)查找同源序列,利用ClustalX和Dnaman软件进行多序列同源比对;以ORFfinder(http:∥www.ncbi.nlm.nih.gov/gorf/orfig.cgi)进行开放阅读框(ORF)查找;在线 Protparam (http:∥web.expasy.org/cgi-bin/protparam/protparam)软件分析氨基酸序列组成、分子质量和等电点;Smart在线软件、Interproscan在线软件预测编码蛋白的基因特征基序、功能域(http:∥www.ebi.ac.uk/Tools/pfa/iprscan/、http:∥smart.embl-heidelberg.de/);利用 SECISearch2.19在 线 软 件 (http:∥genome.unl.edu/SECISearch.html)预测GPX是否存在硒半胱氨酸(Sec)插入序列(SECIS)结构;利用 NetNGlyc软件(http:∥www.cbs.dtu.dk/services/NetNGlyc/)预测GPX和CAT糖基结合位点.
1.4 实时定量PCR(qPCR)检测不同温度下OvGPX和OvCAT的基因表达变化
为了解OvGPX和OvCAT基因在不同温度应激下的表达变化,本文以不同温度组的消化腺和栉鳃的cDNA第1链为模板进行qPCR反应.RNA提取和反转录反应分别采用百泰克公司的RNA Plus试剂盒和TaKaRa公司的 PrimeScript®RT reagent Kit试剂盒,按说明书进行实验操作.应用TaKaRa公司的SYBR Premix Ex TaqTM II试剂盒,在 Rotor-gene3000荧光实时定量热循环仪上进行qPCR反应,实验步骤参照说明书进行.合成基因特异性引物GPX-F、GPX-R、CAT-F和 CAT-R用于该实验,以β-actin 基因作为qPCR的内参基因(序列见表1).根据qPCR给出的Ct值,取3个平行样本的平均值,利用2-ΔΔCt方法计算2个基因mRNA的相对表达量.

表1 实验用引物表Tab.1 Primers used in this study
1.5 统计分析
利用SPSS 13.0软件对所得数据进行单因素方差分析,数据以平均值±标准差的形式,显著性分析水平为p<0.05,并做柱状图.
2 结 果
2.1 OvGPX和OvCAT基因序列分析
以RACE方法,拼接得到OvGPX基因.得到的OvGPX cDNA全长为925bp,包含5′非编码区(5′UTR)36bp,3′非编码区(3′UTR)316bp,ORF 573 bp,共编码190个氨基酸,推测分子质量21.5ku,等电点pI为7.81.OvGPX推导的氨基酸序列(图1)含有GPX家族2个典型酶活性位点基序,分别是从28GKVILVENVASLUGTT43和64LGFPCNQF71;并含有特有的Sec,利用SECISearch2.19在线软件在OvGPX基因的3′UTR处预测到1个SECIS,全长91bp(图2),含1个顶环和1个AG-GA SECIS核,顶环处存在保守的AAA序列.
得到的 OvCAT 全长为2 109bp,包含5′UTR 135bp、3′UTR 435bp和ORF 1 539bp,共编码512个氨基酸,推测分子质量58.3ku,等电点pI为8.76(图3).通过功能域预测,推导的OvCAT氨基酸序列含有1个过CAT活性位点(61FNRERIPERVVHAKGAG77)、1个近端血红素配体标签序列(351RLYSYSDT358)和1个酶免疫响应区(位点428~494).并发现了3个参与过氧化氢酶催化位点(His-71,Asn-144和 Tyr-354),同时预测到了3个糖基结合位点NASL、NYSQ、NVSS.

图1 OvGPX的核苷酸和推导氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of OvGPX cDNA

图2 OvGPX基因的SECIS元件示意图.2The SECIS functional element of OvGPX
2.2 OvGPX和OvCAT基因氨基酸序列同源性分析
通过Blast、Clustal X和DNAman等分析软件,将OvGPX推导的氨基酸序列与8种脊椎动物和无脊椎动物的GPX氨基酸序列进行多序列分析(图4).结果表明OvGPX氨基酸序列高度保守,所有比对序列基本都含有GPX的2个酶活性位点基序,且都有Sec.与曼氏无针乌贼(Sepiella maindroni)的 GPX氨基酸序列同源性最高(74%),与人类(Homo sapiens)的GPX氨基酸序列同源性也达60%.
将本实验得到的OvCAT的氨基酸序列与8种已有动物的CAT氨基酸序列进行多重序列比对(图5).结果显示,所比对物种的CAT氨基酸序列高度保守,基本都含有CAT的特征基序和3个参与催化的残基.比对结果显示,不同物种相似性较高,OvCAT氨基酸序列与同是软体动物门的香港巨牡蛎(Crassostrea hongkongensis)和 盘 鲍 (Haliotis discus)的CAT氨基酸序列相似性高达76%和75%,与人类的CAT氨基酸序列相似性也有68%.

图3 OvCAT的核苷酸和推导氨基酸序列Fig.3 Nucleotide and deduced amino acid sequences of OvCAT cDNA

图4 OvGPX氨基酸序列比对Fig.4 Alignment of OvGPX amino acid sequences
2.3 OvGPX和OvCAT基因mRNA在不同温度下的表达分析
以qPCR方法分析了OvGPX基因在24,26,28和30℃不同温度组处理2h后消化腺和栉鳃的mRNA表达量差异(图6).
在消化腺和栉鳃中,OvGPX mRNA表达量均在28℃组最高,分别达到24℃组的7.57倍(p<0.01)和2.19倍.在30℃组,栉鳃OvGPX mRNA的表达水平下降,只有24℃组的1/3(p<0.05);而消化腺中OvGPX mRNA的表达量与室温组没有显著差异.
不同温度组处理2h,真蛸消化腺和栉鳃中OvCAT mRNA的表达量差异如图7,在消化腺和栉鳃中,28℃组OvCAT mRNA表达量明显升高,分别达到24℃的2.36倍(p<0.01)、2.13倍(p<0.01);在消化腺中26和30℃组的OvCAT mRNA表达量与24℃组无显著差异;栉鳃的OvCAT mRNA表达水平在30℃组低于24℃组,为24℃组的0.57.
不同温度组qPCR结果表明,OvGPX和OvCAT 2个基因的表达水平在不同温度组的表达差异相似,但是OvGPX的mRNA表达量变化波动较OvCAT明显.
3 讨 论
本文研究得到的OvGPX cDNA全长,除了具有2个高度保守的特征基序,预测的氨基酸序列中还发现了由UGA编码的Sec U,这是GPX的中心催化基团,能够催化GSH分解体内的氢过氧化物,从而防止细胞膜和其他生物组织遭受过氧化损伤[12-13].UGA在一般情况下作为终止密码子,但在OvGPX基因中,其主要编码被称为第21种氨基酸的Sec[18].该编码依赖硒元素,当细胞生长缺乏硒时,硒蛋白的翻译会在UGA密码子处中止,成为不完整而没有功能的蛋白;而破译UGA使其编码Sec需要SECIS元件[19]的作用,SECIS元件是一个位于GPX基因3′UTR部分的一个茎-环发卡结构,本文得到的OvGPX基因,在3′UTR区同样发现了SECIS序列,这段序列由螺旋茎和顶环、内环组成,在茎的基部具有保守的AUGAC和UGAC形成的形成非 Watson-Crick双链,结构完整,这个完整的SECIS元件保证了OvGPX基因的正确转录.SECIS元件的分类主要根据保守的AAA序列是否位于顶环进行判断,本研究得到的OvGPX基因的SECIS元件,AAA序列位于顶环,与人类的OvGPX1一样属于一类[20-21].

图5 OvCAT氨基酸序列比对Fig.5 Alignment of OvCAT amino acid sequences
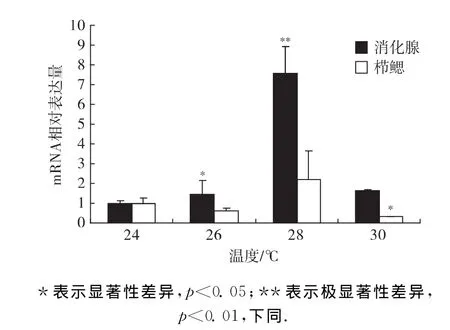
图6 qPCR方法下的OvGPX在不同温度的表达量Fig.6 The expression of OvGPX at different temperatures by qPCR

图7 qPCR方法下的OvCAT在不同温度的表达量Fig.7 The expression of OvCAT at different temperatures by qPCR
水生动物受到热应激后的抗氧化酶的活性变化有所差异,翡翠贻贝(Perna viridis)热激后,SOD、CAT、GST、GPX等酶活力都明显的高于对照组[22];双线血蛤((Hiatula diphos)和中国血蛤(Hiatula chinensis)在20~70℃不同的水温刺激下,CAT酶活性变化趋势表现为先上升,后下降,且双线血蛤的变化幅度比中国文蛤明显[23];在对盘鲍的28℃热应激研究中发现,GPX、CAT和SOD 3个基因的mRNA表达量在热应激后均上调[24].可见,热激强度不同和热激时间的长短,对抗氧化酶活性造成的变化并不相同,而同一实验条件下,不同物种的GPX或CAT酶活性变化也有差异.这些结果说明GPX和CAT这2种抗氧化酶参与热应激后的自由基清除活动,保证了机体免受过度自由基损伤.本实验中,不同的温度应激后,消化腺中的OvGPX和OvCAT基因的mRNA表达量在应激条件下均有上升,体现了2个抗氧化基因在热应激压力下清除过氧化氢,保护机体的积极作用;栉鳃OvGPX和OvCAT的mRNA表达量在28℃组有所升高,26和30℃组表达量下降,说明消化腺和栉鳃抗氧化能力可能有所不同.本文不同强度的热应激实验结果显示,OvGPX mRNA表达量的变化幅度明显大于OvCAT,显示了OvGPX对氧化应激较为敏感.
本文克隆了OvGPX和OvCAT基因全长,并探索2个基因在不同热激强度下的表达情况,初步确定2个基因参与热应激胁迫后的抗氧化反应.这些数据为进一步研究OvGPX和OvCAT的生物学功能提供有效信息,并为深入探索头足类动物的抗氧化体系奠定理论基础.
[1]Navarro J C,Villanueva R.The fatty acid composition of Octopus vulgaris paralarvae reared with live and inert food:deviation from their natural fatty acid profile[J].Aquaculture,2003,219:613-631.
[2]Iglesias J,Otero J J,Moxica C,et al.The completed life cycle of the octopus (Octopus vulgaris,Cuvier)under culture conditions:paralarval rearing using Artemia and zoeae,and first data on juvenile growth up to 8months of age[J].Aquaculture International,2004,12 (4/5):481-487.
[3]徐实怀,马之明,贾晓平,等.人工养殖条件下真蛸的生物学特性及胚胎发育[J].南方水产,2009,5(2):63-68.
[4]Delgado M,Gairin J I,Carbo R,et al.Growth of Octopus vulgaris (Cuvier,1797)in tanks in the Ebro Delta(NE Spain):effects of temperature,salinity and culture density[J].Scientia Marina,2011,75:53-59.
[5]Chilmonczyk S,Monge D.Rainbow trout gill pillar cells:demonstration of inert particle phagocytosis and involvement in viral infection[J].Journal of the Reticuloendothelial Society,1980,28(4):327-332.
[6]Halliwell B.Free radicals,antioxidants,and human disease:curiosity,cause or consequence [J].Lancet,1994,344:721-724.
[7]Wiseman H,Halliwell B.Damage to DNA by reactive oxygen and nitrogen species:role in inflammatory disease and progression to cancer[J].The Biochemical Journal,1996,313:17-29.
[8]Gotia S,Popovici I,Hermeziu B.Antioxidant enzymes levels in children with juvenile rheumatoid arthritis[J].Rev Med Chir Soc Med Nat Iasi,2001,105(3):499-503.
[9]Cetinkaya O,Silig Y,Cetinkaya S,et al.The effects of Rumex patientia extract on rat liver and erythrocyte antioxidant enzyme system[J].Die Pharmazie,2002,57(7):487-488.
[10]Muruganandan S,Gupta S,Kataria M,et al.Mangiferin protects the streptozotocin-induced oxidative damage to cardiac and renal tissues in rats[J].Toxicology,2002,176(3):165-173.
[11]Mills G C.Hemoglobin catabolism.I.Glutathione peroxidase,an erythrocyte enzyme which protects hemoglobin from oxidative breakdown[J].The Journal of Biological Chemistry,1957,229(1):189-197.
[12]Flohe L,Genzler W A,Schock H H.Glutathione peroxidase:a selenoenzyme[J].FEBS Letters,1973,32(1):132-134.
[13]Rotruck J T,Pope A L,Ganther H E,et al.Selenium:biochemical role as a component of glutathione peroxidase[J].Science,1973,179:588.
[14]刘冰,梁婵娟.生物过氧化氢酶研究进展[J].中国农学通报,2005,21(5):223-224.
[15]Nordberg J,Arner E S J.Reactive oxygen species,antioxidants and the mammalian thioredoxin system [J].Free Radical Biology & Medicine,2001,31:1287-1312.
[16]萨姆布鲁克J,拉塞尔 D W,著.分子克隆实验指南[M].3版.黄培堂,等译.北京:科学出版社,2002.
[17]Zhang X,Mao Y,Huang Z,et al.Transcriptome analysis of the Octopus vulgaris central nervous system[J].PLoS One,2012,7(6):e40320.
[18]Stadtman T C.Selenocysteine[J].Annual Review of Biochemistry,1996,65:83-100.
[19]Fagegaltier D,Lescure A,Walczak R,et al.Structural analysis of new local features in SECIS RNA hairpins[J].Nucleic Acids Research,2000,28(14):2679-2689.
[20]Grundener-Culemann E,Martin G W,Harney J W,et al.Two distinct SECIS structures capable of directing selenocysteine incorporation in eukaryotes[J].RNA,1999,5(5):625-635.
[21]Kryukov G V,Castellano S,Novoselov S V,et al.Characterization of mammalian selenoproteomes[J].Science,2003,300(5624):1439-1443.
[22]Verlecar X N,Jena K B,Chainy G B.Biochemical markers of oxidative stress in Perna viridis exposed to mercury and temperature[J].Chemico-biological Interactions,2007,167(3):219-226.
[23]孙业勇,高如承,温扬敏.温度对中国血蛤、双线血蛤肝脏中水解酶和抗氧化酶活性的影响[J].水产科学,2008,10(27):543-544.
[24]De Zoysa M,Whang I,Lee Y,et al.Transcriptional analysis of antioxidant and immune defense genes in disk abalone(Haliotis discus discus)during thermal,low-salinity and hypoxic stress[J].Comparative Biochemistry and Physiology:Part B,2009,154(4):387-395.

