低氧可诱导蛋白2作为新肾癌肿瘤标志物的临床应用
杨 斌 张 争 毛泽斌 辛殿祺 (北京大学第一医院泌尿外科,北京 00034)
肾细胞癌(RCC)早期缺乏典型的临床表现,约30%的患者在确诊时已经发现有远处转移。RCC生物学行为极为复杂,对放疗化疗均不敏感〔1,2〕。大部分靶向治疗药物仍处于临床试验阶段,并且普遍存在完全缓解率低的问题〔3〕。目前尚缺乏一个RCC的肿瘤标志物用于临床诊断。Togashi等〔4〕通过cDNA微列阵分析,选出RCC患者中普遍且明显过表达的基因。并通过半定量RT-PCR、免疫组织化学分析等实验方法,最终证实低氧可诱导蛋白2(HIG2)蛋白的表达在RCC组织中明显上调,而未在其他正常的器官组织内检测到其上调。本文分析HIG2蛋白在RCC临床诊断上的作用。
1 材料和方法
1.1 研究对象 收集2012年10月至2013年12月北大医院泌尿外科100例RCC患者的新鲜血液,其中男56例,年龄60~86〔平均(71.35±1.33)〕岁;女 44例,年龄 60~76〔平均(68.57±2.18)〕岁;与100名健康志愿者的新鲜血液,其中男46例,年龄24~38岁;女54例,年龄23~35岁,平均年龄28岁。患者与志愿者均已知情,并通过伦理审查。采集的血液均经水平离心机4℃,3 000 r/min离心15 min。提取上清血清后,再经小型离心机4℃,12 000 r/min离心10 min提取血清,并保存于-80℃以待检测。
1.2 试剂和材料 大肠杆菌融合表达载体pGEX4T-3 Vector购于Pharmacia Biotech公司,在EcoRI和XhoI位点间插入扩增的HIG2编码区并经测序验证。该HIG2/pGEX4T-3质粒由北京大学基础医学院生化系王秀娟提供。大肠杆菌BL21购于天根生化科技有限公司;96孔单条可拆酶标板购于美国康宁公司;二喹啉甲酸(BCA)蛋白定量试剂盒购于美国Thermo公司;HIG2鼠源单克隆抗体购于上海Santa Cruz公司;HIG2兔源多克隆抗体购于英国Abcam公司;酶联免疫反应板包被液购于美国SurModics公司;TMB单组分显色液购于北京索莱宝科技有限公司。
1.3 谷胱基肽疏基转移酶(GST)-HIG2融合蛋白可溶性表达将测序正确的HIG2/pGEX4T-3质粒转化大肠杆菌BL21感受态细胞中,挑取单克隆分别接种含氨苄青霉素(Amp)的LB培养基中,37℃、180 r/min震荡培养至 OD600=0.4~0.6,并加入IPTG诱导剂至终浓度1 mmol/L,继续培养4 h后,4℃、8 000 r/min离心10 min收集菌体。菌体沉淀用100 μl磷酸盐缓冲液(PBS)重悬后加等量的上样缓冲液,经100℃水浴5 min后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测融合蛋白的表达情况,鉴定表达产物。
1.4 GST-HIG2融合蛋白纯化 将HIG2/pGEX4T-3质粒转化大肠杆菌BL21感受态细胞后大量诱导,4℃、8 000 r/min离心10 min收集菌体,用1×PBS缓冲液重悬菌体。4℃条件下超声破碎菌体,超声后产物经4℃、5 000 r/min离心20 min,分别收集离心上清液和沉淀。对收集液分别进行SDS-PAGE检测。取超声后的上清液过GST亲和层析柱中,使柱中的上清液缓慢流穿。用10倍柱床体积的PBS冲洗。再用含GSH的洗脱液去除杂蛋白。收集流穿液和洗脱液,所有收集的液体均进行SDS-PAGE分析。纯化后的HIG2蛋白用2 000 ml的1×PBS透析以除去谷胱甘肽。最后采用BCA法测定HIG2蛋白浓度。
1.5 ELISA双抗体夹心法测定GST-HIG2表达水平 用酶联免疫反应板包被液,将HIG2单克隆抗体稀释至蛋白质浓度为2 μg/ml,4℃包被 96 孔酶标板 12 h;用 0.15 mol/L pH7.4 PBS洗涤缓冲液洗3次后加入5%脱脂奶粉37℃封闭1 h;1×PBS洗涤3次后,分别取倍比稀释的标准品HIG2蛋白以及稀释的健康志愿者和RCC患者的血清样品100 μl加入上述已包被好的反应孔中,37℃孵育1 h;1×PBS洗涤3次后,加入1∶1 000稀释的HIG2多克隆一抗37℃孵育1 h;PBS洗涤3次后,加入1∶1 000辣根过氧化物酶(HRP)标记的羊抗兔IgG 37℃孵育1 h;PBS洗涤3次后,加入TMB底物显色液100 μl,37℃避光显色15 min;加入 2 mol/L H2SO450 μl,终止反应后,于酶联免疫检测仪450 nm波长下读数。通过HIG2纯蛋白绘制浓度标准曲线,计算200例血清样品的浓度,并按照HIG2蛋白所占GSTHIG2蛋白的分子量比例以及血清稀释比例,换算成纯HIG2蛋白的浓度。浓度标准曲线的绘制采用了Curve Exert1.4软件。
1.6 统计学方法 采用SPSS19.0软件进行工作特征曲线(ROC)分析。
2 结果
2.1 GST-HIG2融合蛋白在大肠杆菌BL21中的表达 含重组质粒的大肠杆菌BL21经IPTG诱导后,在相对分子质量约31 kD位置出现了一条蛋白条带,该结果与预期GST-HIG2融合蛋白相对分子量为31 kD结果一致。见图1。

图1 融合蛋白经IPTG诱导后的表达
2.2 GST-HIG2融合蛋白的纯化 目的蛋白GST-HIG2主要存在上清液中,表明GST-HIG2融合蛋白主要以可溶性的形式存在。利用GST融合蛋白亲和层析柱进行目的蛋白纯化,SDSPAGE分析显示纯化的融合蛋白呈单一条带,纯度为86%。BCA法检测GST-HIG2融合蛋白浓度为0.42 mg/ml。见图2。
2.3 样品血清中HIG2蛋白浓度计算结果 经纯化后的GSTHIG2 融合蛋白分别按照 31、32、33、34、35、36、37 和 41、42、43、44、45、46、47进行稀释,用 ELISA方法检测得出相应 OD值,100例健康志愿者和100例RCC患者血清样品中HIG2蛋白浓度的中位数分别为1 μg/ml(四分位差为0.61~1.56 μg/ml);3.4 μg/ml(四分位差为 2.05 ~10.47 μg/ml)。
2.4 ROC曲线分析结果 对上述浓度值绘制ROC曲线,曲线下面积为0.870,95%置信区间为(0.821,0.918),P <0.001,其诊断正确性为中等,cut-off值为2.03 μg/ml,敏感度和特异度分别为76%、85%,约登指数为61%。见图3。
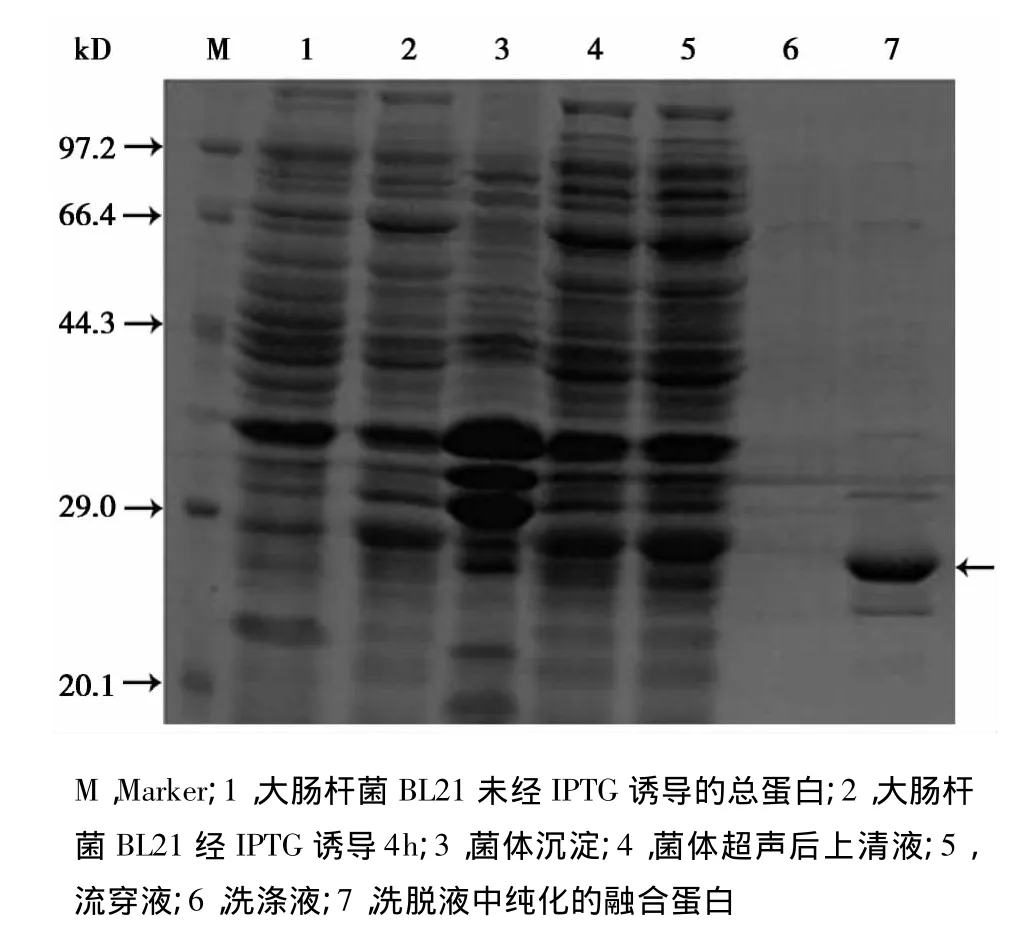
图2 融合蛋白的表达和纯化
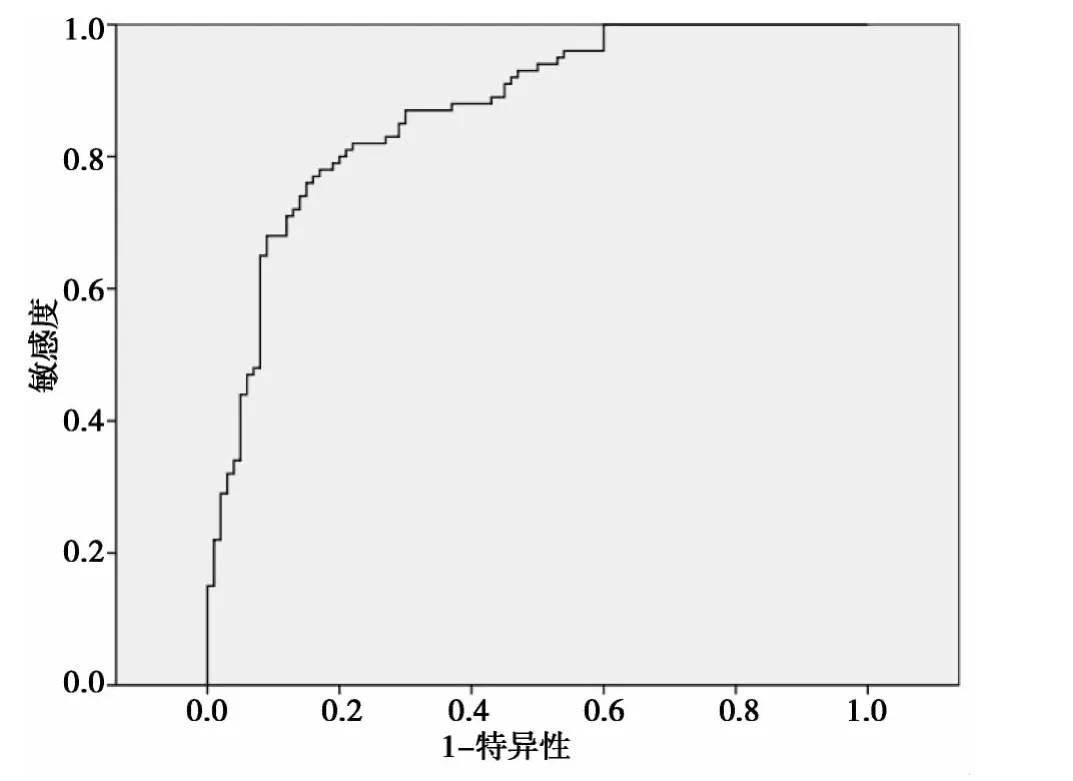
图3 ROC曲线对健康志愿者和肾癌患者血清浓度的分析
3 讨论
2009年全国范围内RCC新发病例数为4 916例,约占全部恶性肿瘤新发病例数的2.01%,在恶性肿瘤发病中排第12位〔1〕。根据RCC病理组织分型,最常见的病理组织类型为透明细胞癌约占80%〔5〕。RCC患者早期诊断主要依靠影像学检查,但很多直径<1 cm的微小肿瘤仍然难以及时准确发现。穿刺活检可判断肿瘤的病理分级分型,但这是一项有创且与临床症状相关联的检查,存在着假阴性、不能及时及针孔肿瘤转移的可能。因此,目前尚缺乏RCC肿瘤标志物用于临床诊断。
HIG2蛋白作为低氧诱导基因首次被Denko等〔6〕发现,其cDNA全长包含1 372个核苷酸。Togashi等〔4〕通过cDNA微列阵分析,选出RCC患者中普遍且明显过表达的基因。并通过半定量RT-PCR、免疫组织化学分析等实验方法最终证实HIG2蛋白在RCC明显上调。通过小干扰RNA(siRNA)阻断HIG2蛋白表达后,RCC细胞生长明显受到了抑制;在肾癌细胞培养基中加入HIG2多克隆抗体,可明显诱导RCC细胞的凋亡〔4〕。以上结果均说明HIG2蛋白在RCC细胞生长中起着重要作用。
目前von Hippel-Lindau(VHL)基因通路被认为是肾透明细胞癌中主要诱发癌症的基因通路。肾透明细胞癌可普遍发现VHL基因甲基化或突变〔7〕,导致调控缺氧诱导因子(HIF)-1α的VHL基因失活,从而使HIF蛋白异常堆积,并进一步使一系列HIF下游调控基因如血管内皮生长因子(VEGF)、转化生长因子(TGF)-α等表达异常,最终导致细胞生理代谢紊乱诱发癌症〔8〕。如临床已经使用的Sorafenib就是通过阻断该通路的来治疗RCC的药物〔9〕。但这些药物往往会使其下游一系列调控蛋白受到抑制,影响多种器官的正常生理代谢,造成严重副作用〔10〕。与之相比,Denko等〔6〕证明在低氧条件下是由 HIF1 调节HIG2的表达,阻断该靶点通路不会影响HIF其他下游调控基因,这样就为临床的靶向治疗避免严重的副作用提供了基础。并且HIG2蛋白仅在RCC组织高表达。免疫染色显示HIG2蛋白在肝脏、心脏、肺、前列腺、骨髓以及正常成人肾脏组织均不表达或低表达。半定量逆转录-聚合酶链式反应显示HIG2 mRNA在其他器官肿瘤如直肠癌、乳腺癌、肝细胞癌等几乎检测不到〔4〕。因此,HIG2蛋白为筛选RCC临床诊断的肿瘤标志物以及分子药物治疗的靶标提供了理论依据。
1 张永贞,杨国庆,张思维,等.中国2009年肾及泌尿系统其他癌发病和死亡分析〔J〕.中国肿瘤,2013;22(5):333-7
2 Garcia JA,Rini BI.Recent progress in the management of advanced renal cell carcinoma〔J〕.CA Cancer J Clin,2007;57(2):112-5.
3 毕新刚,马建辉.肾癌靶向治疗现状〔J〕.临床药物治疗杂志,2011,9(1):16-20.
4 Togashi A,Katagiri T,Ashida S,et al.Hypoxia-inducible protein2(HIG2),a novel diagnostic marker for renal cell carcinoma and potential target for molecular therapy〔J〕.Cancer Res,2005;65(11):4817-26.
5 Oya M,Murai M.Renal cell carcinoma:relevance of pathology〔J〕.Curr Opin Urol,2003;13(6):445-9.
6 Denko N,Schindler C,Koong A,et al.Epigenetic regulation of gene expression in cervical cancer cells by the tumor microenvironment〔J〕.Clin Cancer Res,2000;6(2):480-7.
7 Lessi F1,Mazzanti CM,Tomei S,et al.VHL and HIF-1α:gene variations and prognosis in early-stage clear cell renal cell carcinoma〔J〕.Med Oncol,2014;31(3):840
8 Patel PH,Chadalavada RS,Chaganti RS,et al.Targeting von Hippel-Lindau pathway in renal cell carcinoma〔J〕.Clin Cancer Res,2006;12(24):7215-20.
9 Escudier B,Eisen T,Stadler WM,et al.Sorafenib in advanced clear-cell renal-cell carcinoma〔J〕.N Engl J Med,2007;356(2):125-34.
10 Mizutani Y.Recent advances in molecular targeted therapy for metastatic renal cell carcinoma〔J〕.Int J Urol,2009;16(5):444-8.

