壳聚糖对鲜切莲藕酶促褐变相关因子的影响
汪 伟,张 伟,孙 莹,高 成,朱丽琴
(江西农业大学 食品科学与工程学院/江西省发展与改革委员会农产品加工与安全控制工程实验室,江西 南昌 330045)
鲜切水果蔬菜新鲜、营养丰富、食用方便,近年来市场需求量逐渐增大。莲藕是睡莲科莲属多年生草本植物,富含多种维生素,是一种传统蔬菜,消费量大,鲜切莲藕市场前景广阔。但是鲜切莲藕极易发生酶促褐变,主要是由于多酚在多酚氧化酶(PPO)作用下氧化成醌类物质,并逐渐聚合成有色物质[1],导致莲藕表面褐变,降低商品价值。目前生产上应用较为广泛的抑制褐变技术主要包括添加抗氧化剂,热烫处理,气调包装,涂膜等[2]。
壳聚糖是一种由几丁质脱乙酰基后得到的可食性、天然阳离子多糖。一定浓度的壳聚糖溶液在果蔬表面形成一层具有抑菌作用的半透膜,抑制气体交换、水分散失和果实呼吸作用,提高果实抗氧化能力,延缓水果蔬菜采后衰老[3-5]。壳聚糖对鲜切水果和蔬菜也具有显著的保鲜效果。研究表明壳聚糖能显著抑制贮藏期间鲜切荸荠[6]、蘑菇[7]、南瓜[8]、生姜[9]、马铃薯[10]等多种鲜切果蔬的酶促褐变。壳聚糖能显著抑制鲜切莲藕褐变[11-13],但是目前有关壳聚糖对鲜切莲藕抑制酶促褐变相关因子的研究较少。
本试验以鲜切莲藕为试材,在4 ℃条件下贮藏,研究质量分数为1%、2%壳聚糖处理对鲜切莲藕品质的影响,并研究贮藏期间莲藕中与酶促褐变相关的自由基含量和酶活性的变化,探讨壳聚糖对鲜切莲藕片酶促褐变相关因子的影响,为鲜切莲藕的工业化生产提供参考。
1 材料与方法
1.1 材料及试剂
莲藕,购于江西农业大学集贸市场,选取肉质白,组织结实、无损伤和无腐烂的莲藕。水溶性壳聚糖由山东奥康生物科技有限公司生产。乙酸,没食子酸,乙酸钠,氢氧化钠,乙醇,钼酸钠,钨酸钠,磷酸氢二钠,磷酸氢二钠,硫酸,硫酸钛,磷钼酸铵,联苯胺,对氨基苯磺酸,α-萘胺均为分析纯。
1.2 仪器及设备
紫外-可见分光光度计,上海元析仪器有限公司;生产TGL-20000cR 冷冻离心机,上海安亭科学仪器厂生产;HH-60 型数显恒温水浴锅,国华电器有限公司生产;HWS-288 恒温恒湿培养箱,宁波江南仪器厂生产;SB-3200 超声波清洗机,宁波新芝生物科技股份有限公司生产。
1.3 试验方法
1.3.1 样品处理 壳聚糖溶液的配制:称取一定量的壳聚糖,用0.5%(V/V)乙酸溶解,待溶解后加入1 mol/L NaOH 溶液调节pH 至5.6,然后加入0.05%(W/V)吐温-80,搅拌均匀。
将莲藕洗净,去皮,切成4 mm 薄片,用清水清洗,晾干后随机分成3 组,每组1 500 g。其中一组为对照组(CK),其余两组分别用1%、2%壳聚糖溶液涂膜处理。将切片放入壳聚糖溶液中,待壳聚糖涂膜液在鲜切莲藕表面完全浸润后,取出,室温晾干后装入厚度为0.02 mm 聚乙烯袋中,每组分成3 份,每份500 g,置于恒温恒湿培养箱中,(4±0.5)℃条件,相对湿度为85%~90%条件下保藏,每2 d 随机抽样检测指标。
1.3.2 指标测定方法(1)褐变度:采用消光值法,参照苏新国等[13]方法测定。(2)维生素C 含量:用磷钼蓝法[14]测定维生素C 含量。(3)失重率:采用称重法,公式为

式中m0:鲜切莲藕最初质量(g),m1:贮藏期间的质量(g)。(4)总多酚含量:取1 g 莲藕,加入5 mL的70%乙醇匀浆,90 W 超声提取30 min,10 000×g 离心10 min,取上清液备用。用Folin-ciocalteu 比色法[15]测定总多酚含量。(5)超氧阴离子自由基含量:用羟胺法[16]测定超氧阴离子自由基的含量。(6)过氧化氢含量:用硫酸钛法[17]测定过氧化氢含量。(7)CAT 活性:取2 g 莲藕,加5 mL 预冷磷酸缓冲液(pH 7.0)冰浴匀浆,4 ℃,10 000×g 离心20 min,上清液即为粗酶液。取上述粗酶液,参考Havir 和McHale[18]方法测定CAT 活性,以1 min OD240每减少0.01 作为一个酶活性单位(U)。蛋白质含量采用考马斯亮蓝法[19]。(8)PPO 活性:取上述粗酶液,活性检测参照Zhu 等[15],以1 min OD410每增加0.01作为一个酶活性单位(U)。(9)过氧化物酶(POD)活性:取上述粗酶液,参照联苯胺法[20]测定POD 活性,以1 min OD580每增加0.01 作为一个酶活性单位(U)。
1.4 数据处理
采用Origin8.5 作图,利用SPSS20.0 软件进行试验数据分析,使用Duncan’s 新复极差法进行多重比较,P<0.05 时为显著性差异。
2 结果与分析
2.1 壳聚糖对鲜切莲藕外观的影响
鲜切莲藕贮藏12 d 后的效果如图1。对照组莲藕褐变面积几乎覆盖整个莲藕表面,出现水渍,微有异味。1%和2%壳聚糖处理组褐变面积均较小,有莲藕清香。
2.2 壳聚糖对鲜切莲藕品质的影响
如图2(A)所示,随着贮藏时间延长,褐变指数逐渐增大。壳聚糖处理明显抑制鲜切莲藕褐变,到贮藏12 d,1%、2%壳聚糖涂膜处理鲜切莲藕的褐变度分别为对照组的78.66%和61.83%。
鲜切莲藕在贮藏期间组织汁液不断渗漏,致使质量减少,如图2(B)。到贮藏12 d,1%、2%壳聚糖处理组失重率分别为对照组的70.00%和54.87%,表明2%壳聚糖阻水效果明显高于1%壳聚糖。
鲜切莲藕在贮藏期间维生素C 含量先增大后降低,如图2(C)。贮藏前8 d 2%壳聚糖处理明显抑制了维生素C 含量的增加,贮藏10 d 后1%、2%壳聚糖处理均明显抑制了维生素C 含量的降低。
鲜切莲藕在贮藏期间总酚含量第8 天达到峰值后降低,如图2(D)。壳聚糖涂膜处理组总酚含量明显高于对照组,到贮藏结束,1%、2%壳聚糖处理组总多酚含量分别比对照组高28.67%、30.47%。

图1 壳聚糖对鲜切莲藕抑制褐变效果Fig.1 Effects of chitosan on visual appearance of fresh-cut lotus root
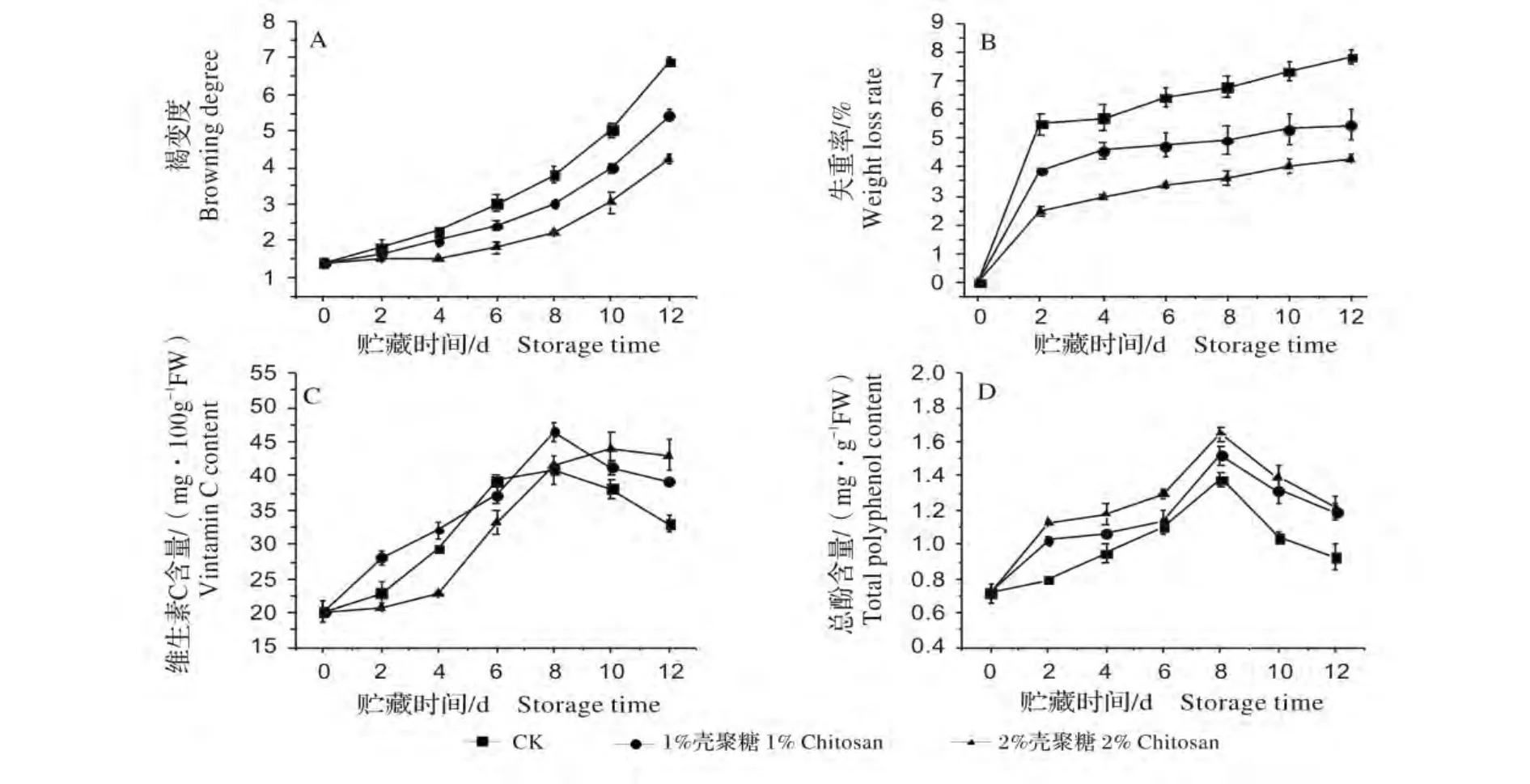
图2 壳聚糖对鲜切莲藕品质的影响Fig.2 Effects of chitosan on quality of fresh-cut lotus root
2.3 壳聚糖对鲜切莲藕自由基含量的影响
鲜切莲藕贮藏期间超氧阴离子(O2·-)含量第6 天达到峰值然后降低,如图3(A)。经壳聚糖处理的鲜切莲藕O2·-含量明显低于对照组(P<0.05)。
鲜切莲藕贮藏期间过氧化氢(H2O2)含量先减小,贮藏4 d 后含量逐渐增大,第8 天含量达到峰值后降低,如图3(B)。壳聚糖涂膜处理的鲜切莲藕H2O2含量明显低于对照组。

图3 壳聚糖对鲜切莲藕O2·-和H2O2含量的影响Fig.3 Effects of chitosan on O2·- and H2O2content of fresh-cut lotus root
2.4 壳聚糖对鲜切莲藕酶活性的影响
鲜切莲藕贮藏期间CAT 活性减小,第8 天略有上升后降低,如图4(A)。壳聚糖处理明显抑制鲜切莲藕CAT 活性降低,第8 天1%、2%壳聚糖CAT 活性分别为照组1.49、1.88 倍。
对照组和壳聚糖处理组鲜切莲藕贮藏期间PPO 活性变化趋势大致相同,第10 天达到峰值后降低,如图4(B)。壳聚糖处理明显抑制了PPO 活性,第10 天1%、2%壳聚糖PPO 活性分别为对照组的61.10%、49.69%。
贮藏期间对照组和壳聚糖处理组鲜切莲藕POD 活性均先增大后降低,如图4(C)。壳聚糖处理明显抑制鲜切莲藕POD 活性增加,第10 天1%、2%壳聚糖处理组POD 活性分别为对照组的46.34%、34.43%。
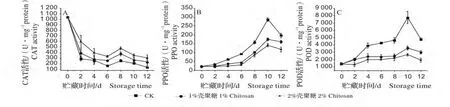
图4 壳聚糖浓度对鲜切莲藕酶活性的影响Fig.4 Effects of chitosan on enzyme activity of fresh-cut lotus root
3 讨论
莲藕鲜切处理造成组织机械损伤,营养物质外渗流失,商品和食用价值大大降低。本试验结果表明,采用1%和2%壳聚糖处理可显著抑制鲜切莲藕褐变和失重,保持了贮藏后期较高维生素C 和多酚含量,显著抑制了O2·-和H2O2的积累,维持了较高的CAT 活性,并显著抑制了PPO 和POD 活性,从而起到抑制鲜切藕片褐变的作用,且2%壳聚糖涂膜效果更佳。这与王兆升等[9]对鲜切生姜的研究相似。壳聚糖在鲜切果蔬表面形成的膜具有阻湿性和气体选择透过性,防止水分蒸腾抑制蔫萎,调节内部CO2和O2,形成高CO2环境,抑制呼吸,减少氧的供应,抑制了维生素C 和酚类物质的氧化,保持了果蔬的新鲜度和品质[6]。
酶促褐变一般分为两步,首先在PPO 催化下酚类化合物形成σ-醌,一旦形成σ-醌,不需要PPO的参与,很快就会发生氧化聚合作用,最终形成褐色色素[1,15]。本试验中壳聚糖处理鲜切莲藕总酚含量显著高于对照组,表明壳聚糖影响了多酚氧化进程,这与孙晓飞等[12]试验结果相似。苏新国等[13]认为PPO 是影响莲藕褐变的关键因素。本试验中壳聚糖处理莲藕切片PPO 活性得到了显著抑制,表明壳聚糖可能是通过降低PPO 酶活性抑制酚类物质的氧化,从而抑制鲜切莲藕酶促褐变,这与壳聚糖对龙眼作用效果一致[4]。植物组织中,酚类化合物主要存在于液泡中,酶促褐变关键酶PPO 主要存在于细胞壁、细胞膜和细胞质中,这种区域化划分阻止了底物和酶接触,抑制了组织褐变。切割加工使蔬菜机械损伤诱导果蔬应激反应,迅速产生大量自由基,自由基攻击细胞膜,细胞中酚与PPO 的区域化分布遭到破坏,从而引起褐变[1,5-6]。本试验中壳聚糖显著抑制了CAT 活性降低,促进CAT 催化降解H2O2,O2·-和H2O2含量显著减少,抑制了活性氧自由基对细胞膜不饱和脂肪酸过氧化的诱导,保护细胞膜,阻碍了液泡中多酚底物的释放,降低了多酚底物与PPO 接触几率,从而抑制了酶促褐变。POD 在H2O2存在条件下,催化酚类和类黄酮物质氧化和聚合,参与酚类物质代谢导致组织褐变[1]。目前已有关于壳聚糖显著抑制POD 活性的报道[21],本试验中壳聚糖处理鲜切莲藕显著抑制了POD 活性的增加,进而抑制了POD 作用途径酶促褐变。
4 结论
壳聚糖涂膜能够抑制鲜切莲藕失水,维持较高的维生素C 和总酚含量,抑制活性氧自由基的积累,保持较高CAT 活性,抑制PPO 和POD 活性,从而抑制鲜切莲藕酶促褐变。与对照组和1%壳聚糖涂膜处理相比,2%的壳聚糖涂膜处理效果更佳。
[1]罗海波,何雄,包永华,等.鲜切果蔬品质劣变影响因素及其可能机理[J].食品科学,2012,33(15):324-330.
[2]He Q,Luo Y.Enzymatic browing and its control in fresh-cut produce[J].Stewart Postharvest Review,2007,6(3):1-7.
[3]Bautista-Baños S,Hernández-Lauzardo A,Velázquez-del Valle M,et al.Chitosan as a potential natural compound to control pre and postharvest diseases of horticultural commodities[J].Crop Protection,2006,25(2):108-118.
[4]Jiang Y,Li Y.Effects of chitosan coating on postharvest life and quality of longan fruit[J].Food Chemistry,2001,73(2):139-143.
[5]Kou X H,Guo W L,Guo R Z,et al.Effects of chitosan,calcium chloride,and pullulan coating treatments on antioxidant activity in pear cv.“Huang guan”during storage[J].Food and Bioprocess Technology,2013,7(3):1-11.
[6]Pen L T,Jiang Y M.Effects of chitosan coating on shelf life and quality of fresh-cut Chinese water chestnut[J].LWT-Food Science and Technology,2003,36(3):359-364.
[7]Eissa H A.Effects of chitosan coating on shelf life and quality of fresh-cut mushroom[J].Journal of Food Quality,2007,30(5):623-645.
[8]张丹丹,杨绍兰,吴昊,等.壳聚糖涂膜对鲜切南瓜贮藏品质的影响[J].中国食品学报,2012,12(11):97-103.
[9]王兆升,董海洲,刘传富,等.壳聚糖在鲜切生姜涂膜保鲜中的应用[J].农业工程学报,2011,27(2):237-241.
[10]Shen X Y.Effects of 1-MCP and chitosan on active oxygen metabolism and quality of fresh-cut potato during storage[J].Agricultural Science & Technology,2012,13(4):807-810.
[11]王向阳,姜丽佳,王忠英.莲藕的酶促褐变及其贮藏中褐变的控制[J].农业工程学报,2009,25(4):276-280.
[12]孙晓飞,丁永川,马建平.壳聚糖处理对鲜切莲藕褐变和抗氧化活性的影响[J].作物杂志,2011(2):57-60.
[13]苏新国,蒋跃明,李月标,等.4-HR 对鲜切莲藕褐变以及贮藏品质的影响[J].食品科学,2003,24(12):142-145.
[14]奚长生.磷钼蓝分光光度法测定维生素C[J].光谱学与光谱分析,2001,21(5):723-725.
[15]Zhu L Q,Zhou J,Zhu S H,et al.Inhibition of browning on the surface of peach slices by short-term exposure to nitric oxide and ascorbic acid[J].Food Chemistry,2009,114(1):174-179.
[16]王爱国,罗广华.植物的超氧物自由基与羟胺反应的定量关系[J].植物生理学通讯,1990,26(6):55-57.
[17]Patterson B D,MacRae E A,Ferguson I B.Estimation of hydrogen peroxide in plant extracts using titanium(IV)[J].Analytical Biochemistry,1984,139(2):487-492.
[18]Havir E A,McHale N A.Biochemical and developmental characterization of multiple forms of catalase in tobacco leaves[J].Plant physiology,1987,84(2):450-455.
[19]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[20]孙文全.联苯胺比色法测定果树过氧化物酶活性的研究[J].果树学报,1988,5(3):105-108.
[21]苏新国,郑永华,张兰,等.壳聚糖涂膜对菜用大豆荚采后衰老和品质的影响[J].植物生理学报,2001,27(6):467-472.

