MC1R 基因在中国草金鱼中的遗传变异及其进化分析
杨竹青,王自蕊,熊六凤,阮记明,隗黎丽
(江西农业大学 动物科学技术学院,江西 南昌 330045)
金鱼(Carassius auratus)堪称中国国粹,起源于我国食用的普通野生鲫鱼,经过长期的环境和人工选择形成了品种繁多、颜色多样的观赏鱼类,受到了世界各国人们的喜爱。草金鱼(Carassius auratus),俗称红鲫或金鲫,是金鱼中最古老的一种,即金鱼的祖先,该品种抗病性和适应性强,体形和尾鳍与普通鲫鱼相同,颜色有红色、白色、红白花色等。金鱼的各种体色主要是由真皮层中许多色素细胞的色素沉积形成的,受遗传、神经内分泌、年龄、营养、环境等因素影响,但其本质是由遗传因素控制的,研究表明鱼类体色属于高遗传力的质量性状,通常受单个基因或少量几个基因控制[1]。研究表明脊椎动物的颜色形成主要是由于黑色素细胞中的酪氨酸源性色素(即黑色素)沉积造成的,它能使鱼类呈现黑色和褐色,有时也出现黄色[2-3]。黑色素合成过程主要受到黑素皮质素受体1(Melanocortin Receptor 1,MC1R)α-MSH 配体信号通路(MC1R/α-MSH signaling pathway)和鼠灰色信号蛋白(agouti signaling protein,ASIP)α-MSH 配体信号通路(ASIP/α-MSH signaling pathway)等两个信号通路调控[4-5]。
MC1R 基因是只含一个外显子的单拷贝基因,编码一个含7 个跨膜结构域的G 蛋白偶联受体—黑素皮质素受体1,在黑色素细胞中特异表达[6-7]。MC1R 与皮肤角质细胞和黑色素细胞分泌的α 促黑色素细胞激素(α-melanocyte stimulate hormone,α-MSH)结合,活化腺苷酸环化酶(Adenylate cyclase)和蛋白激酶A(Protein kinase A),再催化三磷酸腺苷(ATP)转变为环腺苷单磷酸(Cyclic AMP,cAMP)。细胞内cAMP 水平的上升能够刺激黑色素体中限速酶—酪氨酸酶的活性,导致真黑色素的生成。此外cAMP 可通过粘附到细胞外的基质蛋白,从而上调一些黑色素生成基因的表达[5,8]。大量研究表明MC1R 基因是影响人类、鸟类、畜禽、爬行以及鱼类等许多动物体色的主效基因[5,9-10]。因此本研究选择MC1R 基因作为影响金鱼体色的功能候选基因,对其进行全长序列的扩增、SNP 搜寻及功能和进化研究,为鱼类体色形成的分子机制奠定基础。
1 材料和方法
1.1 实验材料
本研究所用实验鱼均购自江西省南昌市草金鱼繁殖场。记录每条鱼的体色并收集尾鳍DNA 样品,蛋白酶K 消化后采用常规的酚/氯仿提取。使用DU-640(Beckman,USA)测定DNA 浓度后,稀释成20 ng/μL工作液,并在4 ℃保存备用。
1.2 实验方法
1.2.1 引物的设计与合成 从NCBI 网站下载鲫鱼MC1R 基因的DNA 序列(GenBank accesion No.AB618067.1),使用在线引物设计软件Primer 3.0(http://frodo.wi.mit.edu/cgi-bin/primer3/primer3_www.cgi)在MC1R 基因的保守区设计两对引物用于PCR 扩增和SNP 搜寻,具体引物和退火温度见表1。
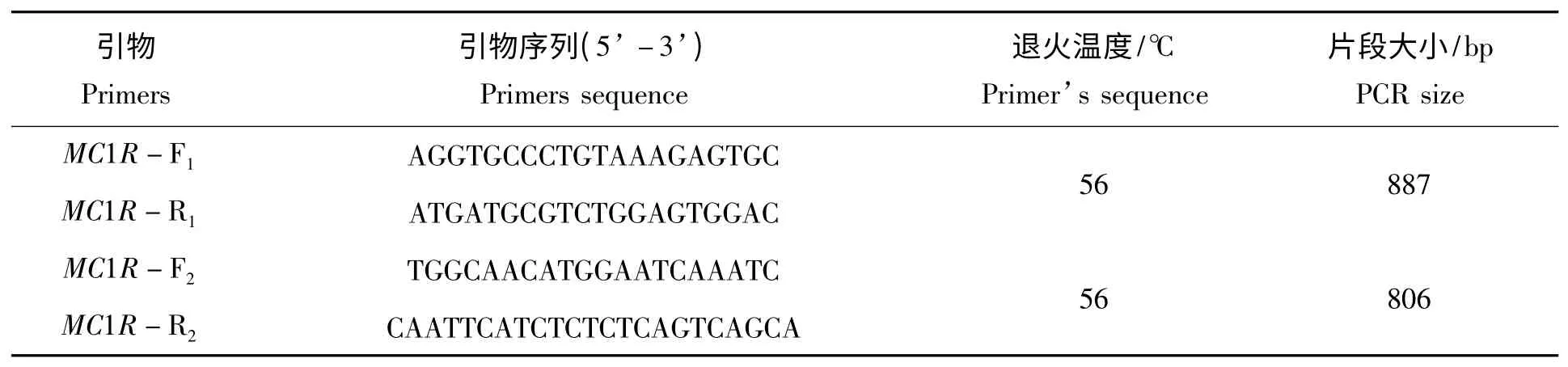
表1 实验研究所用的引物信息和扩增产物Tab.1 The PCR products and primers information in this study
1.2.2 草金鱼MC1R 基因的PCR 扩增和克隆 为了更好扩增出MC1R 基因的全长序列,本实验首先使用引物对F1/R2 扩增MC1R 基因的全长DNA 序列,然后使用引物对F1/R1和F2/R2进行半巢式PCR,得到更纯更亮的PCR 扩增产物。PCR 反应体系为20 μL,其中基因组DNA 40 ng,1×PCR buffer,1.5 mmol/L MgCl2,0.2 mmol/L dNTPs,Taq DNA 聚合酶1.5 U(TAKARA),0.25 μmol/L 上游引物和0.25 μmol/L下游引物。PCR 循环条件:94 ℃预变性3 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸40 s,35 个循环;72 ℃延伸5 min。所有PCR 反应在PTC-200 热循环仪(BIO-RAD,USA)上进行,PCR 产物送上海生工进行双向测序。
1.2.3 MC1R 基因的SNP 搜寻 使用上述实验条件和引物对,对野生银鲫和白色草金鱼的池DNA 进行PCR 扩增,割胶纯化和双向测序。将所得序列进行BLAST 分析,验证其特异性,再分别用DNAStar 软件包的Seqman 程序和Chromas Pro 软件进行分析比较鉴别SNPs。
1.3 MC1R 基因的序列分析与系统进化树的构建
测序结果经过DNAStar 软件包的Seqman 程序和Chromas Pro 软件分析得到可信序列后,采用Cap3在线组装软件(http://pbil.univ-lyon1.fr/cap3.php)进行序列的拼接;使用NCBI/ORF finder 在线软件(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)获得MC1R 基因的ORF 框及氨基酸序列;通过SMART(http://smart.embl-heidelberg.de/smart/set_mode.cgi?GENOMIC=1)软件进行蛋白结构的预测和功能分析。使用NCBI/BLAST 和Cluster X 8.1 软件进行同源序列搜索和同源性比对,并采用Mega4.1 软件中的N.J 法构建系统发育树。
2 结果与分析
2.1 草金鱼MC1R 基因的PCR 扩增结果
MC1R 基因引物F1/R1扩增片段大小为887 bp,引物F2/R2扩增片段大小为806 bp,其片段大小与预期相符(图1,图2)。测序得到的金鱼MC1R 基因序列与预期片段大小也一致,经过DNAStar 软件包的Seqman 程序和Chromas Pro 软件分析得到可信序列后,采用Cap3 在线组装软件进行序列的拼接,拼接后得到1 316 bp 的全长序列。将所测序列与鲫鱼MC1R 基因的mRNA 序列作BLAST 比较,发现这两个片段的同源性均达99%以上,表明这两个片段是金鱼MC1R 基因所特异的序列标签位点。

图1 引物F1/R1的PCR 扩增结果Fig.1 Amplification results of MC1R using primers F1/R1

图2 引物F2/R2的PCR 扩增结果Fig.2 Amplification results of MC1R using primers F2/R2
2.2 草金鱼MC1R 基因SNP 搜寻及蛋白质结构域分析
鱼类MC1R 基因只有一个外显子,通过对野生银鲫鱼和白色草金鱼池DNA 扩增、测序,DNAstar 软件分析发现在整个序列上只鉴定到1 个突变位点,即Exon 1 g.82 G>A(图3)。使用NCBI 在线ORF finder 分析发现该突变导致MC1R 基因的第28 个氨基酸发生改变(丙氨酸>苏氨酸)。通过SMART 软件进行蛋白质结构预测和功能分析,发现MC1R 蛋白有7 个跨膜蛋白组成(图4),且本研究检测到第28个氨基酸的改变导致MC1R 蛋白形成了一个新的低复杂区(图4,5)。
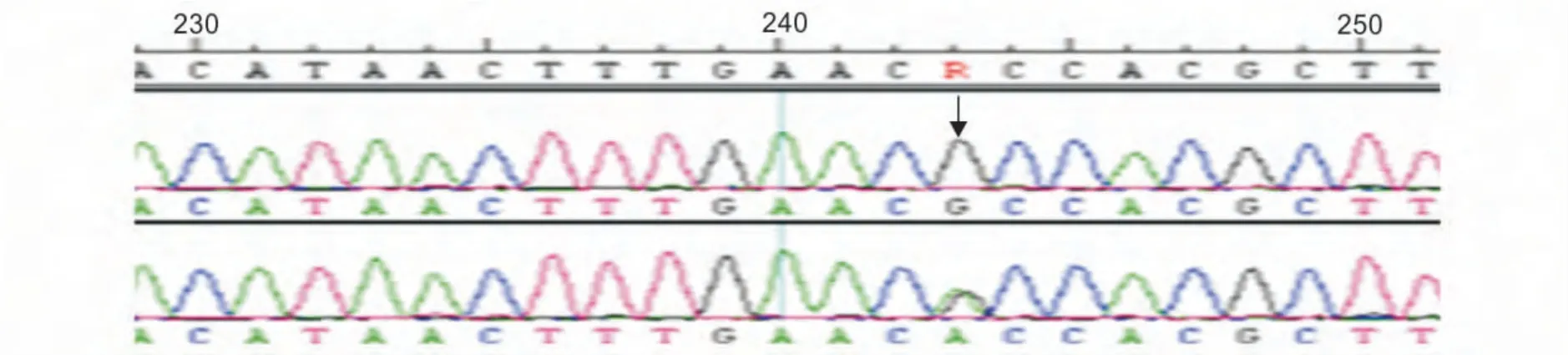
图3 草金鱼MC1R 基因的SNP 搜寻结果Fig.3 SNPs identification in MC1R gene of Carassius auratus

图4 野生型MC1R 蛋白的保守结构域Fig.4 The protected structure domain of Wild MC1R protein

图5 突变型MC1R 蛋白的保守结构域Fig.5 The protected structure domain of muture MC1R protein
2.3 MC1R 基因的同源性分析及系统发育树构建
使用NCBI/BLAST 软件进行MC1R 基因同源序列的搜索,获得鲫鱼(AB618067.1)、鲤鱼(JX989223.1)、斑马鱼(AY161847.1)、虹鳟(NM_001195178.1)、墨西哥丽脂鲤(FJ665984.1)、条斑星鲽(AB287974.1)、牙鲆(AB661668.1)、莫桑比克罗非鱼(AJ871147.1)、孔雀鱼(AB563501.1)、花斑剑尾鱼(DQ866828.1)、黑青斑河豚(AY332238.1)、红鳍东方鲀(AY161854.1)等12 种鱼类MC1R 基因的核苷酸序列。各种鱼类MC1R 基因的cDS 序列大小有一定差异,其中莫桑比克罗非鱼的编码序列最长,而墨西哥丽脂鲤的编码序列最短。同源性结果表明金鱼MC1R 基因核甘酸序列与12 种鱼类的同源性均很高,分别为99%,93%,86%,78%,78%,77%,77%,76%,75%,75%,75%,75%,这说明MC1R 基因在进化上非常保守,可用于物种进化分析。
利用Cluster X 8.1 对上述13 种核苷酸序列进行比对后,再用MEGA4.1 软件进行系统进化树的构建(图6)。聚类结果与经典分类学分类结果基本一致,13 种鱼类MC1R 核酸序列明显被聚为三类,同属鲤科鱼类的斑马鱼、鲤鱼、金鱼、鲫鱼等聚为一类;其次是脂鲤科的墨西哥丽脂鲤单独聚为一类;条斑星碟、牙鲆、莫桑比克罗非鱼、黑青斑河豚、红旗东方鲀、孔雀鱼、花斑剑尾鱼、虹鳟、墨西哥脂鲤聚为一类。结果表明在这13 种鱼类中,鲫鱼、鲤鱼、斑马鱼和金鱼最先遗传分化出来,遗传距离最近;与丽脂鲤、虹鳟、剑尾鱼、孔雀鱼的遗传距离更远。

图6 13 种鱼类MC1R 基因的系统进化树(数值表示置信度)Fig.6 Phylogenetic tree of thirteen fishes in MC1R gene(values represent confidence level)
3 结论与讨论
鉴于黑素皮质素受体1(Melanocortin Receptor 1,MC1R)α-MSH 配体信号通路(MC1R/α-MSH signaling pathway)是调控动物黑色素合成的重要信号通路之一,在黑色素合成过程中起着开关作用,且该基因的突变导致很多物种的毛色和体色呈现多种颜色[1,9-10],本研究将其选为草金鱼色素沉积的功能候选基因。虽然已有研究表明MC1R 基因与鱼类黑色素沉淀密切相关[9-11],但到目前为止还没有关于其与草金鱼体色形成的相关性报道。本研究通过PCR 产物直接测序法搜寻了MC1R 基因在野生鲫鱼和草金鱼中的遗传变异情况,在整个序列上只检测到1 个SNP,这表明MC1R 基因是一个高度保守的基因,在不同物种间或物种内只存在单个碱基的变异。进一步分析发现该突变导致MC1R 基因的第28个氨基酸发生改变(丙氨酸>苏氨酸),且该突变导致MC1R 蛋白一个新的低复杂区形成,再次证明MC1R 基因在草金鱼体色形成中起着重要的调控作用,有时单个碱基的改变就会导致受体激活或失活,引起鱼类颜色的改变如黑色、金色、白色、花斑等[10,12]。MC1R 基因是墨西哥洞鲤和非洲齿鲤等鱼类体色QTL 区域的重要功能候选基因之一,且该基因的单个碱基突变导致墨西哥洞鲤黑色素受体失去活性或活性降低,改变了黑色素细胞的大小、数量,最后造成黑色素形成受阻,从而使眼睛颜色呈现棕色隐性表型[9],在孔雀鱼中也得到了验证[10]。然而Henning 等[13]研究发现MC1R 基因在丽鱼金色表型中表达上调但没有找到与丽鱼金色表型相关的SNP。Tezuka 等[10]研究也发现该基因的SNP 与孔雀鱼的黑斑显著相关,但在不同群体中的等位基因效应不一样,表明其遗传效应可能还受到其他基因的修饰作用。以上矛盾结果可能是由于控制不同鱼类黑色素沉积的作用机制或主效基因不同,同时可能由于鱼类色素细胞种类和组合多样等导致鱼类体色判断不准引起;也可能是由于基因间的互作如上位效应等对其产生重要作用;也许是由于所分析的样品数相对较少,造成统计结果没有达到显著水平。
金鱼因其五彩缤纷的体色总给人们带来爽心悦目的感觉,一直被人类喜爱,与其他鱼类相比,其受到强烈的环境和人工选择。鱼类的体色具有重要的观赏和经济价值,是品种的标志,备受人们关注,相比其他性状也受到更多的人工选择。因此可以推测金鱼在进化过程中,控制动物黑色素合成的重要基因(MC1R)也受到正向选择作用。也有研究表明MC1R 基因是一个高度保守的基因,在遗传进化中起着重要作用,可利用其核苷酸序列分析物种的进化关系[13-15]。本研究也发现13 种鱼MC1R 基因的核苷酸序列的同源性均很高,且聚类结果与经典分类结果一致。聚类结果表明鲫鱼、鲤鱼、斑马鱼和金鱼最先遗传分化出来,同属鲤科鱼类,遗传距离最近;与丽脂鲤、虹鳟、剑尾鱼、孔雀鱼的遗传距离更远。胡建尊等[16]对瓯江彩鲤MC1R 基因的系统进化树分析也得到同样的结果。因此MC1R 基因在金鱼体色和进化的调控中起着重要调控作用,但其作用机制有待进一步研究。
[1]Parichy D M.Pigment patterns:fish in stripes and spots[J].Curr Biol,2003,13:947-950.
[2]Dickman M C,Schliwa M,Barlow G W.Melanophore death and disappearance produces color metamorphosis in the polychromatic Midas cichlid(Cichlasoma citrinellum)[J].Cell Tissue Res,1988,253:9-14.
[3]刘金海,王安利,王维娜.金鱼总色素及色素组分的比较研究[J].水生生物学报,2007,31(1):73-77.
[4]Mao H,Ren J,Ding N,et al.Genetic variation within coat color genes of MC1R and ASIP in Chinese brownish red Tibetan pigs[J].Anim Sci J,2010,81(6):630-634.
[5]Barsh G S.The genetics of pigmentation:from fancy genes to complex traits[J].Trends Genet,1996,12(8):299-305.
[6]Logan D W,Bryson-Richardson R J,Paga'n K E,et al.The structure and evolution of the melanocortin and MCH receptors in fish and mammals[J].Genomics,2003,81:184-191.
[7]Selz Y,Braasch I,Hoffmann C,et al.Evolution of melanocortin receptors in teleost fish:the melanocortin type I receptor[J].Gene,2007,401:114-122.
[8]Rouzaud F,Hearing V J.Regulatory elements of the melanocortin 1 receptor[J].Peptides,2005,26(10):1858-1870.
[9]Gross J B,Borowsky R,Tabin C J.A novel role for Mc1r in the parallel evolution of depigmentation in independent populations of the cavefish Astyanax mexicanus[J].PLoS Genet,2009,5:1000326.
[10]Tezuka A,Yamamoto H,Yokoyama J,et al.The MC1R gene in the guppy(Poecilia reticulata):Genotypic and phenotypic polymorphisms[J].BMC Res Notes,2011,4:31.
[11]Richardson J,Lundegaard P R,Reynolds N L,et al.Mc1r Pathway regulation of zebrafish melanosome dispersion[J].Zebrafish,2008,5(4):289-295.
[12]Sánchez E,Rubio V C,Cerdá-Reverter J M.Molecular and pharmacological characterization ofthe melanocortin type 1 receptor in the sea bass[J].Gen Comp Endocrinol,2010,165(1):163-169.
[13]Henning F,Renz A J.Genetic,Comparative genomic,and expression analyses of the Mc1r Locus in the Polychromatic Midas Cichlid Fish(Teleostei,Cichlidae amphilophus sp.)Species Group[J].J Mol Evol,2010,70:405-412.
[14]聂庆华,刘清神,方梅霞,等.犬MC1R 基因的分子进化分析[J].遗传,2008,30(4):469-474.
[15]Anderson T M,vonHoldt B M,Candille S I,et al.Molecular and evolutionary history of melanism in North American gray wolves[J].Science,2009,323(5919):1339-1343.
[16]胡建尊,李康乐,项松平,等.瓯江彩鲤体色调控相关因子MC1R 的克隆与表达分析[J].上海海洋大学学报,2013,22(4):518-523.

