“灵巴菌质”抗肿瘤活性部位的体外筛选
尚文斌, 孙 钰, 潘稚云, 潘 扬
(南京中医药大学,江苏 南京 210029)
因巴豆毒性较大,内服须炮制后(巴豆霜)入药[17]。在前期工作中,我们采用灵芝菌Ganoderma lucidum(Curtis:Fr.) P.Karst.对巴豆进行独特的发酵法炮制,得到其固体发酵产物——“灵巴菌质”。研究表明,“灵巴菌质”的毒性成分脂肪油和总蛋白的含量已明显降低,这二种物质含量均低于生巴豆及传统炮制品(巴豆霜)[18];进一步实验还发现,“灵巴菌质”的毒性也有了明显的下降,且低于巴豆霜[19]。
通过体外培养和MTT比色法,考察“灵巴菌质”的提取物石油醚部位(PEE)、碱性醇提物(AME)和巴 豆 苷 (Cro) 对 SMMC-7721、MGC-803、A549、HepG-2肿瘤细胞增殖的影响,初步筛选这3种物质的抗肿瘤活性。
1 材料与方法
1.1 主要试剂与仪器
DMSO:PCR级;低熔点琼脂糖:生工生物工程股份有限公司;噻唑蓝/MTT:上海捷瑞生物工程有限公司;胰酶:美国Sigma公司;DMEM培养基:美国Life Technologies;其余试剂包括DMSO、甲醇、石油醚、乙腈等均为分析纯或色谱纯级,水为重蒸馏水。
HF 90二氧化碳培养箱,HF Safe 1200生物安全柜:上海力康生物医疗科技控股有限公司;Leica DM IL LED/DFC450倒置显微镜:德国徕卡仪器有限公司;Hitachi Corona MTP-601F全自动荧光酶标仪:日本日立公司;Sartorius BS 124S电子天平:0.1 mg,德国赛多利斯公司;手动移液器:德国Eppendorf公司。
1.2 化学对照品、瘤株与药品
巴豆苷:由本校凌云博士惠赠(成都普思生物科技有限公司,HPLC面积归一化法测定,其纯度≥98.5%);生巴豆:购自亳州辉睿中药科技有限公司,经潘扬教授鉴定为中药巴豆为大戟科植物巴豆Croton tiglium L.的干燥成熟果实;灵巴菌质(LBJZ):由作者所在实验室提供,制备方法参见文献[8];人肝癌SMMC-7721细胞和 HepG-2细胞、人胃癌MGC-803、人肺癌A549细胞:均由南京大学模式动物研究所惠赠。
1.3 实验方法
1.3.1 “灵巴菌质”石油醚提取部位、碱性醇提物的制备 取灵巴菌质940 g,粉碎,过40目筛,以石油醚、二氯甲烷、水饱和正丁醇和甲醇四个极性梯度依次进行索氏抽提12 h,提取液用旋转蒸发仪将溶剂挥尽后,60℃减压干燥成干浸膏,分别得石油醚、二氯甲烷、正丁醇和甲醇提取物各 150、17、7、50 g;其中石油醚即为石油醚部位 (petroleum ether extracts,PEE)。甲醇提取物用10%盐酸1 000 mL超声辅以搅拌1 h使溶解,过滤,滤液以10%氢氧化钠溶液调pH 9~10,再以4 000 mL正丁醇分3~5次进行萃取,合并萃取液,用旋转蒸发仪减压将溶剂挥尽后,60℃减压干燥成干浸膏,即得碱性醇提物(AME)约14 g。 PEE、AME均用DMSO 溶解成储备液备用,临用时以培养液稀释成所需浓度。
1.3.2 瘤株细胞的培养 将SMMC-7721、HepG-2、A549、MGC-803细胞接种于细胞培养瓶中,DMEM培养基含胎牛血清1 00 ml/L,青霉素100 kU/L和链霉素100 mg/L,置于37℃、5%CO2培养箱,相对饱和湿度的条件下培养。细胞长满后,弃去培养液,用PBS轻轻洗涤2次,加入0.25%胰酶-0.02%EDTA,37℃消化3~5 min,每两天按1∶3比例传代1次,均取对数生长期的细胞用于实验。
1.3.3 MTT比色法测定 消化收集对数增殖期细胞并调整成浓度5×107/L的细胞悬液,接种于96孔板,每孔100 μL,镜下观察确认细胞贴壁良好时,加入含不同质量浓度PEE、AME的培养液,使终质量浓度依次为 25、50、100、200 mg/L;对照品 Cro 终质量浓度依次为 100、200、350、500 μmol/L,以不含药物的培养基培养细胞(含相同浓度的溶剂)作为空白对照,以培养基作为空白孔调零组,每组设4个复孔。细胞和药物在37℃饱和湿度,体积分数5%CO2培养箱中分别孵育24 h和48 h后,每孔加入 20 μL MTT (5 g/L),37 ℃继续孵育 4 h, 终止培养,小心吸弃孔内上清培养液,每孔加入200 μL DMSO,振荡混匀10 min,使结晶物充分溶解。选择490 nm波长,在酶标仪上测定各孔光密度(optical density,OD)值。实验重复3次,按照下列公式计算细胞增殖抑制率(IR,%):
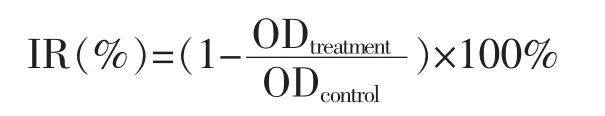
2 结果与讨论
2.1 PEE对4种肿瘤细胞的增殖的影响
1)对SMMC-7721细胞的增殖的影响很小,可以忽略不计;
另一方面,智能家居产品也提供了一种新型的早教形式。近两年,智能家居产品在科技的推动下逐渐渗透至年轻家庭生活的方方面面,其中母婴亲子类智能家居产品不仅能提供母婴知识,还能帮助宝宝学习知识,进行简单早教,因此广受欢迎。各类产品中最受追捧的智能家居产品是智能电视,家庭拥有比例为51%,远高于智能体重秤、智能可穿戴设备等其他智能产品。
2)对HepG-2细胞的增殖有明显的促进作用,质量浓度在100 mg/L时对HepG-2细胞在48 h的增殖促进率高达53.6%,与正常对照组比较均有极显著差异(P<0.001);
3)对MGC-803细胞的增殖有抑制作用,最高质量浓度抑制率仅为22.1%,没有实质性意义。
4)与正常组对照比较,随着的作用质量浓度增加和作用时间的延长,其对A549细胞生长的抑制率也明显增加,在一定质量浓度范围内呈剂量依赖性,100 mg/L药物作用A549细胞48 h后,抑制率达76.3%;200 mg/L作用A549细胞48 h后,抑制率分别高达81.4%。各浓度组在不同时间点比较差异均有极显著差异(P<0.001),结果见图1。
2.2 AME对4种肿瘤细胞增殖的影响
1)对SMMC-7721细胞的增殖有一定的抑制作用,质量浓度在100 mg/L和200 mg/L是抑制率分别为31.7%和38.9%,与正常对照组比较有显著性差异(P<0.05);
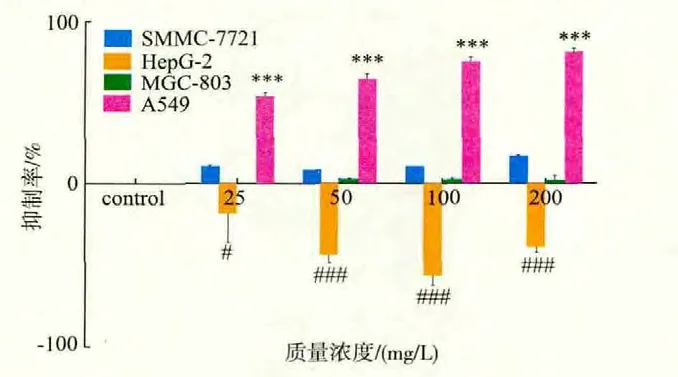
图1 PEE作用48 h后对肿瘤细胞增殖的影响Fig.1 Effects on tumor cell proliferation after treatment with PEE for 48 h
2)质量浓度在100 mg/L时,作用48 h后对HepG-2细胞增殖的促进率高达62.3%,与正常对照组比较均有极显著差异(P<0.001);
3)对MGC-803细胞增殖作用有一定的抑制作用,但作用不明显,与正常对照比较没有显著性差异。
4)随着作用质量浓度增加和作用时间的延长,其对A549细胞生长的抑制率也明显增加,在一定质量浓度范围内呈剂量依赖性和时间依赖性;与空白组相比较,在50、100、200 mg/L作用48 h后的抑制率均有极显著差异(P<0.001),最大质量浓度200 mg/L组在48 h的抑制率分别达67.78%,结果见图2。
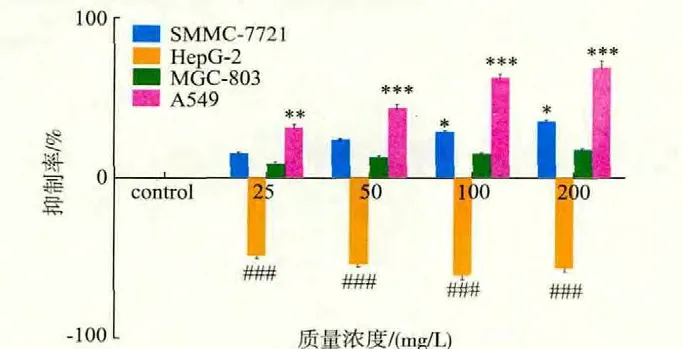
图2 AME作用48 h后对肿瘤细胞增殖作用影响Fig.2 Effects on tumor cell proliferation after treatment with AME for 48 h
2.3 Cro对A549细胞增殖的影响
与空白对照组相比,随着的作用质量浓度增加和作用时间的延长,Cro对A549细胞生长的抑制率也明显增加,在一定质量浓度范围内呈剂量依赖性和时间依赖性,药物作用A549细胞48 h后的抑制率均明显高于相应浓度药物作用于A549细胞24 h后的抑制率,350 μmol/L药物作用A549细胞24 h和48 h后,抑制率分别为42.75% 和62.73%,500 μmol/L作用A549细胞24 h和48 h后,抑制率分别高达56.85%和72.0%,以上两组与空白对照组相比均有极显著性差异(P<0.001),结果见图3。
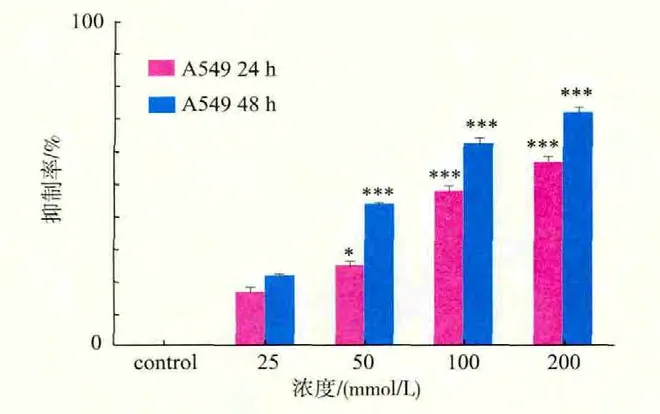
图3 Cro作用48 h后对A549肿瘤细胞增殖作用影响Fig.3 Effects on A549 tumor cell proliferation after treatment with Cro for 48 h
3 结语
将 “灵巴菌质”分为石油醚、二氯甲烷、正丁醇和碱性甲醇提取物四个部位,由于石油醚(PEE)和碱性甲醇提取物(AME)得量相对较大,因此,首先对这两个提取部位进行了抗肿瘤活性的筛选,今后将对另外两个提取部位的药理作用继续进行探索。实验结果显示,PEE和AME对SMMC-7721、MGC-803、A549、HepG-2等4种不同的肿瘤细胞增殖产生不同的效应,有抑制增殖作用;但也有促进增殖作用;与巴豆的有效成分巴豆苷一样,PEE和AME对肺癌A549细胞生长均呈现出明显的抑制作用。
“灵巴菌质”的不同提取物对肿瘤细胞的抑制作用以及不同的效应可能与其活性组分有关。前期研究发现,PEE部分主要为低极性的巴豆脂肪油,甲酯化后经GC-MS法分析结果表明,“灵巴菌质”与生巴豆及其炮制品相比,无论在脂肪油成分种类还是相对含量上均存在一定差异[18]。AME部分则为极性较大的成分,除主要含有巴豆苷外,也含有巴豆三氮唑苷(crotonotriazole nucleotide),在炮制品巴豆霜中也发现存在此成分,而生巴豆中则没有[20],说明巴豆发酵与炮制物质基础类同。巴豆三氮唑苷是前期对“灵巴菌质”化学成分进行分离时,在正丁醇提取部位得到一个新化合物,通过UV、IR、1H NMR、13C NMR、2D NMR和MS确定其化学结构式,化学名为:1-b-D-呋喃核糖-6-氨基-1,2,3-三氮唑并 [5,4-d]吡啶 (1-b-D-ribofuranose-6-amino-1,2,3-triazolo[5,4-d]pyridine)。 对巴豆三氮唑苷的药理活性进行初步研究,发现其有一定的抗病毒活性,但并没有抑瘤效果,提示AME的抗肿瘤效应与巴豆三氮唑苷无关,而与巴豆苷相关。
此外,肿瘤细胞具有相同的病理机制和表型,又具有不同的病理特点和组织特异性,决定其对抗肿瘤药物的敏感性的差异[21]。本研究中PEE和AME抗肿瘤作用的选择性,说明两者具有不同的肿瘤抑制效应。今后需从活性组分分析和肿瘤细胞的不同分子靶点的角度进一步开展研究。
[1 ] 李庆铎.巴豆临床应用综述[J].甘肃中医,1991(4):43-46.LI Qingduo.A review o f clinical applicat ion of Fructus crotonis [J].Gansu Journal of Traditional Chinese Medicine,1991(4):43-46.(in Chinese)
[2 ] 徐立生.巴豆生物碱治疗胃癌 128 例临床观察[J].中华肿瘤杂志,1992,14(5):392.XU Lisheng.128 cases of clinical observation of gastric cancer treated by Croton alkaloids [J].Chinese Journal of Oncology,1992,14(5):392.(in Chinese)
[3]狄洌,许冬青,王明艳,等.巴豆生物碱对人胃癌细胞 SGC-7901 p53基因表达的影响[J].辽宁中医杂志,2003,30(12):1019.DI Lie,XU Dongqing,WANG Mingyan,et al.Effect on human gastric cancer cell SGC-7901 p53 gene expression of Croton alkaloids[J].Liaoning Journal of Traditional Chinese Medicine,2003,30(12):1019.(in Chinese)
[4]许冬青,王明艳,瞿融.巴豆生物碱对人胃腺癌细胞SGC-7901 Fas基因表达影响的研究[J].中医药学报,2005,33(2):9-10.XU Dongqing,WANG Mingyan,QU Rong.Study on human gastric cancer SGC-7901 fas gene expression of croton alkaloids[J].Acta Chinese Medicine and Pharmacology,2005,33(2):9-10.(in Chinese)
[5]赵凤鸣,许冬青,王明艳,等.巴豆生物碱对人胃癌细胞 SGC-7901的诱导分化作用研究[J].中医药学刊,2005,23(1):134,184.ZHAO Fengming,XU Dongqing,WANG Mingyan,et al.Study on SGC-7901 human gastric cancer cell differentiation-inducing effect of croton alkaloids[J].Chinese Archive of Traditional Chinese Medicine,2005,23(1):134,184.(in Chinese)
[6]陈美娟,瞿融,吴慧平,等.巴豆生物碱对人胃癌细胞SGC-7901表型逆转作用研究[J].浙江中医学院学报,2005,29(5):64-65.CHEN Meijuan,QU Rong,WU Huiping,et al.Research of Croton seed alkaloid on phenotype reversion of human being stomach cancer cell SGC-7901[J].Journal of Zhejiang College of Traditional Chinese Medicine,2005,29(5):64-65.(in Chinese)
[7]许冬青,詹臻,王明艳,等.巴豆生物碱诱导人胃癌细胞SGC-7901分化及分子机制的研究[J].中国中医基础医学杂志,2009,15(7):545-546.XU Dongqing,ZHAN Zhen,WANG Mingyan,et al.Study of the Croton alkaloids induced gastric cancer cell SGC-7901 differentiation and the molecular mechanisms [J].Chinese Journal of Basic Medicine in Traditional Chinese Medicine,2009,15(7):545-546.(in Chinese)
[8]朱均,吴智南,徐卫东,等.巴豆生物碱对人骨肉瘤细胞细胞周期凋亡及对Bcl-2基因表达的影响[J].中华中医药学刊,2009,27(7):1450-1452.ZHU Jun,WU Zhinan,XU Weidong,et al.Effect of Croton alkaloid (CA) on cell cycle apoptosis and Bcl-2 gene expression in human osteosarcoma cell[J].Chinese archives of Traditional Chinese Medicine,2009,27(7):1450-1452.(in Chinese)
[9]刘秀德,隋在云.巴豆总生物碱对癌细胞质膜流动性及胞浆基质结构的影响[J].山东中医学院学报,1995,19(3):192-194.LIU Xiude,SUI Zaiyun.The effects on cancer cell plasma membrane fluidity and cytoplasmic matrix structure of the total Croton alkaloids[J].Journal of Shandong University of Traditional Chinese Medicine,1995,19(3):192-194.(in Chinese)
[10]陈武,陈鹏英,刘鹏,等.巴豆生物碱对人肝癌SMMC-7721细胞凋亡及Bax,Bcl-2蛋白表达的影响[J].中国实验方剂学杂志,2011,17(11):199-201.CHEN Wu,CHEN Pengying,LIU Peng,et al.Effect of Crotonis fructus alkaloid on apoptosis of human hepatoma SMMC-7721 cells and Bcl-2/Bax expression [J].Chinese Journal of Experimental Traditional Medical Formulae,2011,17 (11):199-201.(in Chinese)
[11]赵小迎,陈俊,蔡平生.巴豆生物碱抑制卵巢癌细胞增殖和诱导其凋亡的实验研究 [J].中国全科医学,2010,13(7C):2345-2348.ZHAO Xiaoying,CHEN Jun,CAI Pingsheng.Effect of Croton alkaloid on cell cycle,apoptosis and PCNA gene expression in human ovarian cell[J].Chinese General Practice,2010,13(7C):2345-2348.(in Chinese)
[12]许群,方轶萍,赵小迎.巴豆生物碱诱导Hela细胞凋亡及其作用机制[J].中国生化药物杂志,2010,31(6):392-395.XU Qun,FANG Yiping,ZHAO Xiaoying.The apoptosis of Hela cells induced by croton alkaloid and its mechanism[J].Chinese Journal of Biochemical Pharmaceutics,2010,31(6):392-395.(in Chinese)
[13]许群,方轶萍,赵小迎,等.巴豆生物碱上调TRAIL配体、caspase-8的表达诱导HeLa细胞凋亡的体外研究[J].海峡药学,2011,23(2):179-184.XU Qun,FANG Yiping,ZHAO Xiaoying,et al.Apoptosis induced by Croton alkaloid(CA) on cervical cancer Hela cells through up-regulation of TRAIL and caspase-8 in vitro[J].Strait Pharmaceutical Journal,2011,23(2):179-184.(in Chinese)
[14]徐建国,马俊英,杨贵生,等.巴豆煎液对人早幼粒细胞白血病细胞的诱导分化研究[J].中华血液学杂志,1990,11(10):538-539.XU Jianguo,MA Junying,YNNG Guisheng,et al.The research of Croton water extracts induced differentiation of human promyelocytic leukemia cells[J].Chinese Journal of Hematology,1990,11(10):538-539.(in Chinese)
[15] 田艳伟.巴豆水提液对 HL-60 细胞的诱导分化作用[J].山西医药杂志,2002,31(3):265.TIAN Yanwei.The influence of Croton water extracts induced differentiation of HL-60 cells [J].Shanxi Medical Journal,2002,31(3):265.(in Chinese)
[16] Kim J H,Lee S J,Han Y B,et al.Isolation of isoguanosine from Croton tiglium and its anti-tumor activity [J].Arch Pharm Res,1994,17(2):115-118.
[17]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:74-75.
[18] 刘春美,吴晓峰,潘扬,等.巴豆发酵品与生巴豆、巴豆霜中毒性成分的含量比较[J].中国药房,2011,22(43):4071-4074.LIU Chunmei,WU Xiaofeng,PAN Yang,et al.Comparison of toxic ingredient contents of fermented Croton tiglium,crude C.tiglium and defatted C.tiglium seed powder[J].China Pharmacy,2011,22(43):4071-4074.(in Chinese)
[19]潘扬,吴晓峰,涂霞,等.中药巴豆经炮制与发酵后毒性效应的比较[J].食品与生物技术学报,2011,30(5):788-792.PAN Yang,WU Xiaofeng,TU Xia,et al.Toxicological comparison between defatted Croton seed powder and two fermentation products of Fructus crotonis[J].Journal of Food Science and Biotechnology,2011,30(5):788-792.(in Chinese)
[20]孙钰,彭薇,潘扬,等.灵巴菌质碱性醇提物体外抑制A549细胞增殖的作用及机制[J].南京中医药大学学报:自然科学版,2013,29(4):362-367.SUN Yu,PENG Wei,PAN Yang,et al.The proliferative inhibition and its mechanism of alkaline constituents of Lingba Junzhi on human non-small cell lung cancer A549 cells[J].Joruanl of Nanjing University of TCM:Nat Sci Ed,2013,29(4):362-367.(in Chinese)
[21] Henderson-Jackson E B,Conley A,Bui M M.Molecular Pathology and Diagnostics of Cancer[M].Netherlands:Springer,2014:397-421.

