枯草芽孢杆菌Bs916在番茄根部的定殖
乔俊卿, 陈志谊, 梁雪杰, 刘永锋, 刘邮洲
(江苏省农业科学院植物保护研究所,江苏 南京 210014)
枯草芽孢杆菌可产生强抗逆性的内生芽孢,其抑菌谱广,对多种植物病害具有良好防效,且对植物具有促生作用。已有研究结果表明,芽孢杆菌防治植物病害的机制主要有:与病原菌竞争营养和生态位点、分泌抗菌物质抑制病原菌的生长和激发植物诱导系统抗性[1]。然而,生防菌防治植物病害的先决条件是其在引进位点能够有效定殖[2-3]。因此,生防菌的定殖能力及动态规律研究已经成为生防微生物筛选、研发的重要参考指标。
生防菌在植物根际的有效定殖具有以下特征:能够吸附在植物根表面;能够在生长的植物根系上定殖;能够利用种子或根系泌出液为营养繁殖扩展[4]。生防芽孢杆菌通常以生物膜的形式定殖于植物根际。生物膜可以提高生防菌的生存竞争力,帮助其抵抗抗生素等环境压力,逃避原生动物的捕食;生物膜还能维持生防菌在植物根部的定殖数量,从而提高细菌分泌的胞外酶和抗生素的浓度,使其达到有效浓度,保证生防菌发挥正常的生防和促生作用[5]。芽孢杆菌生物膜主成分是胞外多糖、TasA蛋白、多聚谷氨酸以及一些DNA等物质[6]。因此,生物膜的主成分是影响芽孢杆菌在植物根际定殖的重要因子。
江苏省农业科学院植物保护研究所水稻病害与生防研究室经过长期研究,积累了大量的生防菌株资源,并开发了相关产品,如防治水稻纹枯病的生物制剂“纹曲宁”[7-9]和防治水稻细菌性病害的“叶斑宁”等[10-11]。研究结果表明,枯草芽孢杆菌 Bs916(纹曲宁主要活性成分)对多种植物病原真菌和细菌都具有抑制作用;全基因组测序和质谱检测显示,Bs916可产生多种脂肽类和聚酮类抗生素,如表面活性素、杆菌霉素L等[12-14]。本研究拟在Bs916全基因组测序平台和其抑制番茄青枯病菌的基础上,进一步分析Bs916生物膜形成的关键基因,研究其生物膜形成能力,并采用植物MS平板定殖研究法和温室盆栽试验评估Bs916在番茄根部的定殖能力和规律,旨在为芽孢杆菌Bs916防治番茄青枯病的田间应用提供理论基础。
1 材料与方法
1.1 供试材料
试验用病原菌番茄青枯菌(Ralstonia solanacearum,RSQ)和生防菌(Bacillus subtilis Bs916)及其绿色荧光蛋白(GFP)标记菌株Bs916G均由江苏省农业科学院植物保护研究所水稻病害与生防研究室保存。枯草芽孢杆菌活化和发酵均用改良酵母膏蛋白胨葡萄糖(Yeast peptone glucose,YPG)培养基(酵母膏5 g、胰蛋白胨5 g、葡萄糖5 g、pH 7.0~7.2,固体培养基需加琼脂15 g)。菌株Bs916G由姚震声[15]构建,其抗生素使用浓度为:氯霉素(Cm),5 μg/ml。番茄青枯病菌用营养琼脂(Nutrient agar,NA)培养基(牛肉浸膏 3 g、酵母膏 1 g、蛋白胨5 g、葡萄糖10 g、蒸馏水1 000 ml,固体培养基需加琼脂15 g)活化培养。试验所用番茄品种为巨粉宝,枯草芽孢杆菌在无菌番茄根部定殖试验采用植物普通组培(Murashige and skoog,MS)培养基(购自荷兰 Duchefa Biochenie 公司)[16]。
1.2 平板对峙试验
将枯草芽孢杆菌Bs916和Bs916G在YPG固体平板活化,挑取单菌落入YPG液体培养基发酵,33℃、150 r/min振荡培养 48 h(菌含量:2×109CFU/ml)。番茄青枯病菌在NA固体培养基上活化,移入50 ml NA培养液中,28℃、150 r/min振荡培养24 h,吸取青枯菌液涂布空白NA平板(0.2 ml菌液/平板,青枯菌含量:1×108CFU/ml)。NA平板四周呈十字架型打4个直径5 mm的小孔(离培养皿中心距离约为30 mm),每孔上滴入生防菌液5 μl。每处理重复3皿。28℃恒温培养2 d后,调查抑菌圈直径。
1.3 芽孢杆菌生物膜形成能力检测
芽孢杆菌Bs916和Bs916G的生物膜形成能力在MSgg培养液中进行评估。MSgg培养基配方如下:磷酸钾5 mmol/L,Mops(pH=7)100 mmol/L,MgCl22 mmol/L, CaCl2700 μmol/L, FeCl350 μmol/L,MnCl250 μmol/L,ZnCl21 μmol/L,硫胺素2 μmol/L,甘油0.5%,谷氨酸0.5%、色氨酸50 mg/L,苯丙氨酸50 mg/L[6]。将芽孢杆菌Bs916和Bs916G分别接种于10 ml YPG液体培养基中,28℃、180 r/min培养16 h。然后取5 μl培养液,转接到含有3 ml MSgg培养液的12孔细胞培养板中,每个菌株接4孔,重复3次。37℃静置培养24~48 h后,观察生物膜形成情况。
1.4 Bs916在无菌番茄根部的定殖
Bs916发酵48 h后收集菌体,并用灭菌0.9%NaCl稀释至OD600为1.0待用(菌含量约为5×107CFU/ml)。番茄种子于3%次氯酸钠溶液中浸泡5 min灭菌,无菌水冲洗至无味,置于Bs916生防菌液中浸泡24 h,种子晾干后,播种于MS琼脂平板,每平板播种5粒,重复3次,静置于28℃光照培养箱。15 d后,称取番茄根,将其研磨后用无菌水按照倍比稀释法,涂布YPG固体平板,检测生防菌Bs916在番茄根部的定殖数量。
1.5 盆栽定殖
GFP标记菌株Bs916G于YPG中发酵48 h,收集菌液待用,测定原液菌含量,约为 2×109CFU/ml。番茄青枯菌RSQ于NA培养液中培养48 h,收集菌液待用,菌含量约1×109CFU/ml。自然土过筛,与营养土和蛭石按1∶1∶1配比,将催芽的番茄种子播入其中,待番茄苗4叶1心时定植于单独盆钵中。盆栽定殖试验共3个处理,分别是单浇Bs916G菌液处理(Bs916G)、先浇 Bs916G菌液后浇青枯菌处理(Bs916G+RSQ)和浇无菌水对照(CK),每处理15钵,重复3次。番茄定植前,需浇生防菌的处理,先将番茄苗在生防菌液中浸根20 min,待定植后,每棵苗根围再浇Bs916G菌液20 ml;Bs916G+RSQ处理中,每棵苗需同时灌根青枯病菌菌液10 ml;对照处理中,番茄苗在无菌水中浸根20 min,定植后并灌根无菌水20 ml。灌根处理后1 d、2 d、3 d、5 d、7 d、14 d 定期采集番茄根,每次取苗3棵,抖落根土,并称取根部1 g,用无菌水振荡洗涤,倍比稀释后,分别涂布含有10 μg/ml氯霉素的YPG平板,28℃静置培养48~72 h后,统计枯草芽孢杆菌Bs916G菌落数。
1.6 数据分析
试验数据采用Excel 2003和SPSS 16.0软件进行统计分析,Duncan's新复极差法分析不同处理间差异显著性。
2 结果
2.1 枯草芽孢杆菌Bs916生物膜形成关键基因的发掘
全基因组序列分析显示,枯草芽孢杆菌Bs916含有完整的生物膜形成关键基因(簇),包括胞外多糖(EPS)合成酶编码基因簇、TasA蛋白和γ-多聚谷氨酸聚合酶编码基因簇(表1)。其中胞外多糖(EPS)合成酶编码基因簇大小为15 715 bp,包含15个编码基因,与已报道的氨基酸序列同源性达99%~100%;TasA蛋白编码基因大小786 bp,与已报道蛋白同源性达100%;γ-多聚谷氨酸聚合酶编码基因簇大小为4 369 bp,与已报道的相关氨基酸序列同源性达96%~100%。3个完整且高度同源的编码基因(簇)是Bs916生物膜形成的有利遗传保障。

表1 枯草芽孢杆菌Bs916生物膜形成关键基因(簇)信息Table 1 The details of gene clusters related to biofilm formation in Bacillus subtilis Bs916
2.2 GFP标记菌株Bs916G的拮抗活性稳定性及生物膜形成能力
平板对峙试验结果(表2)显示,枯草芽孢杆菌Bs916及其GFP标记菌株Bs916G对番茄青枯病菌均显示较好的抑制作用,抑菌圈直径都在13 mm左右,且无显著差异,这表明GFP的表达并未影响Bs916对番茄青枯菌的拮抗效果。此外,生物膜形成能力结果(图1)显示,Bs916和Bs916G在MSgg培养基中都能够形成生物膜,且质地厚实,多皱褶。这也表明GFP的表达并不影响芽孢杆菌Bs916生物膜的形成能力。
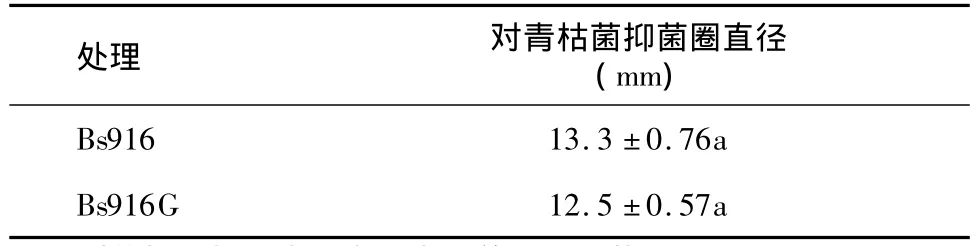
表2 枯草芽孢杆菌Bs916和Bs916G对番茄青枯菌的拮抗作用Table 2 Antagonistic activity of Bacillus subtilis Bs916 and Bs916G against R.solanacearum
2.3 枯草芽孢杆菌Bs916在无菌番茄根部的定殖能力
如图2所示,在MS平板试验中,枯草芽孢杆菌Bs916浸种的番茄根系两侧均看到白色菌痕,而未浸种的番茄根系两侧并无菌痕,这表明Bs916能够利用番茄根系分泌物在番茄根际定殖生存。平板回收测定Bs916的定殖含量显示,Bs916在番茄根部的定殖量为每1 g根3.1×107CFU。

图1 枯草芽孢杆菌Bs916和Bs916G生物膜Fig.1 The biofilm of Bacillus subtilis Bs916 and Bs916G in MSgg medium

图2 Bs916在MS平板试验中的番茄根部定殖情况Fig.2 Colonization of Bs916 on tomato roots in the MS plate
2.4 枯草芽孢杆菌Bs916G在盆栽番茄根部的定殖动态变化
利用GFP标记菌株Bs916G灌根番茄苗后,通过抗性平板回收法检测Bs916G在番茄根部的定殖情况,结果显示:单独灌根 Bs916G的处理中,Bs916G在番茄根部的定殖数量呈现先下降后逐渐上升的趋势,即灌根1 d后,番茄根表定殖量可以达到1×109CFU/g,第5 d下降到最低点,仅为每1 g根1×106CFU,随后逐步回升达到1×107CFU/g,第7 d、14 d稳定在1×107CFU/g。在灌根Bs916G并同时接种青枯菌的处理中,Bs916G的定殖数量变化趋势和未接种处理基本一致,其定殖数量也基本相近,但在第14 d时,Bs916G的定殖量明显比未接种低约10倍,仅为1×106CFU/g(图3)。
3 讨论
芽孢杆菌生物膜的成分主要是胞外多糖、TasA蛋白和γ-多聚谷氨酸。胞外多糖由eps操纵子负责合成,该操纵子编码胞外多糖合成酶,TasA蛋白由tasA负责合成并泌出到胞外[17]。Chen等研究结果表明,枯草芽孢杆菌单独突变eps或tasA基因,虽然能产生微弱的生物膜,但其在番茄根部的定殖能力下降,而eps和tasA的双突变体不产生任何生物膜,在番茄根部基本不能定殖[18-19]。本研究结果显示,枯草芽孢杆菌Bs916中具有完整的生物膜形成关键基因(簇),包括胞外多糖(EPS)合成酶编码基因簇,TasA蛋白和γ-多聚谷氨酸聚合酶编码基因簇,其大小分别为15 715 bp、786 bp和4 369 bp,与已报道的相关氨基酸序列同源性达96%~100%。同时,本研究的后续试验已经构建了tasA基因的突变体,并发现该突变体的生物膜形成能力严重下降,在番茄根系定殖能力减弱,这与Chen等[19]报道的结果一致。由此可见,生物膜是芽孢杆菌在植物根部定殖的重要存在形式。
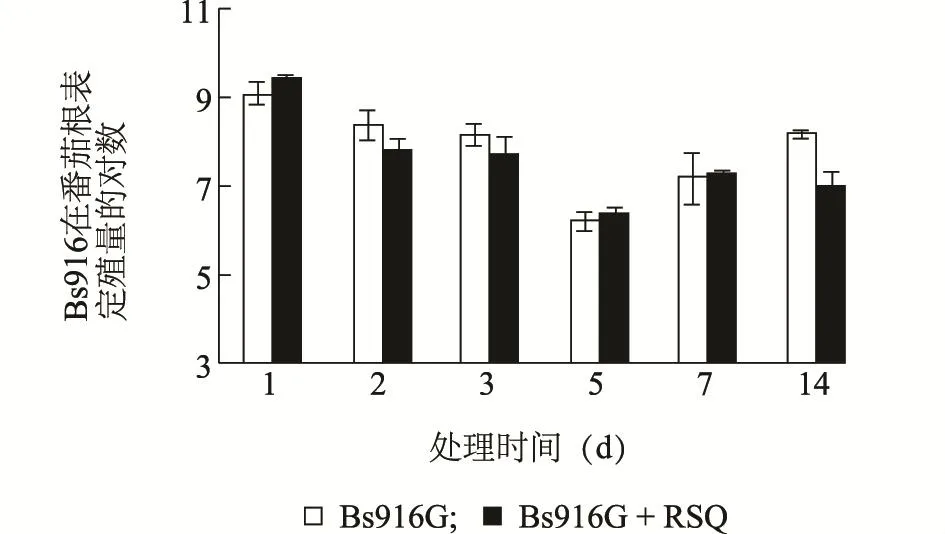
图3 枯草芽孢杆菌Bs916G在盆栽番茄根部的定殖动态变化Fig.3 Dynamics of colonization of B.subtilis Bs916G on the root of tomato over time
绿色荧光蛋白(GFP)是一种良好的标记物,近年来,GFP被广泛应于标记生防芽孢杆菌,用来观察和研究生防菌在植物根部的行为和互作方式[20-21]。刘邮洲等利用GFP标记枯草芽孢杆菌PTS-394,并进行了其在番茄根围定殖的观察研究[22]。本研究首先比较了GFP标记的枯草芽孢杆菌Bs916G与野生型Bs916的生物膜形成能力和抑制番茄青枯菌的能力,确认两者无显著差异后,利用GFP标记菌株进行其在番茄根部的定殖动态和规律研究,为生防芽孢杆菌Bs916田间防治番茄青枯病奠定了理论基础。
生防芽孢杆菌施用后,稳定的定殖能力是其发挥生防、促生作用的关键因素[23],因此,生防菌的定殖能力及动态规律研究已经成为生防微生物筛选、研发的重要参考指标之一。刘庆丰等[24]报道,枯草芽孢杆菌XF-1能在大白菜根围、根表和根内长时间定殖,有利于占据有利生态位点,从而抑制白菜根肿病菌的侵染和繁殖。本试验结果表明,枯草芽孢杆菌Bs916能够在番茄根部定殖,其在番茄根部的定殖数量呈现先下降后逐渐上升的趋势,即使接种青枯菌,Bs916的定殖数量的变化趋势和未接种处理也基本一致,但在第14 d时,其定殖量明显比未接种低约10倍。以上结果表明,枯草芽孢杆菌Bs916可以在番茄根部有效定殖,这是其在田间发挥防治番茄青枯病的重要保障因素。
[1] LUGTENBERG B,KAMILOVA F.Plant-growth-promoting rhizobacteria [J].Annual Review of Microbiology,2009,63:541-556.
[2] 殷幼平,袁训娥,李 强,等.生防菌枯草芽孢杆菌CQBS03的绿色荧光蛋白基因标记及其在柑橘叶片上的定殖[J].中国农业科学,2010,43(17):3555-3563.
[3] 王志远,吴兴兴,吴毅歆,等.解淀粉芽孢杆菌B9601-Y2抗性基因标记及其在作物根部的定殖能力[J].华中农业大学学报,2012,31(3):313-319.
[4] KLOEPPER J W.Plant growth-promoting rhizobacteria as biological control agents[M]//Metting F B.Soil Microbial Ecology:Applications in Agricultural and Environmental Managment.New York:Marcel Dekker Inc.,1992:255-274.
[5] 刘 俊.解淀粉芽孢杆菌CO6防治桃褐腐病菌的机制及其产生的γ-多聚谷氨酸在定殖中的作用[D].南京:南京农业大学,2010.
[6] BRANDA,S S,CHU F,KEARNS D B,et al.A major protein component of the Bacillus subtilis biofilm matrix [J].Molecular Microbiology,2006,59:1229-1238.
[7] 陈志谊,许志刚,高泰东,等.水稻纹枯病拮抗细菌的评价及利用[J].中国水稻科学,2000,14(2):98-102.
[8] 陈志谊,刘 荣,刘永锋.水稻纹枯病拮抗细菌B-916的选育[J]. 中国生物防治,2003,19(1):15-18.
[9] 陈志谊,刘永锋,陆 凡.井冈霉素和生防菌Bs-916协同控病作用及增效机理[J].植物保护学报,2003,30(4):429-434.
[10]张荣胜,陈思宇,王晓宇,等.解淀粉芽孢杆菌Lx-11防治水稻细菌性条斑病应用技术研究[J].中国生物防治,2014,29(4):595-600.
[11]张荣胜,王晓宇,罗楚平,等.解淀粉芽孢杆菌Lx-11产脂肽类物质鉴定及表面活性素对水稻细菌性条斑病的防治作用[J].中国农业科学,2013,46(10):2014-2021.
[12] WANG X,LUO C,CHEN Z.Genome sequence of the plant growth-promoting rhizobacterium Bacillus sp.strain 916 [J].Journal of Bacteriology,2012,194(19):5467-5468.
[13] LUO C,LIU X,ZHOU H,et al.Nonribosomal peptide synthase gene clusters for lipopeptide biosynthesis in Bacillus subtilis 916 and their phenotypic functions[J].Applied and Environmental Microbiology,2015,81(1):422-431.
[14] LUO C,ZHOU H,ZOU J,et al.Bacillomycin L and surfactin contribute synergistically to the phenotypic features of Bacillus subtilis 916 and the biocontrol of rice sheath blight induced by Rhizoctonia solani[J].Applied Microbiology and Biotechnology,2015,99(4):1897-1910.
[15]姚震声,陈中义,陈志谊,等.绿色荧光蛋白基因标记野生型生防枯草芽孢杆菌的研究[J].生物工程学报,2003,19(5):551-555.
[16] MURASHIGE T,SKOOG F.A revised medium for rapid growth and bio assays with tobacco tissue cultures[J].Physiologia Plantarum,1962,15:473-479.
[17] BRANDA S S,GONZALEZ-PASTOR J E,DERVYN E,et al.Genes involved in formation of structured multicellular communities by Bacillus subtilis[J].Journal of Bacteriology,2004,186,3970-3979.
[18] BEAUREGARD P B,CHAI Y,VLAMAKIS H,et al.Bacillus subtilis biofilm induction by plant polysaccharides[J].Proc Natl Acad Sci USA,2013,110(17):E1621-1630.
[19] CHEN Y,CAO S,CHAI Y,et al.A Bacillus subtilis sensor kinase involved in triggering biofilm formation on the roots of tomato plants[J].Molecular Microbiology,2012,85(3):418-430.
[20] 郝变青,马利平,乔雄梧.GFP标记的植物促生菌B96-Ⅱ-gfp的定殖能力研究[J].中国生态农业学报,2010,18(4):861-865.
[21]杨秀荣,田 涛,孙淑琴,等.GFP标记生防细菌B579及其定殖能力检测[J].植物病理学报,2013,43(1):82-87.
[22]刘邮洲,梁雪杰,乔俊卿,等.枯草芽孢杆菌PTS-394的GFP标记及其定殖能力[J].植物保护学报,2014,41(4):416-422.
[23] FAN B,BORRISS R,BLEISS W,et al.Gram-positive rhizobacterium Bacillus amyloliquefaciens FZB42 colonizes three types of plants in different patterns[J].Journal of Microbiology,2012,50:38-44.
[24]刘庆丰,熊国如,毛自朝,等.枯草芽孢杆菌XF-1的根围定殖能力分析[J].植物保护学报,2012,39(5):425-430.
