温湿度交互作用对闽楠幼苗形态和生理生化的影响
安常蓉,韦小丽*,叶嘉俊,王明丹,田萧肖,段如雁
(1.贵州大学 林学院,贵州 贵阳550025;2.安龙县洒雨镇林业站,贵州 安龙552404)
闽楠(Phoebe bournei)是我国珍贵用材树种,渐危种。分布于浙江、福建、江西、广东、贵州等地区海拔200~1 000m的常绿阔叶林中,被列为国家二级保护植物[1]。由于闽楠的渐危,目前对闽楠的研究也越来越受到重视,研究领域包括闽楠的种苗繁育[2-9]、造林技术[10-12]、遗传多样性[13]、木材特性[14]等方面。而关于高温与相对湿度组合对闽楠生长和生理生化的影响未见报道。随着全球气候变化,高温、干旱、水涝、冰冻等逆境胁迫频繁发生,研究者们越来越关注植物对逆境的生态适应性。夏季的高温是影响林木生长发育的重要逆境因子之一,尤其对林木幼苗生长影响极大,幼苗能否忍耐高温逆境成苗直接关系到林木育苗的成败。高温往往伴随着土壤干旱、低湿,前人的研究主要考虑高温单一因子的影响[15-17],而对温度、湿度、土壤干旱的交互影响缺乏研究。本研究拟采取人工模拟不同的高温和相对湿度组合,探讨闽楠幼苗对温湿度交互作用的反应和适应,找出闽楠幼苗适宜的温湿度条件和能够忍受的温湿度条件,为生产上进行闽楠育苗应对高温干旱逆境采取相应技术措施提供理论依据。
1 材料与方法
1.1 试验材料
以1年生的闽楠苗作试验材料。于2013年4月上旬,选择生长一致、无病虫害的幼苗,苗木高、地径分别为(22.1±0.5)cm,地径(0.34±0.05)cm。将苗木栽种在规格为直径12.9cm、高9cm的花盆中,盆栽土壤为黄壤和腐殖土等量混合,每盆1株,共栽植200盆,在幼苗恢复期间进行常规水肥管理。
1.2 试验设计
设置25℃、30℃、35℃、40℃4个温度梯度和50%、65%和80%3个相对湿度的组合,用RXZ智能型人工气候箱(宁波江南仪器厂)控制实验条件,光照强度均为22 000lx,以25℃与不同湿度的组合为对照。白天温度按设计控制,时间为8h,考虑到4个温度条件下实际昼夜温差存在差异,分别设计夜晚温度为12℃、16℃、18℃和22℃,时间为16h。每处理15盆苗,处理前,充分浇水使苗盆中的土壤含水量基本保持一致,处理过程中不补充水分,为减少处理过程中的物理蒸发,用塑料薄膜覆盖苗盆表面,并定期测定土壤相对含水量。每天观测苗木的形态变化,分别在处理5、10、15d取样测定苗木生理生化指标变化,每处理测定5次重复。试验后期阶段由于高温导致叶片出现斑点和焦边现象时,取样的叶片要去掉相应的枯焦部分。
1.3 生理生化指标的测定
叶片相对含水量测定采用饱和鲜重法[18];叶绿素含量测定参照混合液直接浸提法[19];细胞质膜透性测定参照电导率法[18];丙二醛(MDA)质量摩尔浓度采用硫代巴比妥酸法从测定[20];超氧化物歧化酶(SOD)测定采用抑制 NBT光还原方法[21];脯氨酸(Pro)含量采用酸性茚三酮法[21];根系活力测定采用α-萘胺氧化法进行测定[22]。
1.4 数据统计与分析
采用Excel对数据进行计算整理,用SPSS进行不同处理指标的方差分析。
2 结果与分析
2.1 温湿度交互作用下闽楠幼苗土壤含水量变化
相同温度条件下,随着相对湿度的降低和胁迫时间的延长,土壤含水量变化呈现下降趋势(表1);相同湿度条件下,随着胁迫温度的升高,土壤含水量显著下降。胁迫15d时,35℃+50%、40℃+50%组合分别比对照组下降了50.0%和33.3%。温湿度组合互作效应均表现为4个温度与50%相对湿度的组合土壤含水量随着时间的延长下降明显,可见高温低湿胁迫加剧苗盆土壤含水量的下降,从而导致闽楠幼苗一系列指标的变化。

表1 温湿度交互作用下盆栽苗土壤含水量变化(平均值+标准差)Table 1 The variation of soil water content in pot seedlings under temperature and humidity interaction process(mean+SE)
2.2 温湿度交互作用对闽楠幼苗形态的影响
通过观察发现,各组合中,25℃与不同相对湿度的组合条件下植株生长正常,形态没有发生变化。高温与不同湿度的互作条件下,随着温度增加,湿度降低,叶片受伤害的时间提前。35℃+50%组合处理的第5天表现出嫩叶发黄,35℃+50%组合处理第10天,幼苗出现枯焦的现象;15d时,35℃+65%和35℃+50%组合植株失水萎靡,老叶反卷现象严重;40℃条件下,5d时,部分植株的嫩叶部位失去支撑力,颜色开始变黄,第10天时,相对湿度为65%和50%组合的全部植株枯焦且叶边缘的枯焦面积进一步扩大,部分老叶有脱落现象。在整个处理过程中,30℃+80%、35℃+80%组合幼苗叶片无明显的变化。由此可见,35℃+65%、35℃+50%组合处理随着时间的持续对幼苗叶片造成轻度的伤害;40℃+65%、40℃+50%组合处理随着时间持续对闽楠幼苗叶片造成严重伤害。
2.3 温湿度交互作用下对闽楠幼苗生理生化指标的影响
2.3.1 叶片相对含水量 相同温度条件下,随着相对湿度的降低和胁迫时间的延长,幼苗叶片相对含水量(RWC)呈下降趋势(表2),不同相对湿度和不同胁迫时间幼苗叶片RWC差异显著(p<0.05)。相同湿度条件下,随着胁迫温度的升高,叶片RWC逐渐增加,不同温度处理间叶片RWC差异显著(p<0.05)。胁迫15d时,35℃+50%、40℃+50%组合分别比相对湿度为80%时下降了86.6%和79.0%。温湿度组合互作效应均表现为4个温度与80%相对湿度的组合叶片RWC最高,处理期间3个时间段测得的叶片RWC平均值都>94.0%,而40℃+50%的处理叶片RWC最低,胁迫15d时其值是对照平均值的1.17倍,可见持续的高温低湿胁迫造成植株严重失水。
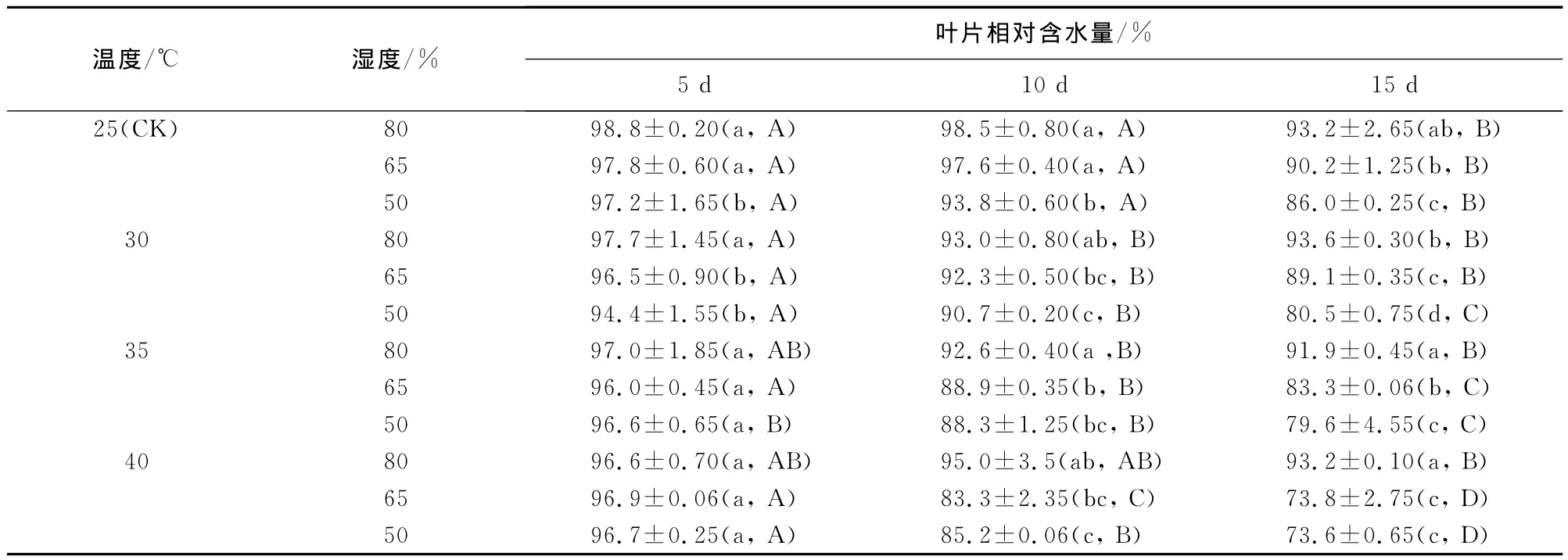
表2 温湿度交互作用下闽楠幼苗叶片相对含水量的变化(平均值±标准差)Table 2 The variation of leaf relative water content of P.bournei seedlings under temperature and humidity interaction process(mean±SE)
2.3.2 叶绿素含量 相同温度条件下,随着相对湿度的降低和胁迫时间的延长,幼苗叶绿素含量呈下降趋势(表3),不同相对湿度和不同胁迫时间幼苗叶绿素含量差异显著(p<0.05)。相同湿度条件下,随着胁迫温度的升高,幼苗叶绿素含量逐渐下降,不同温度间幼苗叶绿素含量差异显著(p<0.05)。对于不同的组合,胁迫15d时,35℃+50%、40℃+50%组合的叶绿素含量分别比同温度下湿度80%时下降了23.0%和41.9%,分别比25℃+50%下降了73.5% 、76.2%,说明高温低湿严重影响闽楠幼苗叶绿素的合成。
2.3.3 细胞质膜透性 植物组织在受到逆境危害时,细胞膜的结构和功能首先受到伤害,细胞膜透性增大。研究结果表明,相同温度条件下,随着相对湿度的降低和胁迫时间的延长,幼苗叶片细胞质膜透性呈上升趋势(表4),不同相对湿度和不同胁迫时间处理幼苗叶片细胞质膜透性差异显著(p<0.05);相同湿度条件下,随着胁迫温度的升高,叶片细胞质膜透性逐渐增加,不同温度间叶片细胞质膜透性差异显著(p<0.05)。不同组合之间,不论胁迫时间长短,均表现为对照的叶片细胞质膜透性较小,高温低湿处理的叶片细胞质膜透性较大,其中40℃+50%组合处理的细胞质膜透性最大,处理期间3个时间段测得的叶片细胞质膜透性平均值为59.0%,胁迫15d时其值为对照平均值的2.44倍。说明随着胁迫温度的升高相对湿度的降低,细胞膜受损程度加大,膜透性增加、电解质外渗,闽楠叶片受到的伤害就越严重。

表3 温湿度交互作用下闽楠幼苗叶绿素含量的变化(平均值±标准差)Table 3 The variation of chlorophyll content of P.bournei seedlings under temperature and humidity interaction(mean±SE)
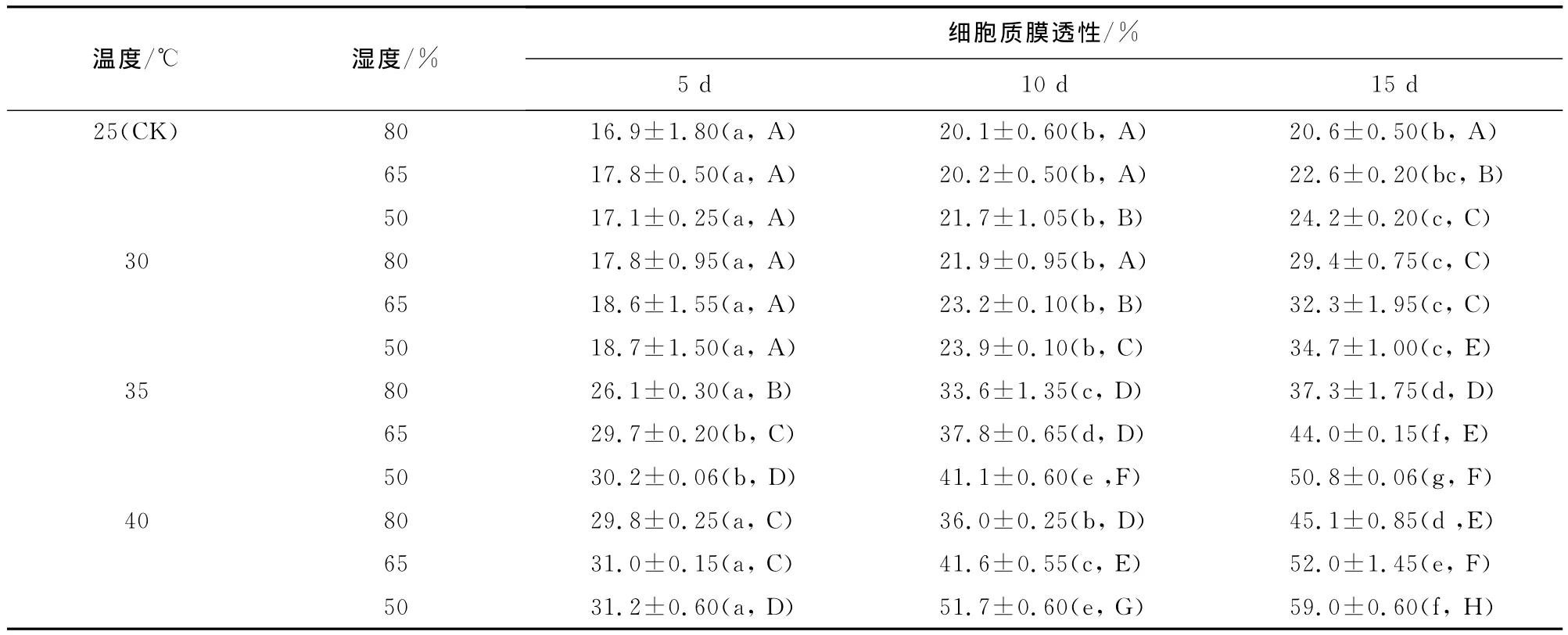
表4 温湿度交互作用对闽楠幼苗细胞质膜透性的影响(平均值±标准差)Table 4 Effect of temperature and humidity interaction on cell cytoplasmic of P.bournei seedlings(mean±SE)
2.3.4 丙二醛(MDA)含量 在相同温度条件下,不同湿度的处理MDA含量随胁迫时间延长而增加,不同时间之间MDA含量差异显著(p<0.05),但不同湿度处理间MDA含量变化没有明显规律性(表5)。相同湿度条件下,不同温度处理闽楠幼苗MDA含量也随胁迫时间延长而增加,且差异显著(p<0.05),但不同温度处理间MDA含量变化没有明显规律性。不同组合之间比较,总体而言,胁迫5d、10d时,高温低湿的组合MDA含量大于较低温与高湿度的组合,40℃+50%组合胁迫5、10d时分别比25℃+80%组合的MDA含量增加了2.76倍和1.64倍;胁迫15d时,反而表现出对照组合的MDA含量高于严重胁迫的组合,其原因可能是严重胁迫影响了膜脂过氧化底物的产生,即使遇到严重胁迫,也不可能产生更高的膜脂过氧化产物。
2.3.5 超氧化物歧化酶(SOD)活性 相同温度条件下,随着相对湿度的降低和胁迫时间的延长,幼苗SOD活性呈增加趋势(表6),不同相对湿度、不同胁迫时间幼苗的SOD活性差异显著(p<0.05);相同湿度条件下,随着胁迫温度的升高,幼苗SOD活性逐渐增加,不同温度间幼苗SOD活性差异显著(p<0.05)。胁迫10d时,4个温度与50%相对湿度的组合分别比80%时增加了79.6%、88.4%、92.6%和73.8%。温湿度组合互作效应表现为25℃+80%的SOD活性最低,40℃+50%的处理SOD活性最高,胁迫10d时其值是对照平均值的1.75倍,但胁迫15d时其SOD活性下降,说明闽楠幼苗保护酶系统的作用是有限的,当胁迫严重超过了自我调节的范围时,SOD活性下降。
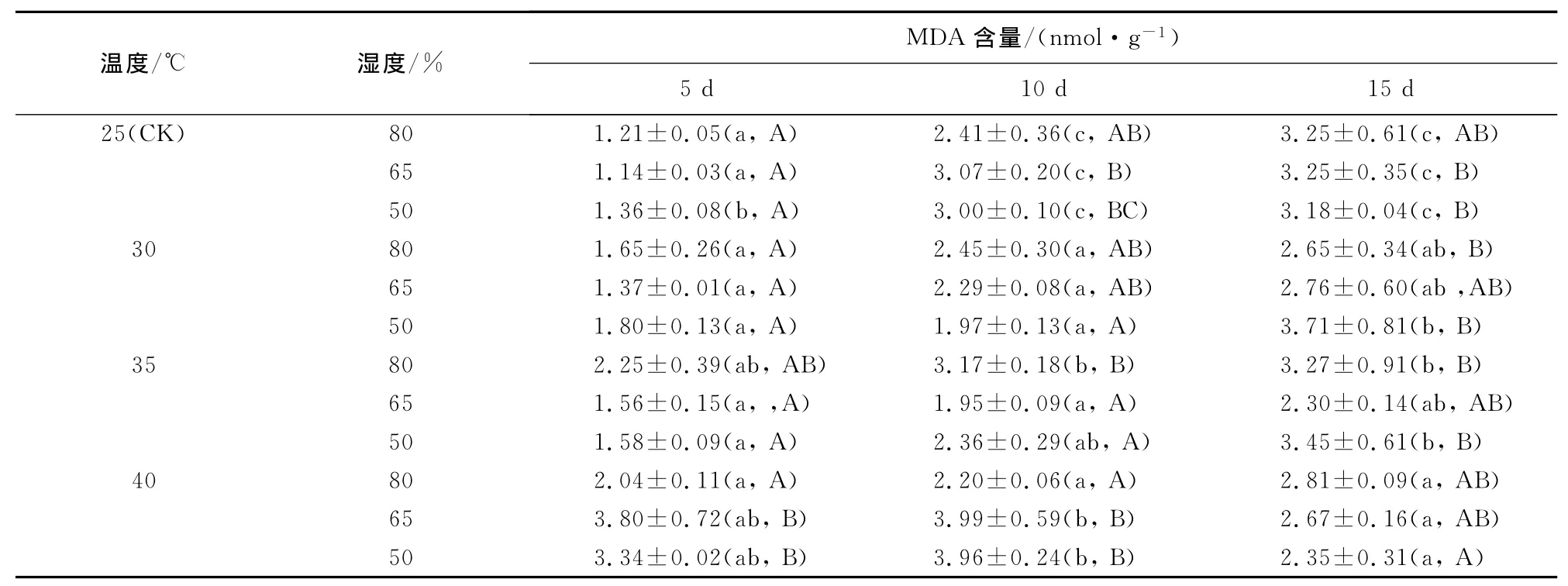
表5 温湿度交互作用对闽楠幼苗MDA含量的影响(平均值±标准差)Table 5 Effect of temperature and humidity interaction on MDA content of P.bournei seedlings(mean±SE)
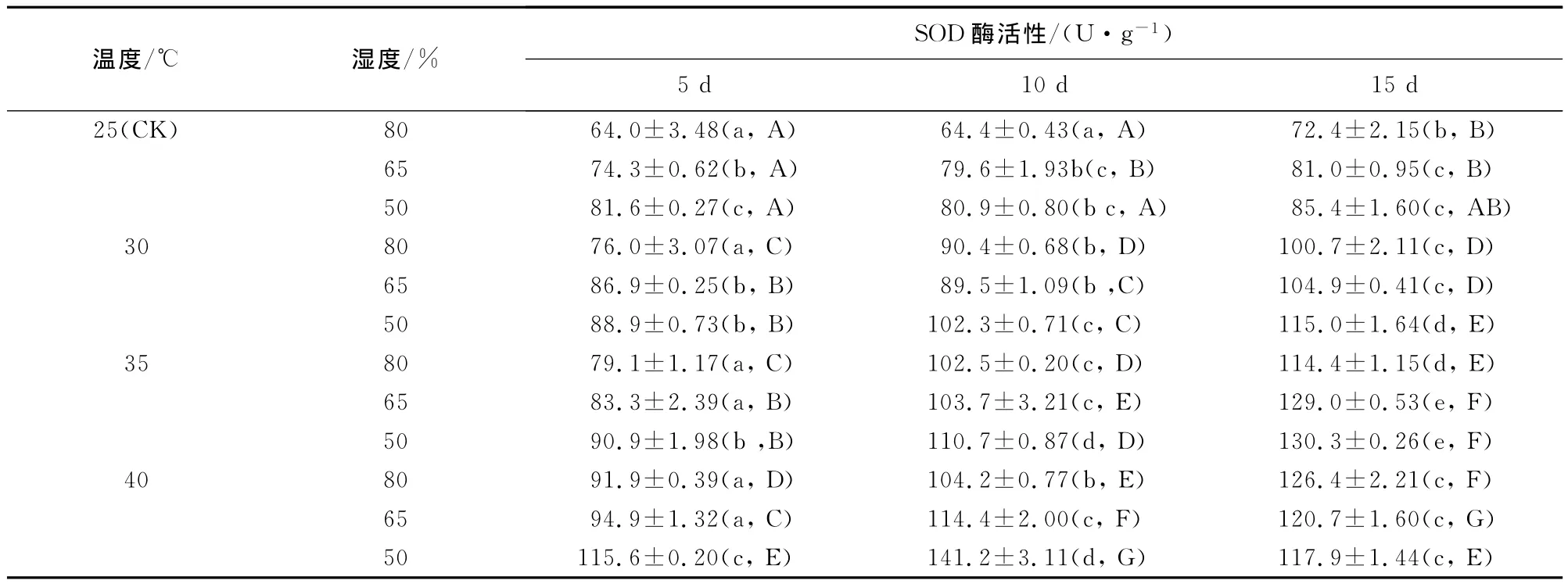
表6 温湿度交互作用对闽楠幼苗SOD酶活性的影响(平均值±标准差)Table 6 Effect of temperature and humidity interaction on SOD enzymatic activity of P.bournei seedlings(mean±SE)
2.3.6 脯氨酸(pro)含量 相同温度条件下,随着相对湿度的降低和胁迫时间的延长,幼苗叶片Pro含量呈逐渐增加的趋势(表7),不同相对湿度,不同胁迫时间幼苗叶片Pro含量差异显著(p<0.05);相同湿度条件下,随着胁迫温度的升高,幼苗叶片Pro含量增加,不同温度间幼苗叶片Pro含量差异显著(p<0.05)。胁迫15d时,40℃+65%和40℃+50%分别比80%时增加了1.12和1.29倍。温湿度互作效应总体表现为25℃+80%的叶片平均Pro含量最低,40℃+50%处理的平均Pro含量最高,胁迫10d时其值是25℃+80%的2.19倍,说明胁迫时间较短时,高温低湿严重胁迫下,闽楠幼苗通过增加Pro含量,增强渗透调节能力以适应逆境。但胁迫15d时,40℃+50%组合Pro含量则降低,说明闽楠幼苗的渗透调节能力有限,当胁迫超过其可调范围时其渗透调节物质合成下降。
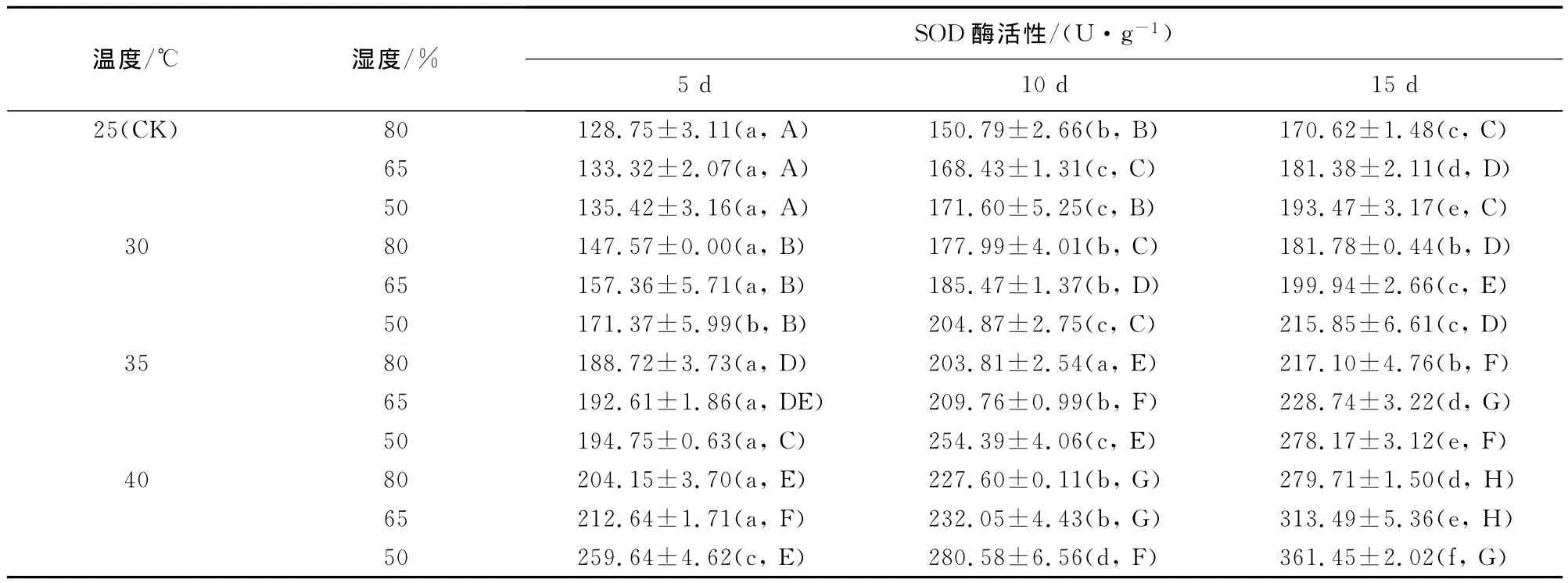
表7 温湿度交互作用对闽楠幼苗脯氨酸含量的影响(平均值±标准差)Table 7 Effect of temperature and humidity interaction on proline content of P.bournei seedlings(mean±SE)
2.3.7 根系活力 相同温度条件下,随着相对湿度的降低和胁迫时间的延长,幼苗根系活力逐渐下降(表8),不同相对湿度、不同胁迫时间,幼苗的根系活力差异显著(p<0.05);相同湿度条件下,随着胁迫温度的升高,幼苗根系活力呈下降趋势,不同温度间幼苗根系活力差异显著(p<0.05)。不同组合之间,40℃+50%处理的幼苗在任何胁迫时间其根系活力均最低,处理期间3个时间段测得的根系活力平均值为11.52mg·g-1,比对照组下降了35.6%,这说明高温低湿导致幼苗根系活力降低,幼苗对水分养分的吸收能力减弱,从而导致幼苗受到严重伤害。
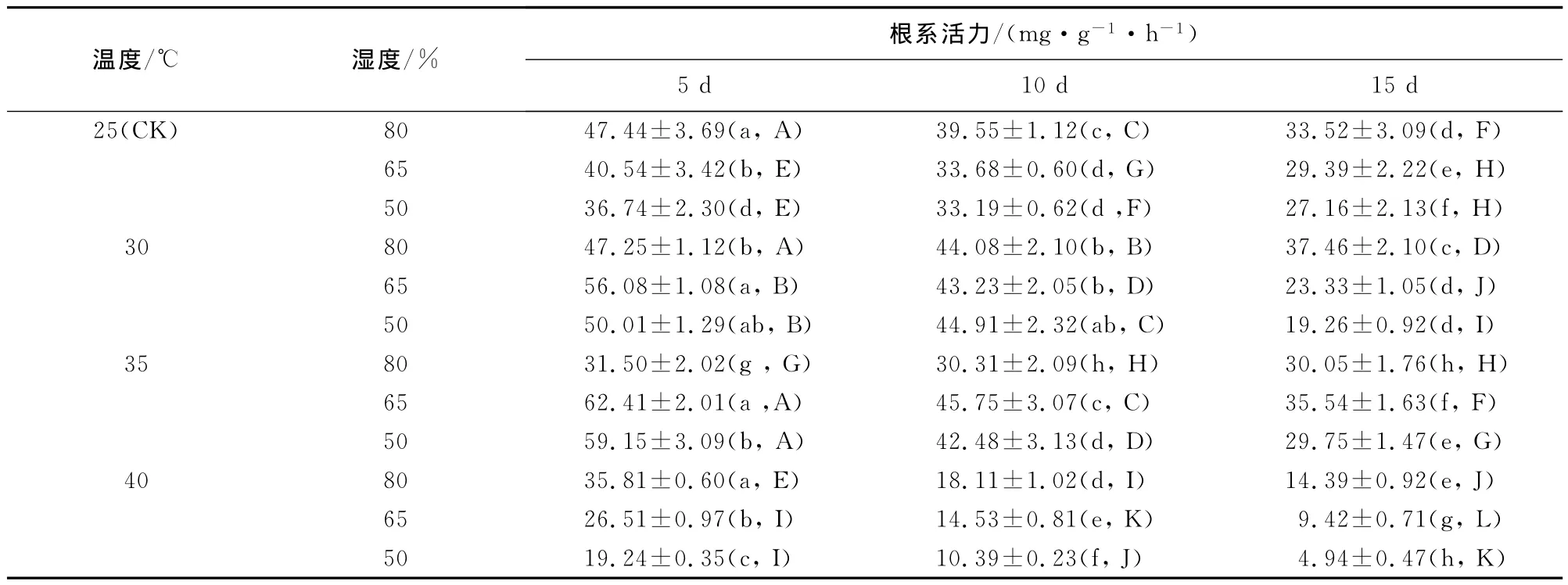
表8 温湿度交互作用对闽楠幼苗根系活力的影响(平均值±标准差)Table 8 Effect of temperature and humidity interaction on root activity of P.bournei seedlings(mean±SE)
3 结论与讨论
苗木在高温胁迫下,体内细胞在结构、生理及生物化学上发生一系列的适应性改变后,最终在植物的生长状况和形态特征上有所表现。前人已研究高温胁迫对海州常山[23]、银杏[24]、西洋杜鹃[25]幼苗形态的影响,观察到随着胁迫温度的升高,幼苗叶片形态发生不同程度的变化。本试验结果表明,随着胁迫温度的升高、相对湿度的降低和胁迫时间的延长,闽楠幼苗叶形发生明显的变化,即胁迫初期,叶片的叶尖出现枯黄现象,随后叶片明显褪绿且泛黄,最后植株受害现象十分明显,叶片完全黄化,枯焦也严重,部分植株的叶片枯死、脱落。植株嫩叶自动脱落其目的是减少蒸腾,进而维持自身正常的生理代谢[26]。
叶片相对含水量反映了植物组织在高温胁迫时的蒸腾耗水补充能力的差异。吴涛[27]等的研究表明,膏桐幼苗叶片含水量下降的原因是胁迫温度的升高和胁迫时间的延长,其极端高温对叶片含水量影响最显著。在本试验中,当胁迫温度达到40℃,随相对湿度的降低和胁迫时间的延长,幼苗叶片相对含水量下降最明显,高温、大气干旱和土壤干旱交互作用加剧了植株的失水。
高温逆境、大气干旱和土壤干旱引起叶绿素含量下降已被众多研究证实,高温胁迫降低了叶绿素的合成速率,引起叶绿体结构与功能的破坏,引发叶绿素的分解破坏[28-29];大气干旱和土壤干旱对叶绿素的影响与高温胁迫基本一致,干旱使植物组织严重脱水,不仅影响叶绿素形成,还使先形成的有叶绿素遭到严重破坏[30-31]。本研究中闽楠幼苗在胁迫初期,高温高湿处理叶绿素下降不明显,但高温低湿处理下降较明显,此时主要为高温和大气干旱胁迫;但随着胁迫时间延长,幼苗叶绿素含量急剧下降,此时闽楠幼苗承受着高温、大气干旱和土壤干旱三重胁迫,叶绿素合成严重受阻,原有叶绿素加速叶绿素的分解。
植物在大气干旱、高温等逆境条件下一个共同的反应是膜脂过氧化作用,在植物细胞结构上造成膜损伤,细胞膜透性增加,在物质合成方面,膜脂过氧化产物MDA不断积累[30]。本试验中,细胞质膜透性随着胁迫温度的升高、湿度的降低而持续增加,随着时间的延长,叶片细胞质膜透性显著高于对照组,可见,高温、低湿、低土壤含水量交互作用效应显著高于单一胁迫因子的作用。大多数研究表明,单一胁迫因素作用下,膜脂过氧化产物MDA含量随着胁迫程度的加深、胁迫时间的延长而增加[17]。在本研究中,闽楠幼苗MDA含量变化总体上是胁迫时间的延长而增加,但因为存在温度、湿度和土壤含水量的交互影响,其变化没有明显的规律性。胁迫15d时,反而表现出对照组合的MDA含量高于严重胁迫的组合,这与前人的研究有所不同[23-24,28-29]。其原因可能是严重胁迫影响了膜脂过氧化底物的产生,即使遇到严重胁迫,也不可能产生更高的膜脂过氧化产物。在逆境胁迫下,抗氧化酶系统发生响应,从而减轻活性氧对植物的伤害。SOD是植物体内活性氧自由基清除系统的第一道防线,可对抗或阻断因氧自由基对细胞造成的损害,并及时修复受损细胞,在活性氧清除系统中起关键作用[32]。本研究结果表明,在轻度或短期胁迫下,闽楠叶片SOD活性逐渐上升,以清除活性氧自由基,降低伤害,是闽楠对逆境的一种适应性反应,但在严重或长期胁迫条件下SOD活性下降,说明闽楠幼苗保护酶系统的作用是有限的,高温、低湿、低土壤含水量交互作用加剧了胁迫程度,超过了闽楠幼苗的保护酶系统调节范围。
干旱、高温等逆境胁迫都会影响植物吸水而造成细胞水分亏缺,植物为适应水分亏缺条件,在细胞内主动形成系列渗透调节物质以增强其渗透调节能力,降低因水分亏缺对细胞的伤害。脯氨酸是植物体内一种理想且重要的渗透调节物质,在逆境胁迫下,植物迅速积累脯氨酸并进行渗透调节,以维持细胞一定的含水量和膨压势平衡,从而增强植物的抗逆性[33]。本研究中,闽楠幼苗在高温低湿且短时间的胁迫下,体内脯氨酸合成增加以增强渗透调节能力,但当高温、低湿、低土壤含水量且胁迫时间延长时,则表现出降低的趋势,表明高温、低湿、低土壤含水量多因子严重胁迫超过了闽楠的渗透调节能力,反映出闽楠幼苗渗透调节能力的的局限性,这与前人的研究结论类似[34]。
根系活力是反映植物根系吸收合成能力的重要指标。各种逆境都会不同程度地影响根系的活力,从而影响植物对水分、养分的吸收。陈志刚[35]等对西南桦耐热性的研究中,随着胁迫温度的升高,西南桦根系活性显著下降。本研究的结论与此相似,随着高温、低湿、低土壤含水量三重胁迫的加剧而急剧下降,致使植株吸收水分、养分能力受阻,在形态上表现出植株出现枯焦、失绿的现象。
在自然环境中,高温能够单独影响植物生长、光合、氧化防御系统和细胞超微结构,但随着高温时间的延长,则派生出低湿、低土壤含水量逆境,随着全球气候的变暖,高温、低湿和低土壤含水量交互胁迫时常发生。本研究结果表明,从单因素胁迫到多因素胁迫,闽楠幼苗在形态、和生理生化上的反应和适应是一致的,不同的是影响程度的加剧。多重胁迫往往会超过植株的自我调节能力而对植株造成致命性伤害,因此,在生产中应尤为重视。本研究结果表明,闽楠幼苗在25℃条件下,无论相对湿度如何,其受到的影响都较小;在30℃高温条件下,相对湿度80%时闽楠幼苗在胁迫5d时各指标与对照差异不大,胁迫10d后时,各指标均比对照有明显变化。因此,对于闽楠幼苗来说,当大气温度超过30℃时,胁迫时间超过10d,即使大气相对湿度还较高,都应加强水分管理,可通过遮阴和浇水降低大气温度、提高大气相对湿度和土壤含水量。40℃+50%组合则是闽楠幼苗不能承受的极限条件。
[1] 郑万钧,杨衔缙,李锡文,等.中国树木志[M].北京:中国林业出版社,1982:795-797.
[2] 王东光,尹光天,邹文涛,等.不同基质和季节对闽楠嫩枝扦插生根的影响[J].热带作物学报,2013,34(8):1458-1462.
[3] 申展,李铁华,文仕知,等.不同因素对闽楠嫩枝扦插生根的影响[J].中南林业科技大学学报,2013,33(1):63-67.SHEN Z,LI T H,WEN S Z,et al.Effect of different factors on cutting rooting of Phoebe bournei twigs[J].Journal of Central South University of Forestry &Technology,2013,33(1):63-67.(in Chinese)
[4] 王艺,王秀花,张珍丽,等.不同栽培基质对浙江楠和闽楠容器苗生长和根系发育的影响[J].植物资源与环境学报,2013,22(3):81-87.
[5] 王东光,尹光天,邹文涛,等.氮素营养对闽楠幼苗生长及光合特性的影响[J].林业科学研究,2013,26(1):70-75.WANG D G,YIN G T,ZOU W T,et al.Effects of nitrogen loading on growth and photosynthetic characteristics of Phoebe bournei seedlings[J].Forest Research,2013,26(1):70-75.(in Chinese)
[6] 王东光,尹光天,杨锦昌,等.磷肥对闽楠苗木生长及叶片氮磷钾浓度的影响[J].南京林业大学学报:自然科学版,2014,38(3):40-44.
[7] 王振兴,朱锦懋,王健,等.闽楠幼树光合特性及生物量分配对光环境的响应[J].生态学报,2012,32(12):3841-3848.WANG Z X,ZHU J M,WANG J.The response of photosynthetic characters and biomass allocation of Phoebe bournei young trees to different light regimes[J].Acta Ecologica Sinica,2012,32(12):3841-3848.(in Chinese)
[8] 刘军,姜景民,陈益泰,等.闽楠种子轻基质容器育苗及优良家系选择[J].西北林学院学报,2011,26(6):70-73.
[9] 王樱琳,韦小丽,段如雁,等.闽楠幼苗对大量元素缺乏的响应[J].西北林学院学报,2014,29(2):61-65.WANG Y L,WEI X L,DUAN R Y,et al.Effect of nutritional deficiency on the growth of Phoebe bournei seedling[J].Journal of Northwest Forestry University,2014,29(2):61-65.(in Chinese)
[10] 邵明晓,文仕知,何功秀,等.不同林龄闽楠人工林生物量结构特征[J].中南林业科技大学学报,2014,34(6):44-48.
[11] 楚秀丽,刘青华,范辉华.不同生境、造林模式闽楠人工林生长及林分分化[J].林业科学研究,2014,27(4):445-453.CHU X L,LIU Q H,FAN H H,et al.Growth and structure differentiation of Phoebe bournei plantation with different sites and modes of afforestation[J].Forest Research,2014,27(4):445-453.(in Chinese)
[12] WU J Y,HUANG M J,CHEN M G,et al.Effects of shading degree on storage rate and growth of phoebe bournei seedlings in fields[J].Agricultural Science &Technology,2014,15(9):1567-1570.
[13] 罗宁.闽楠优良地理种源选择及其子代林遗传增益分析[J].西部林业科学,2014,43(5):19-23.
[14] 多化琼,王喜明,王悦东.利用傅里叶变换研究闽楠木材纤维细胞尺寸[J].西北林学院学报,2009,24(3):159-162.
[15] 欧祖兰,曹福亮.植物耐热性研究进展[J].林业科技开发,2008,22(1):1-4.
[16] 陈培琴,郁松林,詹妍妮,等.植物在高温胁迫下的生理研究进展[J].中国农学通报,2006,22(5):223-226.
[17] 张亚军,王丽学,陈超,等.植物对逆境的响应机制研究进展[J].江西农业学报,2011,23(9):60-65.
[18] 侯福林.植物生理学实验教程[M].北京:科学出版社,2004:35-36.
[19] 张宪政.植物叶绿素含量的测定—丙酮乙醇混合液法[J].辽宁农业科学,1986(3):26-28.
[20] 张立军,樊金娟.植物生理学实验.中国农业出版社,2007.
[21] 郝再彬.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:110-113.
[22] 张志良,翟伟菁.植物生理学实验[M].北京:高等教育出版社,1990.
[23] 曾德静,王铖,刘军,等.高温胁迫对海州常山形态和生理特性的影响[J].东北林业大学学报,2013,41(3):91-93.ZENG D J,WANG C,LIU J,et al.Effect of high temperature stress on morphological and physiological characteristics of Clerodendrum trichotomum[J].Journal of Northeast Forestry University,2013,41(3):91-93.(in Chinese)
[24] 欧祖兰,曹福亮,郑军.高温胁迫下银杏形态及生理生化指标的变化[J].南京林业大学学报:自然科学报,2008,32(3):32-34.OU Z L,CAO F L,ZHENG J.The change of physio-biochemistry and morphological characteristics of Ginkgo biloba L.subjected to high temperature stress[J].Journal of Nanjing Forestry University:Natural Sciences Edition,2008,32(3):32-34.(in Chinese)
[25] 郑宇,何天友,陈凌艳,等.高温胁迫下西洋杜鹃的生理响应及耐热性[J].福建林学院学报,2012,32(4):328-333.
[26] 薛立,曹鹤.逆境下植物叶性状变化的研究进展[J].生态环境学报,2010,19(8):2004-2009.
[27] 吴涛,郎南军,彭明俊,等.高温胁迫对膏桐幼苗部分生理指标的影响[J].东北林业大学学报,2008,36(11):30-31.
[28] 刘奕清,陈泽雄,杨婉晴.高温和干旱胁迫对巨尾桉幼苗生理特性的影响[J].园艺学报,2008,35(5):763-764.
[29] 彭松,郑勇奇,马淼,等.高温胁迫下花楸树幼苗的生理响应[J].林业科学研究,2011,24(5):602-608.PENG S,ZHENG Q Y,MA M,et al.Physiological adaptation of sorbus pohuashanensis seedlings to heat stress[J].Forest Research,2011,24(5):602-608.(in Chinese)
[30] P.J.克雷默尔,T.T.考兹洛夫斯基.木本植物生理学[M].汪振儒,译.北京:科学出版社,1985.
[31] 吴芹,张光灿,裴斌,等.3个树种对不同程度土壤干旱的生理生化响应[J].生态学报,2013,33(12):3648-3656.
[32] 曹福亮,郁万文,汪贵斌,等.模拟夏季高温条件下银杏幼苗抗氧化酶系统的动态变化[J].华南农业大学学报,2008,29(2):84-85.
[33] 肖万欣,王延波,谢甫绨,等.高温和干旱胁迫下,植物叶片光合系统变化、气孔运动及其调控研究进展[J].辽宁农业科学,2012(6):29-33.
[34] 黄红英,窦新永,邓斌,等.不同次生种源马枫树对高温胁迫的响应[J].林业科学,2009,45(7):153-154.
[35] 陈志刚,谢宗强,郑海水.不同地理种源西南桦苗木的耐热性研究[J].生态学报,2003,23(11):2327-2331.

