3 种抗氧化 剂对硅酸钠胁迫下粉红单端孢(Trichothecium roseum)孢子生存能力的保护作用比较研究
赵冠华,牛黎莉*,罗荣涛,段伟鹏,张 蓉,毕 阳,张盛贵
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
3 种抗氧化 剂对硅酸钠胁迫下粉红单端孢(Trichothecium roseum)孢子生存能力的保护作用比较研究
赵冠华,牛黎莉*,罗荣涛,段伟鹏,张 蓉,毕 阳,张盛贵
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
本实验研究了抗坏血酸(VC)、还原性谷胱甘肽(reduced glutathione,GSH)和半胱氨酸(cysteine,Cys)3 种抗氧化剂分别作为预防剂和治疗剂对硅酸钠和对应pH值溶液胁迫下粉红单端孢(Trichothecium roseum)孢子存活力的保护作用。结果表明,3 种抗氧化剂均能使硅酸钠胁迫下孢子的生存能力部分恢复,而使对应pH值胁迫下孢子的生存能力80%恢复;3 种抗氧化剂中VC的保护效果要优于GSH和Cys;3 种抗氧化剂作为预防剂的效果要优于其治疗效果。
抗氧化剂;硅酸钠;生存能力
粉红单端孢(Trichothecium roseum)是重要的果蔬采后病原物,可引起苹果的霉心病[1]、甜瓜的粉霉病[2-3]、芒果的果腐病[4]以及其他多种果蔬的采后病害[5]。此外,该病原物还能产生对人和动物有害的单端孢霉烯毒素[6-7]。目 前,对由T. roseum引起病害的控制主要采用异菌脲、嘧菌酯等化学合成的杀真菌剂[4],但长期使用不仅存在药物残留危害、污染环境、而且会增加病原物的抗药性[8]。因此,亟需寻找新的、更为安全有效的控制方法。
据报道,硅酸钠对多种采后病原物具有广谱的抑菌活性,可抑制菌丝生长和孢子萌发[9-13],本课题组前期研究发现,硅酸钠引起的细胞质膜损伤可能与其诱导菌体产生的过量活性氧(reactive oxygen spieces,ROS)有关。同样,Qin Guozheng等[14]发现,用硼酸盐处理扩展青霉(Penicillium expansum)后,菌体内有大量ROS积累,并促进了蛋白质的羰基化。用硼酸盐处理的灰葡萄孢(Botrytis cinerea),发现菌丝细胞膜损伤,并伴有大量的内容物渗漏。氯化铝和焦亚硫酸钠等盐类能引起对盐敏感真菌的细胞膜丙二醛(methane dicarboxylic aldehyde,MDA)含量和膜脂饱和程度的提高,使得膜脂过氧化[15]。外源抗氧化物VC和超氧化物歧化酶(superoxide dismutase,SOD)能使ROS胁迫条件下的菌体P. expansum中ROS保持正常的生理稳态,并能修复由ROS引起的细胞损伤。但是,对硅酸钠胁迫下外源抗氧化剂对孢子生存力保护效果的研究尚鲜见报道。
本实验采用100 mmol/L硅酸钠溶液和对应pH值溶液处理T. roseum孢子,研究3种抗氧化剂对胁迫条件下孢子存活率的保护效果与处理时间的关系;以及不同添加方式对孢子的保护效果进行比较;探讨3种抗氧化剂对硅酸钠胁迫下T. roseum孢子生存力的影响规律。
1 材料与方法
1.1 材料与试剂
T. roseum为甘肃农业大学食品科学与工程学院采后生物实验室保存。
NaOH 天津市大茂化学试剂厂;硅酸钠、吐温-80、抗坏血酸(VC)、还原型谷胱甘肽(reduced glutathione,GSH)、半胱氨酸(cysteine,Cys)、葡萄糖 天津市光复精细化工研究所;2’,7’-二氯荧光黄双乙酸盐(dichlorofluorescein diacetate,DCFH-DA)、荧光染料 美国Sigma公司;二甲基亚砜(dimethylsulfoxide,DMSO) 美国Amresco公司。
1.2 仪器与设备
Olympus BX61荧光显微镜 奥林巴斯(中国)有限公司;高压蒸汽灭菌锅 上海三申医疗器械有限公司;电热鼓风干燥箱、电热恒温培养箱 上海一恒科学仪器有限公司;PHS-3C型pH计 上海仪电科学仪器股份有限公司;超净工作台 苏净集团苏州安泰空气技术有限公司;振荡培养箱 上海跃进医疗器械有限公司;XH-B旋涡混合器 江苏康健医疗用品有限公司;电子天平 上海精科天美科学仪器有限公司。
1.3 方法
1.3.1 孢子的收集
取28℃条件下培养10 d的T. roseum平板,加入含体积分数为0.05%的吐温-80的无菌水,用玻璃棒刮下平板上的病原菌孢子,然后转入50 mL三角瓶中,在WYX-A微型旋涡混合器上振荡15 s,再用4层无菌纱布过 滤,滤液用血球计数板计数算出孢子悬浮液的浓度后,最后稀释孢子悬浮液的浓度为1×106孢子/mL。
1.3.2 孢子生存能力的测定
参照Angelova等[16]的方法并修改,药剂处理时,孢子悬浮液的浓度控制在约106孢子/mL左右,药剂处理后,稀释成104孢子/mL,吸取100 μL的孢子悬浮液,进行凃板,平板为马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基。每个处理5 个平板,在恒温28 ℃条件下培养48 h后,记录每个平板菌落形成数(CFU),求平均值。


1.3.3 硅酸钠和对应pH值溶液处理后孢子中内源ROS的观察
配制100 mmol/L的硅酸钠溶液,用pH计测定硅酸钠溶液在28 ℃条件下pH值为12.60,然后用10 mol/L的NaOH溶液调蒸馏水的pH值为12.60,得对应pH值溶液,121 ℃条件灭菌20 min后,待用。取上述孢子悬浮液2 mL,8 000×g离心10 min,弃上清,分别用无菌水、灭菌后的硅酸钠溶液以及对应的pH值溶液各2 mL加入孢子中,28 ℃、150 r/min摇床中处理3 h,8 000×g离心5 min,50 mmol/L磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤3 次,用500 μL的PBS重悬细胞。T. roseum孢子内源ROS的测定参照Qin Guozheng等[17]的方法并修改,每个离心管中添加荧光染料DCFH-DA(溶解在DMSO中,母液浓度为0.01 mol/L),使其终浓度为10 μmol/L,在28 ℃条件下孵育1 h后,真菌孢子在8 000×g离心5 min,并用PBS洗涤3 次。然后用荧光显微镜在激发光为蓝色光下观察发荧光的孢子数。每个处理重复3 次。
1.3.4 硅酸钠和对应pH值溶液对孢子存活率的影响
参照Avis等[18]的方法并修改,取上述孢子悬浮液2 mL,8 000×g离心10 min,弃上清,分别用无菌水、灭菌后的100 mmol/L的硅酸钠溶液以及对应的pH值为12.60的溶液各2 mL加入孢子中,28 ℃、150 r/min摇床中处理不同的时间(0、30 min、1 h、3 h、6 h、9 h),随后进行孢子存活率的测定。每个处理重复3 次。
1.3.5 外源抗氧化剂作为预防剂对孢子存活率的保护
在上述无菌水、灭菌后的硅酸钠、灭菌后的对应pH值处理液中分别加 入3 种外源抗氧化剂VC、GSH和Cys,使抗氧化剂的终浓度达到100 μmol/L,待用。取上述孢子悬浮液2 mL,8 000×g离心10 min,弃上清,分别加入2 mL加了抗氧化剂的各溶液,28 ℃,150 r/min摇床中处理不同的时间(0、30 min、1 h、3 h、6 h、9 h),参照1.3.2节的方法进行孢子保护率的测定。每个处理重复3 次。
1.3.6 外源抗氧化剂作为治疗剂对孢子存活率的保护
同上述1.3.4节的方法处理孢子后,稀释成104孢子/mL后,吸取100 μL涂布于分别含有100 μmol/L抗氧化剂(VC、GSH、Cys)的PDA培养基中,参照1.3.2节的方法进行孢子保护率的测定。每个处理重复3 次。
1.4 数据处理
全部数据用Microsoft Excel 2007处理系统进行统计处理。
2 结果与分析
2.1 硅酸钠和对应pH值溶液处理对孢子中ROS含量的影响

图1 硅酸钠和对应pH值溶液对T. rosseeuumm分生孢子ROS的影响Fig.1 Effects of sodium silicate and corresponding pH on the production of reactive oxygen species in T. roseum spores
由图1可知,与对照组相比,100 mmol/L硅酸钠和对应pH值溶液处理3 h后,孢子中内源ROS含量均有所增加,且硅酸钠处理后,发荧光的孢子的比率显著高于对照和对应pH值溶液处理。因此,认为硅酸钠引起T. roseum氧化胁迫要比对应pH值溶液处理引起的氧化胁迫更严重。
2.2 硅酸钠和对应pH值溶液对孢子存活率的影响
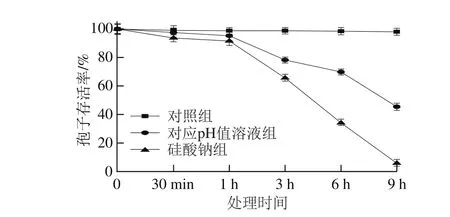
图2 硅酸钠和对应pH值溶液对T. roseum分生孢子处理不同的时间后对其存活率的影响Fig.2 Effects of sodium silicate and corresponding pH on spore viability of T. roseum
由图2可知,100 mmol/L硅酸钠和对应pH值溶液处理对孢子存活均有抑制作用,但是硅酸钠和对应pH值溶液处理之间存在差异。当处理时间在1 h以内时,各处理对孢子的存活率影响变化不大;随着处理时间的延长,孢子存活率显著降低,且硅酸钠处理显著低于对照和对应pH值溶液处理。在整个处理期间,对照组的孢子存活率保持稳定。当处理时间为9 h时,硅酸钠处理的孢子的存活率仅为对照的5.9%,是对应pH值溶液处理的12.8%。
2.3 3 种抗氧化剂作为预防剂对孢子保护率的影响

图3 3 种外源抗氧 化剂对硅酸钠和对应pH处理的T. roseum孢子保护率的影响Fig.3 Effects of three exogenous antioxidants as protective agents on spore viability of T. roseum treated with sodium silicate and corresponding pH
由图3可知,VC、GSH、Cys作为预防剂均能增加硅酸钠和对应pH值溶液处理的孢子的存活率,但存在差异。当处理时间小于1 h时,3 种抗氧化剂对孢子的保护率的影响变化较小,这可能是由于药剂短时间处理,对孢子的存活率影响变化也是较小的;当处理时间超过1 h时,随着处理时间的延长,其保护效果非常显著。其中VC的保护效果最好,其次为GSH,最后为Cys。当处理9 h时,抗氧化剂VC能使36%的孢子免受硅酸钠的破坏,能使48%的孢子免受pH值溶液处理的破坏(图3A);GSH对其保护率分别为32%和40%(图3B);Cys分别为29%和38%(图3C)。
2.4 3 种抗氧化剂作为治疗剂对孢子治疗率的影响
由图4可知,3 种抗氧化剂VC、GSH和Cys对孢子的治疗率均有显著改善,但存在差异。当处理时间低于1 h时,3 种抗氧化剂对孢子的治疗率的影响变化较小;当处理时间超过1 h时,随着处理时间的延长,其治疗效果非常显著。VC的治疗效果最好,GSH和Cys的治疗效果相差不大。处理9 h时,抗氧化剂VC能挽救11%的孢子免受硅酸钠的破坏,挽救28%的孢子免受对应pH值溶液的破坏(图4A)。抗氧化剂GSH的治疗率分别为9.9%和25.6%(图4B),Cys分别为9.3%和20.6%(图4C)。
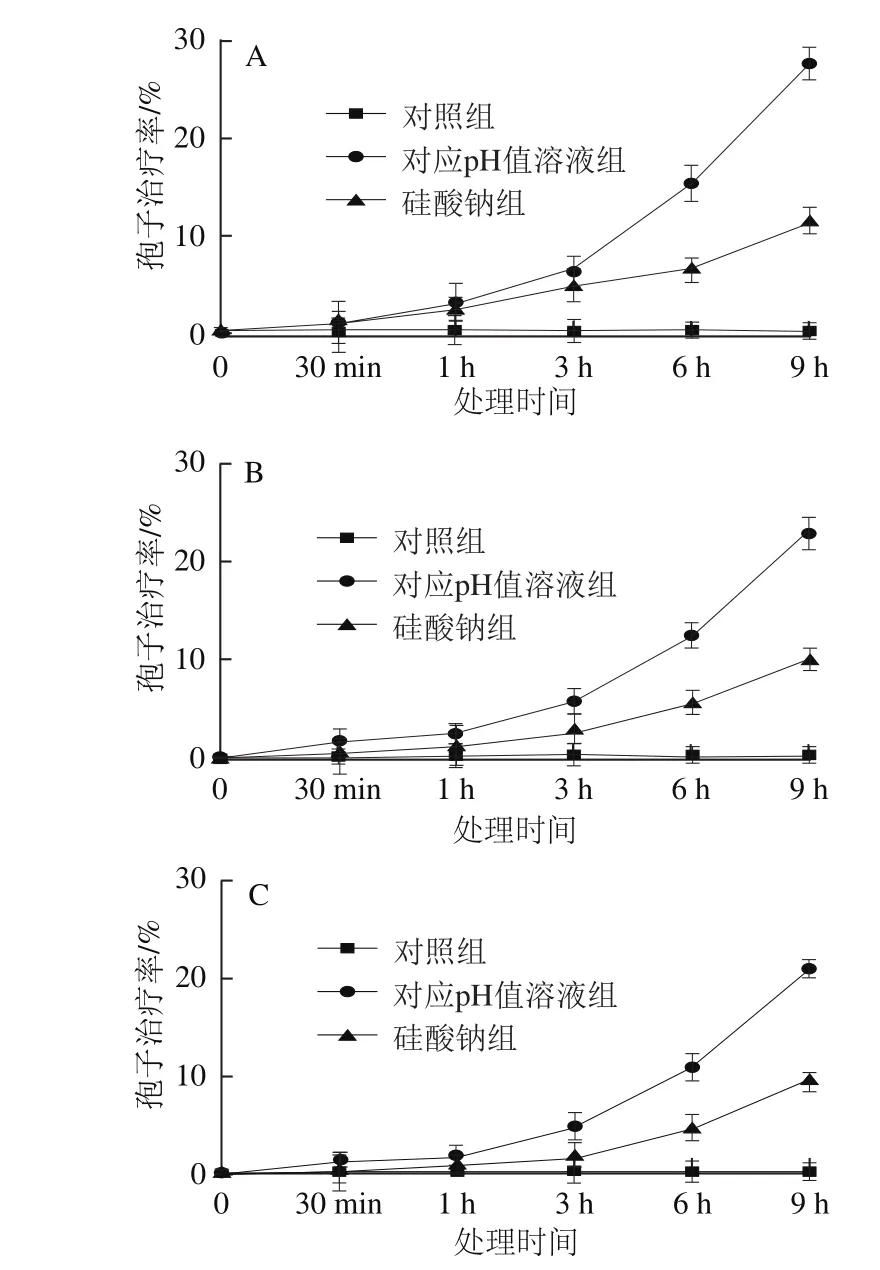
图4 3 种外源抗氧化剂对硅酸钠和对应pH处理的T. roseum孢子治疗率的 影响Fig.4 Effect of three exogenous antioxidants as therapeutic agents on spore viability of T. roseum treated with sodium silicate and corresponding pH
2.5 两种不同添加抗氧化剂方式对提高孢子存活率的比较

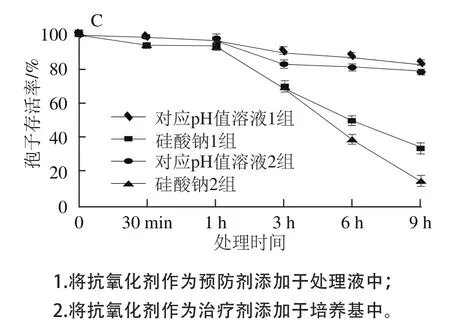
图5 抗氧化剂不同添加方式对硅酸钠和对应pH值溶液胁迫下的T. roseum seum分生孢子存活率的影响Fig.5 Comparative effects of three antioxidants as protective or therapeutic agents on spore viability of T. roseum treated with sodium silicate and corresponding pH
由图5可知,两种不同添加抗氧化剂方式对硅酸钠和对应pH值溶液胁迫下的孢子的存活率均有显著影响,但之间存在差异。与硅酸钠胁迫下的孢子相比,抗氧化剂能使pH值溶液胁迫下的孢子保持较高的存活率;而且将抗氧化剂作为预防剂的效果优于治疗剂。处理9 h后,VC(图5A)、GSH(图5B)和Cys(图5C)作为预防剂时,硅酸钠胁迫下的孢子的存活率分别为41.8%、37.8%和34.8%,而对应pH值溶液胁迫下的孢子的存活率分别达到93.4%、85.4%和83.4%;作为治疗剂时,硅酸钠胁迫下的孢子的存活率分别为16.8%、15.7%和15.1%,而对应pH值溶液胁迫下的孢子的存活率分别达到83.1%、82.1%和80%。但是,硅酸钠处理的孢子,不管是何种添加方式,对其存活率只有部分的改善,最高也只能达到41.8%;而对应pH值溶液处理,外源抗氧化剂能使T. roseum孢子存活率最低保持在80%的水平。
3 讨 论
本研究发现,经100 mmol/L硅酸钠和对应pH值溶液处理的孢子中ROS含量明显升高,且硅酸钠引起的孢子的氧化胁迫要比对应pH值溶液严重。同时硅酸钠和对应pH值溶液均使孢子的存活率显著下降,但硅酸钠的影响明显高于对应pH值溶液。外源抗氧化剂对硅酸钠胁迫下的孢子的生存能力的保护效果要弱于对应pH值溶液。抗氧化剂的添加方式,预防效果优于治疗效果。且3 种抗氧化剂,VC的效果要优于GSH,GSH要优于Cys。
在正常的生理条件下细胞内的ROS处于不断产生和清除的动态平衡中,ROS不仅作为重要的信号分子参与细胞发育、分化和衰老等过程[19-21]。而且参与环境胁迫因子诱导的生理响应过程,引起杀菌剂对菌体的毒害[22],诱导细胞发生凋亡[23]。活性氧的作用具有两面性,当其处于低浓度条件下往往作为信号分子参与细胞的生理调控,但浓度过高或长时间在胞内滞留,氧代谢失调,氧自由基动态平衡被破坏,核酸、蛋白、脂质和糖类等受到氧化并丧失正常的功能,细胞结构和功能可能会受到损伤甚至并出现死亡[24]。对微生物而言,都进化成氧化胁迫响应(oxidative stress response,OSR)机制来清除胞内逐渐升高的ROS。而其中GSH、植物螯合肽、VC、多胺、黄酮类、生物碱和类胡萝卜素等物质是主要的氧化胁迫防御系统[20]。
实验结果表明,VC、GSH和Cys均能减轻硅酸钠和对应pH值溶液对分生孢子的损伤;而且无论是作为保护剂还是治疗剂,VC的效果要优于GSH和Cys,这可能和抗氧化剂的作用机理有关。VC作为抗氧化剂能通过一系列氧化还原反应来直接清除H2O2[25]。而GSH和Cys是一种普遍存在的含硫醇还原剂,它可以通过还原细胞内二硫键来保持细胞内的氧化还原平衡,保护例如外源性化学物质 和重金属等对细胞大分子的损伤[24]。
同时发现外源抗氧化剂对硅酸钠胁迫和对应pH值溶液胁迫下的分生孢子的损伤均具有减轻作用,但是减轻程度,对应pH值溶液要远远优于硅酸钠。Liu Jia等[9]认为硅酸钠的抗真菌活性,与硅酸钠的碱性直接相关。但是本实验发现与100 mmol/L硅酸钠溶液碱性相同的NaOH溶液胁迫下的孢子,添加抗氧化剂时,发现其保护效果要远高于硅酸钠胁迫的孢子。因此,推测硅酸钠的抑菌效果可能与其碱性有一定的关系外,最主要可能和硅酸根离子直接相关。
抗氧化剂的添加方式,对孢子生存力的保护存在差异,这可能是由于作为预防剂时,对孢子产生的ROS能及时清除,能保护细胞膜或一 些蛋白质等大分子物质免受ROS的损伤,从而提高孢子的生存力;作为治疗剂时,孢子已产生的ROS使细胞质膜受损或已使蛋白质、核酸等大分子物质氧化损伤而发生不可逆变化,对其治疗效果有限。因此,其预防效果优于治疗效果。
综上所述,外源抗氧化剂VC、GSH和Cys对硅酸钠和对应pH值溶液胁迫下的分生孢子的存活能力均具有一定的保护作用,预防效果优于治疗效果,而且VC的效果要优于GSH和Cys;对硅酸钠胁迫下的孢子的存活力只能部分恢复,而能使对应pH值胁迫下的孢子的生存力80%恢复;因此,硅酸钠对T. roseum的抑制效果除了与其改变环境pH值外,更多地涉及硅酸根离子的影响。至于硅酸根离子是如何影响菌体自身产生和清除ROS,以及抗氧化剂如何参与ROS的清除尚有待进一步研究。
[1] 呼丽萍, 马春红. 苹果霉心病菌的侵染过程[J]. 植物病理学报, 1995, 25(4): 351-356.
[2] HUANG Yining, DEVERALL B J, TANG Wenhua, et al. Foliar application of acibenzolar-S-methyl and protection of postharvest rock melons and Hami melons from disease[J]. European Journal of Plant Pathology, 2000, 106(7): 651-656.
[3] BI Yang, TIAN Ship ing, LIU Hongxia, et al. Effect of temperature on chilling injury, decay and quality of Hami melon during storage[J]. Postharvest Biology and Technology, 2003, 29(2): 229-232.
[4] 杨波, 杨冬平, 高兆银, 等. 杀菌剂对芒果果腐病原粉红单端孢菌的室内毒力测定[J]. 热带生物学报, 2013, 4(1): 45-49.
[5] HUANG H C, KOKKO E G. Trichotheciu m roseum, a mycoparasite of Sclerotinia sclerotiorum[J]. Canadian Journal of Botany, 1993, 71(12): 1631-1638.
[6] TANG Yamei, XUE Huali, BI Yang, et al. A method of analysis for T-2 toxin and neosolaniol by UHPLC-MS/MS in apple fruit inoculated with Trichothecium roseum[J]. Food Additives & Contaminants: Part A, 2015, 32(4): 480-487.
[7] 魏晋梅, 周围, 毕阳. 粉红单端孢体外产毒条件的探讨及粗毒素活性测定[J]. 食品工业科技, 2007, 28(5): 110-112.
[8] AVIS T J. Antifungal compounds that target fungal membranes: applications in plant disease control[J]. Canadian Journal of Plant Pathology, 2007, 29(4): 323-329.
[9] LIU Jia, ZONG Yuanyuan, QIN G Z, et al. Plasma membrane damage contributes to antifungal activity of silicon against Penicillium digitatum[J]. Current Microbiology, 2010, 61(4): 274-279.
[10] LI Yongcai, BI Yang, GE Yonghong, et al. Antifungal activity of sodium silicate on Fusarium sulphureum and its effect on dry rot of potato tubers[J]. Journal of Food Science, 2009, 74(5): M213-M218.
[11] BI Yang, TIAN Shiping, GUO Yurong, et al. Sodium silicate reduces postharvest decay on Hami melons: induced resistance and fungistatic effects[J]. Plant Disease, 2006, 90(3): 279-283.
[12] 郭玉蓉, 葛永红, 毕阳, 等. 采后硅酸钠处理对苹果梨黑斑病的影响[J].食品科学, 2003, 24(12): 140-142.
[13] 李渐鹏, 胡林刚, 李永才, 等. 复合防腐剂对百合青霉病抑制效果的研究[J]. 食品科学, 2014, 35(3): 71-75.
[14] QIN Guozheng, ZONG Yuanyuan, CHEN Qiling, et al. Inhibitory effect of boron against Botrytis cinerea on table grapes and its po ssible mechanisms of action[J]. International Journ al of Food Microbiology, 2010, 138(1): 145-150.
[15] AVIS T J, MICHAUD M, TWEDDELL R J. Role of lipid composition and lipid peroxidation in the sensitivity of fungal plant pathogens to aluminum chloride and sodium metabisulfite[J]. Applied and Environmental Microbiology, 2007, 73(9): 2820-2824.
[16] ANGELOVA M B, PASHOVA S B, SPASOVA B K, et al. Oxidative stress response o f fi lamentous fungi induced by hydrogen peroxide and paraquat[J]. Mycological Research, 2005, 109(2): 150-158.
[17] QIN Guozheng, TIAN Shiping, CHAN Zhulong, et al. Crucial role of antioxidant proteins and hydrolytic enzymes in pathogenicity of Penicillium expans um analysis based on proteomics approach[J]. Molecular & Cellular Proteomics, 2007, 6(3): 425-438.
[18] AVIS T J, RIOUX D, SIMARD M, et al. Ultrastructural alterations in Fusarium sambucinum and Heterobasidion annosum treated wi th aluminum chloride and sodium metabisulfi te[J]. Phytopathology, 2009, 99(2): 167-175.
[19] HAMANN A D, BRUST H D, OSIEWACZ H D. Apoptosis pathways in fungal growth, development and ageing[J]. Trends in Microbiology, 2008, 16(6): 276-283.
[20] BHATTACHARJEE S. Reactive oxyge n species and oxidative burst: roles in stress, senescence and signal[J]. Current Science India, 2005, 89: 1113-1121.
[21] GESSLER N N, AVER’YANOV A A, BELOZERSKAYA T A. Reactive oxygen species in regulation of fungal development[J]. Biochemistry (Moscow), 2007, 72(10): 1091-1109.
[22] OGITA A, HIROOKA K, YAMAMOTO Y, et al. Synergistic fungicidal activity of Cu2+and allicin, an allyl sulfur compound from garlic, and its relation to the role of alkyl hydroperoxide reductase 1 as a cell surface defense in Saccharomyces cerevisiae[J]. Toxicology, 2005, 215(3): 205-213.
[23] 魏燕, 辛晓燕. 活性氧调控的细胞凋亡信号[J]. 现代肿瘤医学, 2011, 19(2): 371-373.
[24] HELLER J, TUDZYNSKI P. Reactive oxygen species in phytopathogenic fungi: signaling, development, and disease[J]. Annual Review of Phytopathology, 2011, 4 9: 3 69-390.
[25] 黄芳, 王建明, 徐玉梅. 硼抑制灰霉病菌孢子萌发机制的初步研究[J].植物病理学报, 2008, 38(4): 370-376.
Comparison of Protective Effects of Three Antioxidants on Spore Viability of Trichothecium roseum under Sodium Silicate Stress
ZHAO Guanhua, NIU Lili*, LUO Rongtao, DUAN Weipeng, ZHANG Rong, BI Yang, ZHANG Shenggui
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
The protective effects of three antioxidants on spores ofTrichothecium roseumunder sodium silicate and corresponding pH stress were studied by comparing the spore viability. The results showed that all the investigated antioxidants enabled the sodium silicate-stressed spor es to restore partially their viability. Moreover, the viability of 80% spores under corresponding pH stress was restored. VC had better protective effect onTrichothecium roseumspores than GSH and Cys. The preventive effect of the three antioxidants was better than their therapeutic effect.
antioxidants; sodium silicate; spore viability
TS255.3
A
10.7506/spkx1002-6630-201517036
2014-11-24
2013年国家级大学生创新创业训练计划项目(201310733019)
赵冠华(1990—),男,本科,研究方向为食品科学与工程。E-mail:lookgo@qq.com
*通信作者:牛黎莉(1979—),女,讲师,博士研究生,研究方向为采后防腐和保鲜。E-mail:niull@gsau.edu.cn

