脱氢表雄酮对大鼠脂肪代谢的影响及机理
陈 迪,康 健,马海田*
(南京农业大学 农业部动物生理生化重点实验室,江苏 南京 210095)
脱氢表雄酮对大鼠脂肪代谢的影响及机理
陈 迪,康 健,马海田*
(南京农业大学 农业部动物生理生化重点实验室,江苏 南京 210095)
目的:以雄性Sprague-Dawley(SD)大鼠为对象,探讨日粮中添加不同剂量的脱氢表雄酮(dehydroepiandrosterone,DHEA)对大鼠脂肪代谢常规生化指标及相关基因表达的影响。方法:将60只雄性SD大鼠随机分为对照组,DHEA低、中、高剂量组,各处理组大鼠分别灌胃0、25、50、100 mg/(kg·d)的DHEA(以体质量计,下同),连续灌胃8 周,测定大鼠血脂、肝脂水平及肝脏脂肪代谢相关基因表达量。结果:DHEA中剂量组大鼠体质量显著低于对照组(P<0.05)。中剂量的DHEA可极显著降低大鼠血清中甘油三酯和血糖含量(P<0.01),低、中剂量的DHEA可显著升高大鼠血清高密度脂蛋白胆固醇含量(P<0.05)。脂肪代谢合成相关基因分析结果表明,低、高剂量的DHEA可显著或极显著降低大鼠肝脏组织中脂肪酸合成酶(fatty acid synthase,FAS)mRNA表达水平(P<0.05或P<0.01);与对照组相比,不同剂量的DHEA均可显著或极显著降低大鼠肝脏组织中固醇调节元件结合蛋白-1(sterol regulatory element binding protein-1,SREBP-1)mRNA和肝细胞核因子-4(hepatocyte nuclear factor-4,HNF-4)mRNA表达水平(P<0.05或P<0.01),但对乙酰辅酶A羧化酶(acetyl coenzyme A carboxylase,ACC)mRNA表达水平均无显著影响(P>0.05)。脂肪代谢分解相关基因分析结果表明,不同剂量DHEA均可显著或极显著降低大鼠肝脏组织中酰基辅酶A氧化酶(acyl coenzyme A oxidase,ACO)mRNA表达水平(P<0.05或P<0.01);与对照组相比,低、高剂量的DHEA可显著或极显著降低大鼠肝脏组织中肉毒碱棕榈酰转移酶-1(carnitine palmitoyl transterase-1,LCPT-1)mRNA和过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor-α,PPARα)mRNA表达水平(P<0.05或P<0.01);中、高剂量的DHEA可显著或极显著降低大鼠肝脏组织中脂肪三酰甘油脂肪酶(adipose triglyceride lipase,ATGL)mRNA表达水平(P<0.05或P<0.01)。结论:长期灌胃DHEA可影响雄性大鼠脂肪代谢途径中关键因子基因的表达,最终降低大鼠体内脂肪的沉积。
脱氢表雄酮;脂类代谢;mRNA
世界卫生组织(World Health Organization,WHO)提出肥胖是对人类健康最大的威胁之一,肥胖是很多疾病的重要诱因,如关节炎、糖尿病、心脑血管疾病及高血压甚至癌症[1-2],并且肥胖会导致更高的发病率和死亡率。现如今中国城市居民正面临着“肥胖危机”,这将对中国医疗卫生和福利体系造成真实、不可避免的压力[3]。脱氢表雄酮(dehydroepiandrosterone,DHEA)及其硫酸盐(dehydroepiandrosteronesulfate,DHEAS)是一种C19类固醇激素,主要由肾上腺与性腺(睾丸、卵巢)分泌[4]。DHEA是性激素合成过程的中间产物,经靶器官的调节,能转化成雌激素、雄激素、孕激素和皮质酮等其他激素[5-6],因此被誉为多向性“激素缓冲剂”[7-8]。DHEA的受体广泛分布于肝脏、肾脏和睾丸等器官中,参与完成一系列广泛而重要的生理反应。已有的研究[9]表明,DHEA在促进脂肪代谢、抗氧化、提高机体免疫力、增强细胞活性、促进动物健康生长发育等方面具有积极的调节作用。虽然大量研究[10-11]报道,DHEA可能作为一种抗肥胖的中间代谢产物来减少脂肪贮存,然而DHEA在体内对脂肪代谢影响的确切生物化学机制还在不断探索当中。因此,本实验以雄性Sprague-Dawley(SD)大鼠为对象,探讨长期饲喂DHEA对SD大鼠体质量、脂肪代谢常规生化指标及相关基因表达的影响,以期为DHEA作为降脂调节剂在人类医学和畜牧生产中的应用提供理论基础和实验依据。
1 材料与方法
1.1 动物、材料与试剂
清洁级雄性SD大鼠,初始体质量200~220 g,购自苏州大学实验动物中心,许可证号:SYXK(苏)2008-0024。SD大鼠饲养期间,恒温25℃,相对湿度50%,自由采食饮水,自然光照。
DHEA(纯度99%),购自江苏常州佳尔科药业集团有限公司。
甘油三酯(triglyceride,TG)测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒、游离脂肪酸(free fatty acid,FFA)测定试剂盒、血糖测定试剂盒 南京建成生物工程研究所;Green Master Mix美国Vazyme Biotech公司。
1.2方法
1.2.1动物分组与处理
适应性饲养1周后,将60只雄性SD大鼠随机分为4组:对照组,DHEA低、中、高剂量组。各处理组大鼠分别灌胃0、25、50、100 mg/(kg·d)的DHEA(以体质量计,下同),连续灌胃8周,期间记录各组大鼠的体质量及采食量。实验期间各组大鼠均饲喂普通日粮,该日粮配比符合GB 14924.3—2010《实验动物配合饲料营养成分》,饲料由江苏协同生物工程有限责任公司提供。
1.2.2 样品采集及处理
实验结束时,各处理组大鼠禁食12 h后称质量,处死大鼠并采集血清,-20℃条件下保存备用。取大鼠肝脏、睾丸周围脂肪垫,称质量后于-70℃条件下保存。
1.2.3 常规生化指标检测
使用磷酸甘油氧化酶-过氧化物酶-抗过氧化物酶复合物(glycerolphosphate oxidase-peroxidase anti-peroxidase complex,GPO-PAP)法检测血清及肝脏组织中TG和TC含量,使用双试剂直接法检测HDL-C含量,使用比色法检测FFA和血糖水平,具体操作步骤按照试剂盒说明书方法进行。
1.2.4 脂肪代谢相关基因检测
取SD大鼠肝脏组织样品,用Trizol试剂提取总RNA,紫外分光光度计和变性琼脂糖凝胶电泳测定总RNA浓度与纯度(OD260nm/OD280nm=1.8~2.0)。
反转录采用20μL体系:12μmol/L随机引物、0.5 mmol/L dNTP、20 U/μLRNA酶抑制剂、10 U/μL反转录酶(M-MLV RTase)、4μL5×RT Buffer(250 mmol/L T r i s-H C l(p H 8.3)、5 0 m m o l/L M g C l2、250 mmol/L KCl、50 mmol/L二硫苏糖醇、2.5 mmol/L亚精胺)。反转录流程为:RNA模板、dNTP和随机引物混合,70℃变性5 min,立即冷却,加入其余试剂37℃反应60 min,95℃灭活5 min。所得产物于-20℃条件下保存备用。脂肪代谢相关基因引物序列使用Primer 5.0软件设计,由Invitrogen生物技术有限公司合成。引物序列及相关参数如表1所示。
实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)使用20μL反应体系:2μLcDNA模板、10μLAceQ☒ qPCR SYBR☒Green Master Mix、目的基因引物2μL、加入灭菌蒸馏水使反应体系体积至20μL。PCR反应条件如下:95℃10 s,60℃5 s,72℃30 s,40个循环。

表1 目的基因引物序列Table1 Primer sequences for target genes
1.3 数据统计分析
2 结果与分析
2.1 DHEA对大鼠体质量、采食量及睾丸周围脂肪垫质量的影响
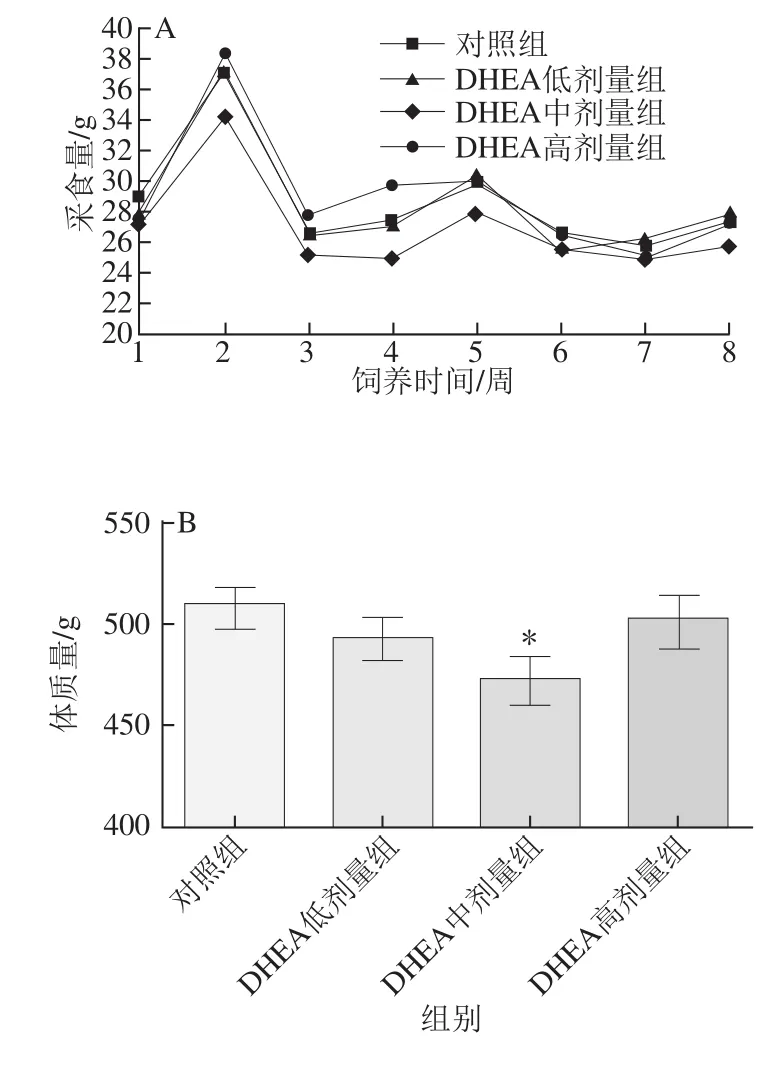
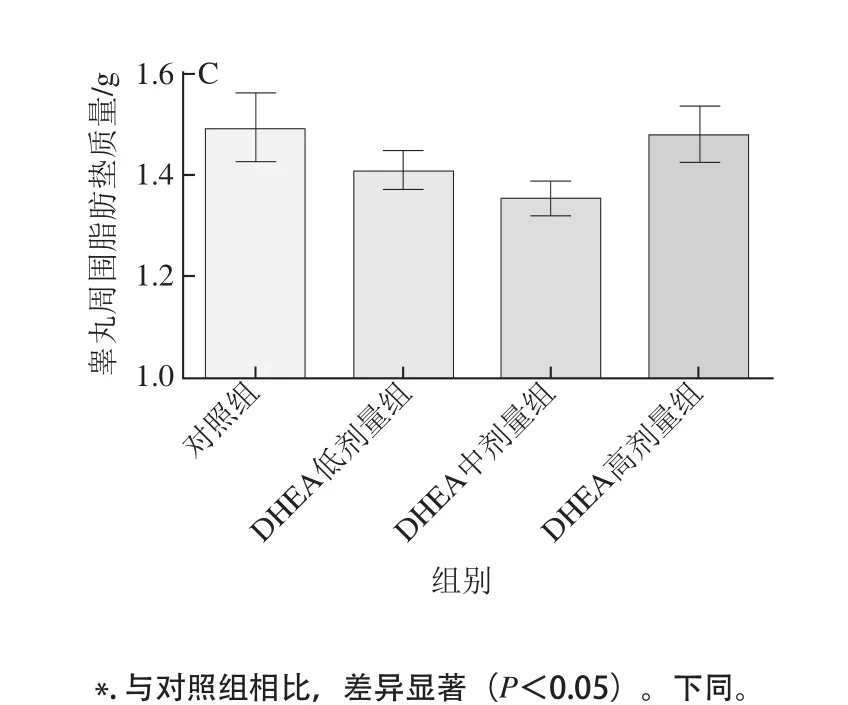
图1 DHEA对大鼠采食量(A)、体质量(B)及睾丸周围脂肪垫质量(C)的影响Fig.1 Effect of DHEA on feed intake (A), body weight (B) and epididymal fat-pad weight (C) in rats
如图1所示,8周实验期内,各剂量的DHEA对大鼠采食量无显著影响(图1A);DHEA中剂量组大鼠的体质量显著低于对照组(P<0.05),DHEA低、高剂量组大鼠的体质量均有降低趋势,但没有表现出统计学上差异(P>0.05)(图1B)。DHEA各组大鼠的睾丸周围脂肪垫质量虽然无统计学上的差异,但均有降低的趋势(P>0.05)(图1C),3个DHEA剂量组大鼠的睾丸周围脂肪垫质量较对照组分别降低了5.55%、9.24%和1.13%。
2.2 DHEA对大鼠血清脂肪代谢常规生化指标的影响

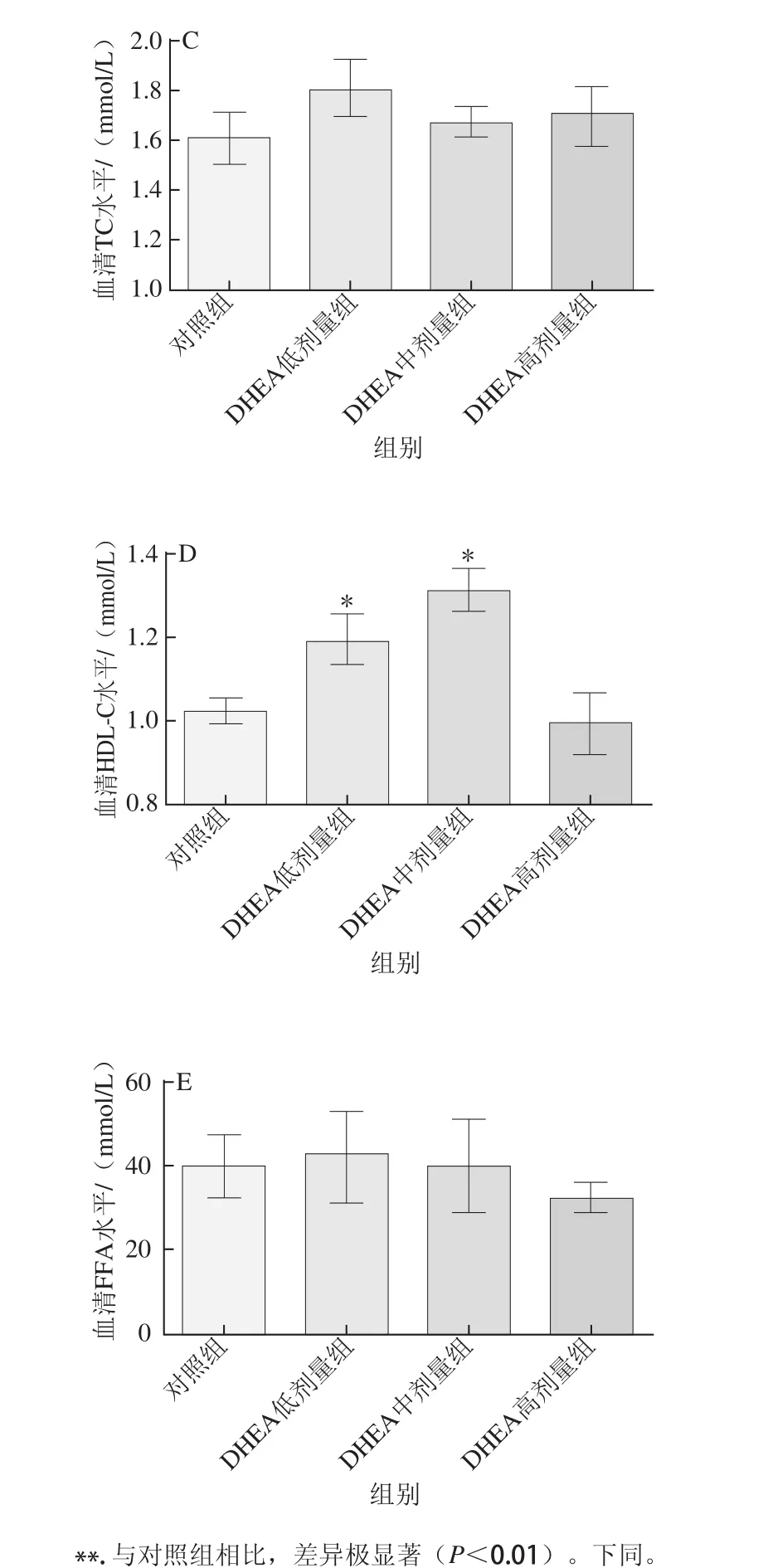
图2 DHEA对大鼠血清脂肪代谢相关生化指标的影响Fig.2 Effect of DHEA on lipid metabolism parameters in the serum of rats
如图2所示,中剂量的DHEA可极显著降低大鼠血清中TG和血糖含量(P<0.01),低、高剂量的DHEA对大鼠血清中TG和血糖含量均无显著影响(P>0.05)。低、中剂量的DHEA可显著提高大鼠血清HDL-C含量(P<0.05),但3个不同剂量的DHEA对大鼠血清TC以及FFA含量均无显著影响(P>0.05)。
2.3 DHEA对大鼠肝脏组织中TG、TC含量及肝脂酶活性的影响
如图3所示,3个不同剂量的DHEA对大鼠肝脏组织中TG、TC含量均无显著影响(P>0.05)。不同剂量的DHEA均有提高肝脂酶活性的趋势,且DHEA高剂量组大鼠肝脏中肝脂酶活性显著高于对照组(P<0.05)。
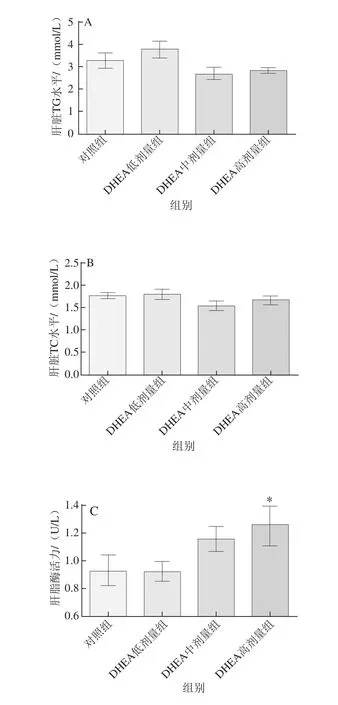
图3 DHEA对大鼠肝脏TG、TC含量及肝脂酶活性的影响Fig.3 Effect of DHEA on the contents of triglycerides and cholesterol and lipase activity in the liver of rats
2.4 DHEA对大鼠肝脏中脂肪合成相关因子mRNA表达量的影响

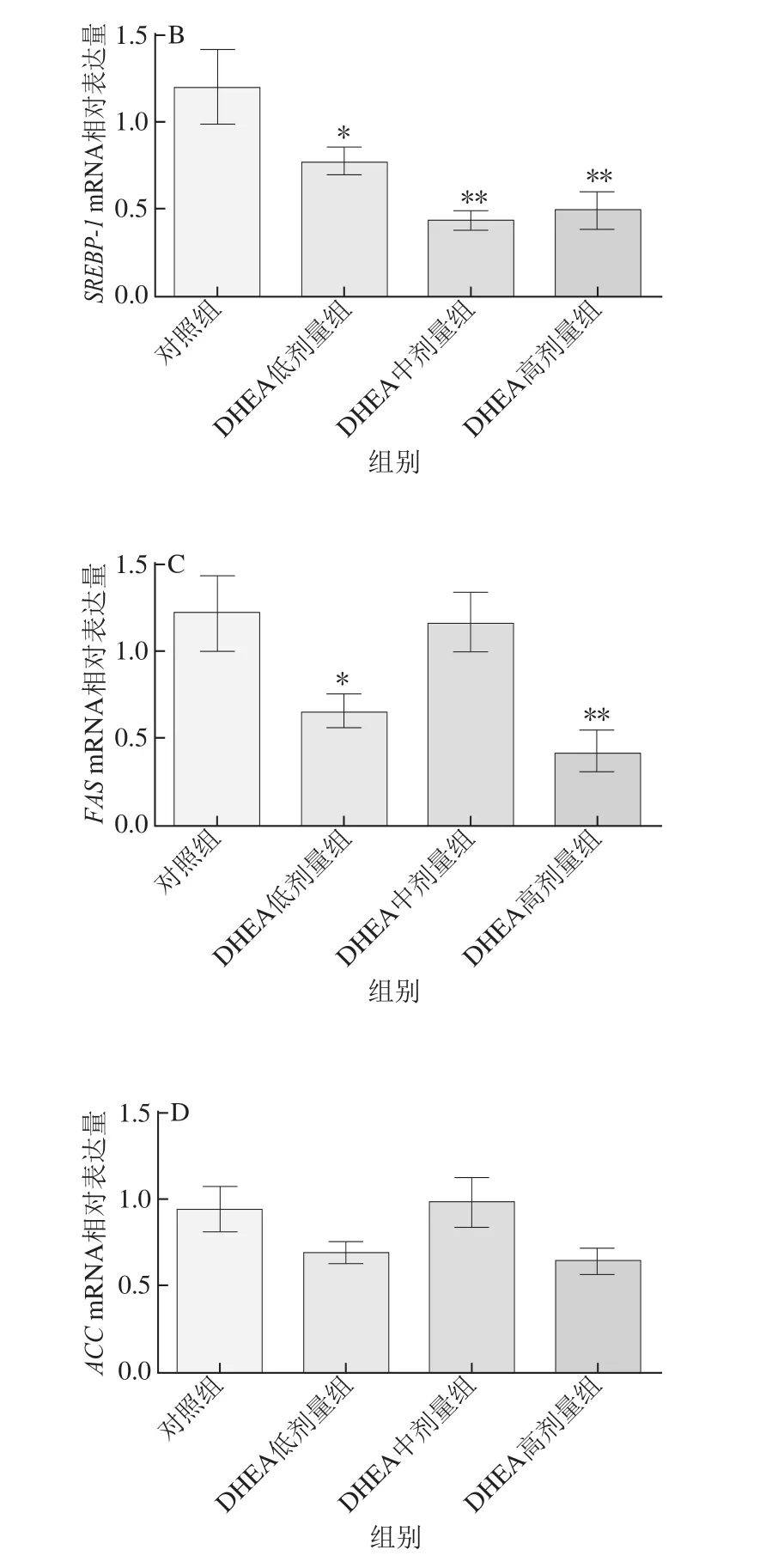
图4 DHEA对大鼠肝脏脂肪合成代谢相关基因表达的影响Fig.4 Effect of DHEA on the mRNA expression levels of lipid anabolism-related genes in the liver of rats
如图4所示,低剂量的DHEA可显著降低大鼠肝脏组织中FASmRNA表达水平(P<0.05),高剂量的DHEA则可极显著降低大鼠肝脏组织中FASmRNA表达水平(P<0.01);与对照组相比,低剂量的DHEA可显著降低大鼠肝脏组织中SREBP-1mRNA表达水平(P<0.05),中、高剂量的DHEA则可极显著降低大鼠肝脏组织中SREBP-1mRNA表达水平(P<0.01);低、高剂量的DHEA可极显著降低大鼠肝脏组织中HNF-4mRNA表达水平(P<0.01),同时中剂量的DHEA可显著降低HNF-4mRNA表达水平(P<0.05);3个不同剂量的DHEA对大鼠肝脏组织中ACCmRNA表达水平均无显著影响(P>0.05)。
2.5 DHEA对肝脏中脂肪分解相关因子mRNA表达的影响
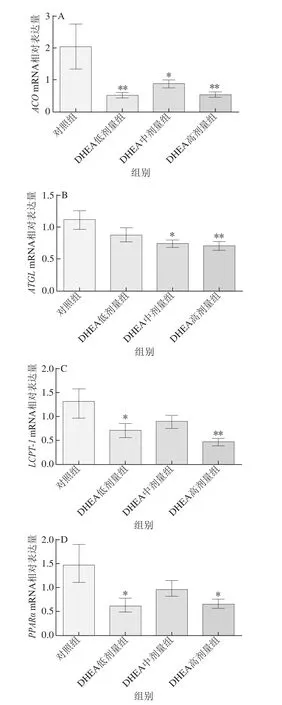
图5 DHEA对大鼠肝脏脂肪分解代谢相关基因表达的影响Fig.5 Effect of DHEA on the mRNA expression levels of lipolysis metabolism-related genes in the liver of rats
如图5所示,中剂量的DHEA可显著降低大鼠肝脏组织中ACOmRNA表达水平(P<0.05),低、高剂量的DHEA则可极显著降低大鼠肝脏组织中ACOmRNA表达水平(P<0.01);与对照组相比,低剂量的DHEA可显著降低大鼠肝脏组织中LCPT-1mRNA表达水平(P<0.05),高剂量的DHEA则可极显著降低大鼠肝脏组织中LCPT-1mRNA表达水平(P<0.01);DHEA低、高剂量组大鼠肝脏组织中PPARαmRNA表达水平较对照组显著降低(P<0.05);DHEA中剂量组大鼠肝脏组织中ATGLmRNA表达水平较对照组显著降低(P<0.05),而高剂量的DHEA则可极显著降低大鼠肝脏组织中ATGLmRNA表达水平(P<0.01)。
3 讨 论
大量研究表明[11-13],DHEA的作用不仅限于作为甾体激素前体发挥抗衰老作用,其在降低体质量、促进脂肪代谢、抗氧化、提高机体免疫力、增强细胞活性和促进动物健康生长发育等方面均具有积极的调节作用[9,14]。本实验结果表明,连续8周灌胃50 mg/(kg·d)的DHEA可以显著降低雄性大鼠的体质量,该结果与Yamauchi等[15-16]报道的DHEA可通过改变机体的能量利用方式来减轻体质量报道一致。不同剂量的DHEA对大鼠睾丸周围脂肪垫质量虽然无统计学上的显著影响,但3个DHEA剂量组大鼠睾丸周围脂肪垫质量分别较对照组降低了5.55%、9.24%和1.13%,提示DHEA对雄性大鼠脂肪的沉积有一定抑制作用,这与本实验前期研究结果(DHEA有降低幼年期大鼠腹脂沉积的效应)基本一致[17-18]。本实验结果表明,连续8周灌胃50 mg/(kg·d)的DHEA可降低大鼠血清中TG和血糖含量,同时显著升高大鼠血清中HDL-C含量,但对大鼠血清FFA含量并无显著影响,血清中FFA的含量不仅取决于脂肪动员速率,也取决于肝脏摄入脂肪酸的速率,可能由于其他生化机制的影响而导致FFA合成和分解速率达到平衡,所以血清FFA含量没有变化。由以上结果可推测DHEA可能抑制肝脏脂肪酸合成、促进胆固醇向高密度脂蛋白胆固醇合成,并抑制极低密度脂蛋白胆固醇合成从而达到降脂的作用,这与Richards等[19]的报道结果一致。脂蛋白脂酶主要调节血浆脂蛋白中的脂质代谢,是清除血浆脂蛋白中所含TG的限速酶,而肝脂酶则在中、高密度脂蛋白的代谢中起着重要作用。本实验结果表明,不同剂量的DHEA均有提高大鼠肝酯酶活性的效应,增强了肝酯酶水解TG的能力,最终表现为大鼠血清中TG含量的降低和腹脂沉积的减少。
动物脂肪代谢与脂肪的合成、分解等过程息息相关,其中ACC、FAS、SREBP-1以及HNF-4等均是肝脏脂肪酸合成的关键因子[20]。本实验结果显示,连续8周灌胃DHEA可显著下调雄性SD大鼠肝脏组织中FASmRNA、SREBP-1mRNA和HNF-4mRNA的表达水平,提示DHEA对机体脂肪酸合成有抑制作用,从而降低了大鼠血清中的TG含量,达到减少脂肪沉积的效果。这与先前本课题组以罗氏308肉鸡为实验材料时所测得的结果一致[5]。
ACO是在过氧化物酶体中对中、长链脂肪酸进行β-氧化的限速酶[21];CPT-1是短链脂肪酸在线粒体中进行β-氧化的关键因子,而LCPT-1是CPT-1在肝脏中的分型[22];ATGL是脂肪分解的关键酶,与TG的分解代谢过程密切相关,可以显著地提升TG酯酶的活性并且催化脂类分解的第一步限速反应[23]。PPARs属于细胞核受体超家族,是配体依赖的转录因子,其调节脂类及脂蛋白代谢,影响脂肪酸的摄取和分解[24]。本实验结果表明,连续8周灌胃DHEA可显著下调雄性SD大鼠肝脏组织中ACOmRNA、LCPT-1mRNA、PPARαmRNA和ATGLmRNA的表达水平,提示DHEA可以抑制机体中TG的分解和脂肪酸的氧化,表明DHEA对脂肪分解代谢也存在抑制效应。
综合以上实验结果表明,DHEA对脂肪合成关键因子的抑制作用可能是血清TG水平降低及脂肪沉积减少的直接原因,猜测脂肪分解的关键因子被抑制也有可能是由脂肪合成被抑制导致的,因为血清TG水平降低及脂肪沉积减少意味着脂肪分解代谢的底物减少,由此触发了机体的反馈机制,导致脂肪分解的关键因子mRNA表达量降低。这种反馈调节可能与SREBP、SREBP裂解激活蛋白的协同作用有关[25],但其具体代谢机制尚不明确,还需要进一步研究。
综上所述,长期灌胃DHEA可影响脂肪代谢途径中关键因子基因的表达,最终降低雄性SD大鼠体内脂肪的沉积。
[1] STRĄCZKOWSKI M, KOWALSKA I, STĘPIEŃ A, et al. Insulin resistance in the first-degree relatives of persons with type 2 diabetes[J]. Medical Science Monitor, 2003, 9(5): CR186-CR190.
[2] van VLIET-OSTAPTCHOUK J V, NUOTIO M L, SLAGTER S N, et al. The prevalence of metabolic syndrome and metabolically healthy obesity in Europe: a collaborative analysis of ten large cohort studies[J]. BMC Endocrine Disorders, 2014, 14: 9. doi: 10.1186/1472-6823-14-9.
[3] KOPELMAN P G. Obesity as a medical problem[J]. Nature, 2000, 404: 635-643.
[4] 马志民, 刘兰服, 姚海兰, 等. 脱氢表雄酮研究进展[J]. 河北农业科学, 2014, 18(3): 60-62.
[5] CHEN Juan, TANG Xue, ZHANG Yuanshu, et al. Effects of maternal treatment of dehydroepiandrosterone (DHEA) on serum lipid profi le and hepatic lipid metabolism-related gene expression in embryonic chickens[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2010, 155(4): 380-386.
[6] RICE S P L, ZHANG L, GRENNAN-JONES F, et al. Dehydroepiandrosterone (DHEA) treatment in vitro inhibits adipogenesis in human omental but not subcutaneous adipose tissue[J]. Molecular and Cellular Endocrinology, 2010, 320(1): 51-57.
[7] Y U E J i a n g, WA N G L i h u a, H U A N G R o n g, e t a l. Dehydroepiandrosterone-sulfate (DHEAS) promotes MIN6 cells insulin secretion via inhibition of AMP-activated protein kinase[J]. Biochemical and Biophysical Research Communications, 2013, 440(4): 756-761.
[8] 卢佳宏. 针刺对治疗患者面部痤疮、血清IGF-1、DHEA及改善其抑郁焦虑状态的研究[D]. 北京: 中国中医科学院, 2013: 84-86.
[9] MORALES A J, NOLAN J J, NELSON J C, et al. Effects of replacement dose of dehydroepiandrosterone in men and women of advancing age[J]. The Journal of Clinical Endocrinology & Metabolism, 1994, 78(6): 1360-1367.
[10] HANSEN P A, HAN D H, NOLTE L A, et al. DHEA protects against visceral obesity and muscle insulin resistance in rats fed a high-fat diet[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 1997, 273(5): R1704-R1708.
[11] KAJITA K, ISHIZUKA T, MUNE T, et al. Dehydroepiandrosterone down-regulates the expression of peroxisome proliferator-activated receptor γ in adipocytes[J]. Endocrinology, 2003, 144(1): 253-259.
[12] 林健, 何聆, 林升清, 等. 脱氢表雄酮对大鼠的发育毒性[J]. 癌变·畸变·突变, 2007, 18(6): 479-481.
[13] K A J I T A K, I K E D A T, M O R I I, e t a l. E f f e c t s o f dehydroepiandrosterone (DHEA) on AMPK activity and gene expression in fat tissue[J]. Diabetologia, 2006, 49∶ 354.
[14] 严卫星, 贾群山. DHEA的安全性与功能[J]. 中国食品卫生杂志, 2000, 12(1): 44-49.
[15] YAMAUCHI T, KAMON J, MINOKOSHI Y, et al. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase[J]. Nature Medicine, 2002, 8(11): 1288-1295.
[16] YAMAUCHI T, KAMON J, WAKI H, et al. The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity[J]. Nature Medicine, 2001, 7(8): 941-946.
[17] 马海田, 田朝阳, 宋李杰, 等. 脱氢表雄酮对幼年大鼠脂类代谢的影响[J]. 南京农业大学学报, 2008, 31(3): 113-116.
[18] 马海田, 田朝阳, 邹思湘, 等. 脱氢表雄酮对大鼠脂类代谢和抗氧化作用的影响[J]. 中国应用生理学杂志, 2009, 25(1): 95-96.
[19] RICHARDS R J, PORTER J R, SVEC F. Serum leptin, lipids, free fatty acids, and fat pads in long-term dehydroepiandrosterone-treated Zucker rats[J]. Proceedings of the Society for Experimental Biology and Medicine, 2000, 223(3): 258-262.
[20] PENG I C, CHEN Z, SUN W, et al. Glucagon regulates ACC activity in adipocytes through the CAMKKβ/AMPK pathway[J]. American Journal of Physiology-Endocrinology and Metabolism, 2012, 302(12): E1560-E1568.
[21] KARBOWSKA J, KOCHAN Z. Effect of DHEA on endocrine functions of adipose tissue, the involvement of PPARγ[J]. Biochemical Pharmacology, 2005, 70(2): 249-257.
[22] 魏冰, 白厚增, 靳一哲, 等. 运动, EGCG和肉碱对肥胖大鼠体重, 内脏脂肪及肝脏CPT1表达的影响[J]. 中国运动医学杂志, 2012, 31(4): 331-335.
[23] ZIMMERMANN R, STRAUSS J G, HAEMMERLE G, et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase[J]. Science, 2004, 306: 1383-1386.
[24] DESVERGNE B, WAHLI W. Peroxisome proliferator-activated receptors: nuclear control of metabolism 1[J]. Endocrine Reviews, 1999, 20(5): 649-688.
[25] 郭晓强, 郭振清. SREBP介导的胆固醇生物合成反馈调节[J]. 生命的化学, 2007, 27(4): 292-294.
Effect and Mechanism of Different Doses of Dehydroepiandrosterone on Lipid Metabolism in SD Rats
CHEN Di, KANG Jian, MA Haitian*
(Key Laboratory of Animal Physiology and Biochemistry, Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095, China)
This study aimed to investigate the effects of dehydroepiandrosterone (DHEA) on routine biochemical indicatorsand the expression levels of lipid metabolism-related genes. A total of 60 male Sprague-Dawley (SD) male rats wererandomly divided into 4 groups∶ control group (0 mg/(kg·d) DHEA), low-dose group (25 mg/(kg·d) DHEA), moderate-dosegroup (50 mg/(kg·d) DHEA) and high-dose group (100 mg/(kg·d) DHEA). The results showed that DHEA significantlydecreased body weight in moderate-dose group when compared with control group (P< 0.05). The levels of serumtriacylglycerol and glucose were highly significantly decreased in moderate-dose group (P< 0.01). The level ofhigh-density lipoprotein cholesterol (HDL-C) was signifi cantly increased in high-dose group(P< 0.05).The results of quantitative realtime polymerase chain reaction (qRT-PCR)showed that mRNA expression level of fatty acid synthase (FAS) was significantlydecreased in moderate-dose group (P< 0.05 orP< 0.01) when compared with control group. The mRNA expression levelsof sterol regulatory element binding protein-1 (SREBP-1) and hepatocyte nuclear factor-4 (HNF-4) were significantlydecreased in all the DHEA groups (P< 0.05 orP< 0.01). However, the mR NA expression level of acetyl coenzyme Acarboxylase (ACC) was not significantly changed (P> 0.05). As for the adipolysis-related genes, the mRNA expressionlevels of acyl coenzyme A oxidase (ACO) were significantly decreased in all the DHEA groups (P< 0.05 orP< 0.01).The mRNA expression levels of carnitine palmitoyl transterase-1 (LCPT-1) and peroxisome proliferator activated receptor-α(PPARα) were significantly decreased in both low- and high-dose groups (P< 0.05 orP< 0.01). The mRNA expression levels of adipose triglyceride lipase (ATGL) were significantly decreased in both moderate- and high-dose groups (P< 0.05 orP< 0.01). These findings indicate that DHEA affects the key factors affecting lipid metabolism, resulting in decreased fat deposition in male rats.
dehydroepiandrosterone (DHEA); lipid metabolism; mRNA
S852.23
1002-6630(2015)17-0252-07
10.7506/spkx1002-6630-201517047
2014-11-07
陈迪(1990—),女,硕士研究生,主要从事动物机能生物化学研究。E-mail:2012107012@njau.edu.cn
*通信作者:马海田(1974—),男,教授,博士,主要从事营养生物化学研究。E-mail:mahaitian@njau.edu.cn

