288.15-318.15 K温度范围内离子液体[C5mim][Pro]水溶液的体积和表面性质
李 驰 杨宏旭 刘入境 杨 奇 佟 静 杨家振(辽宁大学绿色合成与先进材料制备化学辽宁省高校重点实验室,辽宁沈阳110036)
288.15-318.15 K温度范围内离子液体[C5mim][Pro]水溶液的体积和表面性质
李 驰 杨宏旭 刘入境 杨 奇 佟 静*杨家振
(辽宁大学绿色合成与先进材料制备化学辽宁省高校重点实验室,辽宁沈阳110036)
在288.15-318.15 K温度范围内,测定了不同浓度离子液体1-戊基-3-甲基咪唑丙酸盐([C5mim][Pro])水溶液的密度和表面张力,计算了不同温度下不同浓度的溶液热膨胀系数、表观摩尔体积和溶液等张比容;根据密度实验数据计算得到溶质表观膨胀率,并与Harned和Owen提供的理论方程计算结果作了比较,两者计算结果能够很好一致;另外,本文还验证了预测溶液表面张力的经验方程,用其预测溶液的表面张力,不仅与溶液表面张力实验值在误差范围内很好一致,也与用等张比容方法预测的结果一致.
离子液体水溶液;密度;表面张力;表观摩尔体积;等张比容;丙酸盐
1 引言
近年来离子液体已成为多学科交叉的前沿研究领域之一,其中利用羧酸合成的离子液体,易被生物降解、对环境更加友好,受到了学术界和产业界的高度重视.1-7丙酸是一种低毒、易于保存的廉价羧酸.丙酸离子液体具有普适催化性能,对纤维素等生物材料有强大的溶解力,可以预见在化工和医药工业中可能会有较大的应用前景.5,6
©Editorial office of Acta Physico-Chimica Sinica
长期以来,离子液体的研究一直集中在合成和应用上.尽管离子液体可以设计,人们也可以根据需要选择性地合成具有特殊性能的离子液体,然而离子液体溶液却能提供无限多个具有特殊性能的机会,同时,离子液体溶液的很多热力学性质也是离子液体应用中不可或缺的基础数据.8-12到目前为止,除本课题组研究过298.15 K的丙酸离子液体[C5mim][Pro]水溶液性质外,还没有类似报道.13作为我们研究工作14-17的继续,本文报道了(1)在288.15-318.15 K范围内,测定了不同浓度的离子液体1-戊基-3-甲基咪唑丙酸盐([C5mim][Pro])水溶液的密度和表面张力,根据文献18-20的方法计算了它们的表观摩尔体积和溶液的等张比容;(2)根据密度实验数据得到了不同温度、不同浓度的溶液的表观摩尔膨胀率,并与Harned和Owen21提供的理论方程的计算结果作了比较;(3)本文验证了预测溶液表面张力的经验方程并用其计算了溶液的表面张力,同时也用等张比容方法预测了不同浓度的丙酸离子液体[C5mim][Pro]水溶液的表面张力,两种方法的预测结果都与溶液表面张力实验值很好一致.
2 实验部分
2.1 试 剂
去离子水17为上海化学试剂有限公司生产的阴离子交换树脂(717型),用常规方法活化.N-甲基咪唑(AR试剂,纯度99%,浙江双港化工厂),使用前氮气保护减压蒸馏.乙腈(分析纯,天津天河化学试剂厂)用3A分子筛干燥,在氯化钙干燥管保护下分馏,收集354-355 K馏分.乙酸乙酯、丙酮、甲醇、溴代正戊烷、丙酸等均为AR级试剂(上海化学试剂有限公司),用标准方法精制.
2.2 离子液体的合成
用中和法合成了离子液体[C5mim][Pro].17,22-24用核磁共振氢谱(1H NMR)和差式扫描量热(DSC)表征了产品的结构(见Supporting Information中的图S1、表S1和图S2).核磁共振谱表征没有发现杂质的共振峰.差式扫描量热(DSC)数据是在-120-100°C温度区间获得的,先保持样品在-120°C平衡5 min,而后以10°C·min-1的速率升温至100°C.从DSC谱图可见,[C5mim][Pro]没有明确的熔点,只有玻璃化转变温度Tg=-76.02°C,这一点与文献24中报道的氨基酸离子液体十分类似.
2.3 丙酸离子液体水溶液的密度与表面张力的测定
在质量摩尔浓度0.0100-0.5000 mol·kg-1范围内配制一系列离子液体[C5mim][Pro]水溶液样品,在288.15-318.15 K温度范围内用奥地利Anton Paar公司生产的DMA 4500型振动管数字密度计测量这些样品的密度.测量前用干燥空气和去离子水校正该仪器,其自身控温精度为±0.01 K.在298.15 K下测量纯水密度,与文献值25相比误差不超过±0.00002 g·cm-3.
在与上述相同的温度和浓度范围内,用最大气泡法表面张力组合实验仪(DP-AW,南京桑力电子设备厂生产)测量样品的表面张力.用带有二级控温装置的超级恒温水浴(GDH-2008W,上海比朗仪器有限公司)控制测量温度,控温精度为±0.05 K.用校正过的仪器在298.15 K下测量纯水的表面张力,其结果与文献值25相比误差不超过±0.10 mJ·m-2,说明该仪器可以在本工作中使用.
将测量样品的密度和表面张力数据分别列入表1和表2中,表中的每一个值都是三次测量的平均值.每个样品都是用重量法新鲜配制的.从表中可以看出,离子液体的密度和表面张力随着温度的升高而降低;表面张力随着浓度的增加而减小,密度随着浓度的增加而增大.
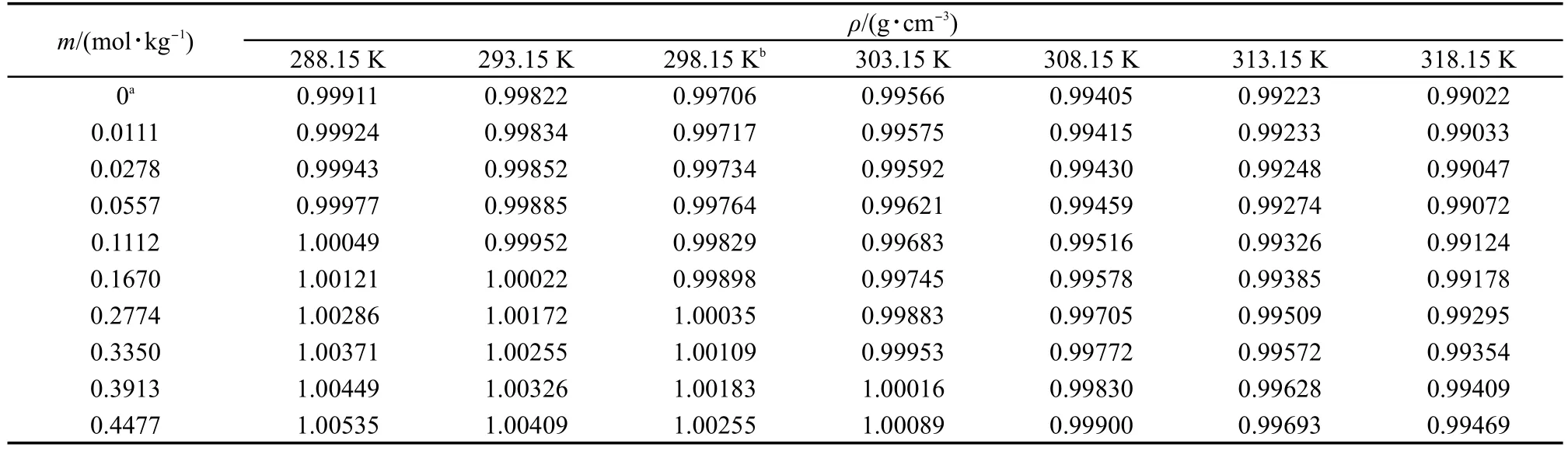
表1 在288.15-318.15 K范围内不同浓度(m)的[C5mim][Pro]水溶液的密度(ρ)Table 1 Values of density(ρ),for aqueous[C5mim][Pro]with various molalities(m)at 288.15-318.15 K
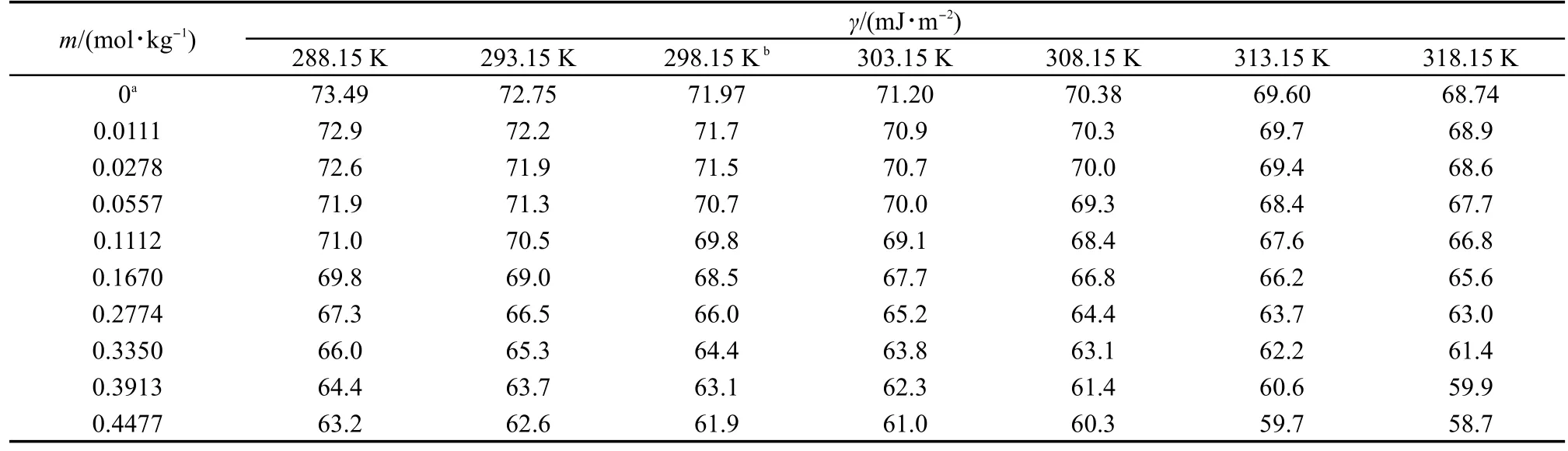
表2 在288.15-318.15 K范围内不同浓度的[C5mim][Pro]水溶液的表面张力(γ)Table 2 Values of surface tension(γ),for aqueous[C5mim][Pro]with various molalities at 288.15-318.15 K
3 结果和讨论
3.1 [C5mim][Pro]水溶液的热膨胀系数
[C5mim][Pro]水溶液的密度ρ与温度T的关系可用下面的经验方程表示:
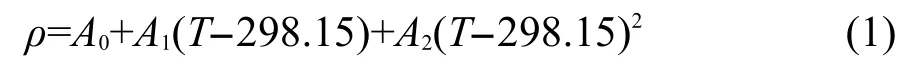
其中Ai是经验参数.按照方程(1)用密度数据ρ对(T-298.15)拟合,将拟合得到的参数Ai值、相关系数r和标准偏差s都列入表3中.另外,把用水的文献密度值25对(T-298.15)拟合得到的Ai值也列入了表3.根据热膨胀系数α的定义:20
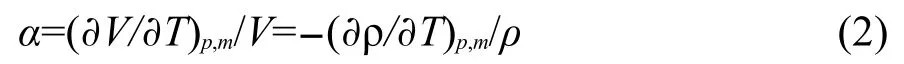
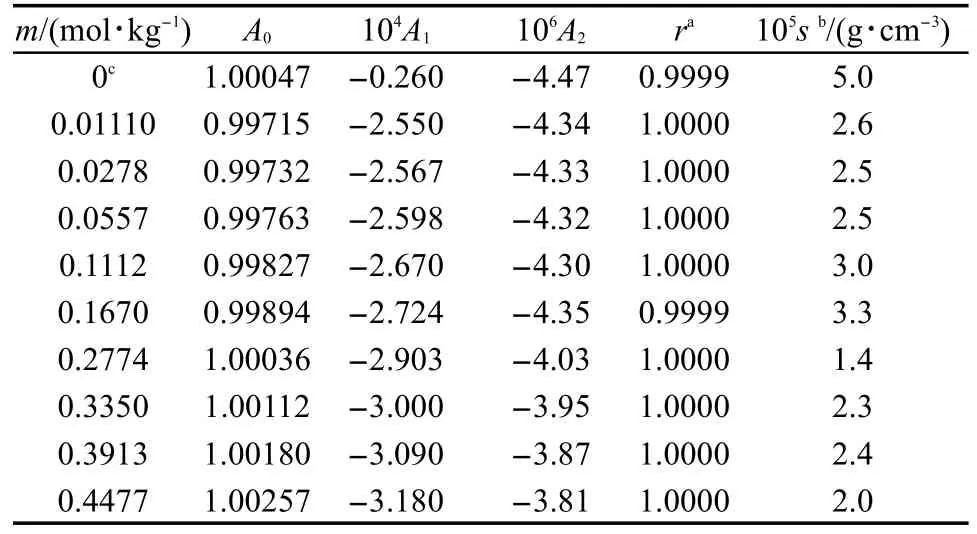
表3 [C5mim][Pro]水溶液的密度ρ对(T-298.15)拟合得到的各参数值(A0,A1,A2)Table 3 Parameter values(A0,A1,A2)of the fitting for the densities for aqueous[C5mim][Pro]and(T-298.15)
其中下角标p和m分别为压力和质量摩尔浓度.借助方程(1)可得到计算α的方程:
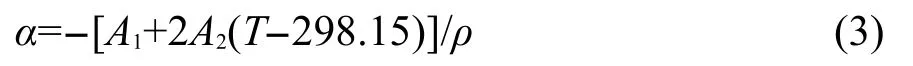
按照方程(3)计算得到不同温度下各个浓度的[C5mim][Pro]水溶液热膨胀系数α,并列入Supporting Information中(见表S2).在指定温度下用α对m作图能得到一组很好的直线(见图1).
3.2 [C5mim][Pro]水溶液的表观摩尔膨胀率
利用方程(4)可从溶液的密度数据得到表观摩尔体积(φVB)21
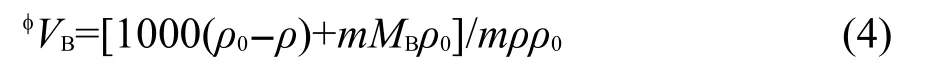
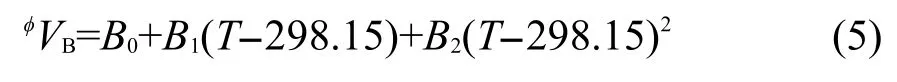
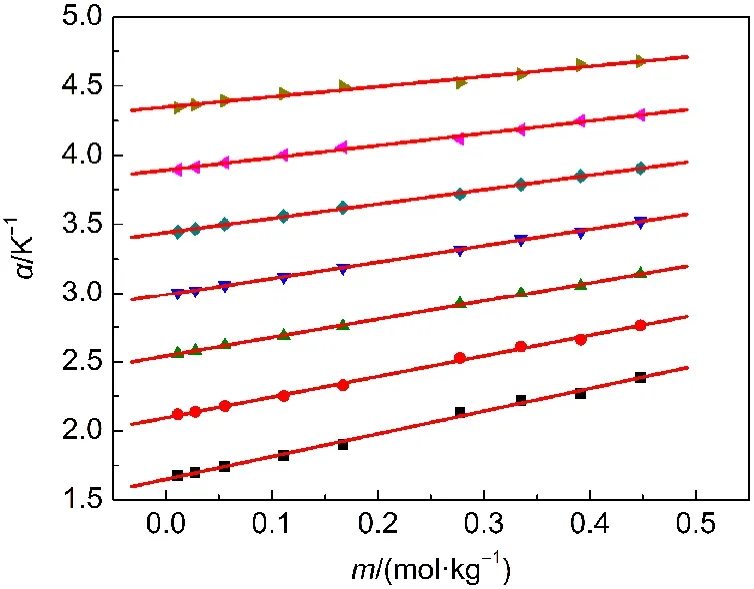
图1 不同温度下[C5mim][Pro]水溶液热膨胀系数α对质量摩尔浓度(m)的线性关系Fig.1 Plots of the thermal expansion coefficient α vs the molarity(m)for aqueous[C5mim][Pro]at different temperatures
其中ρ0是水的密度,MB是溶质的摩尔质量.将利用方程(4)计算得到的[C5mim][Pro]水溶液φVB的值列入Supporting Information表S3中.从表S3可见, [C5mim][Pro]水溶液的表观摩尔体积φVB随温度T的变化可用下面经验方程表示:其中Bi是经验参数.根据方程(5),用表观摩尔体积实验值对(T-298.15)作拟合,可得到经验参数Bi值,把Bi值连同拟合相关系数r和标准偏差s均列入表4中.从表4可见,相关系数r>0.995,标准偏差小于实验误差,表明此经验方程能很好地反映表观摩尔体积随温度的变化规律.
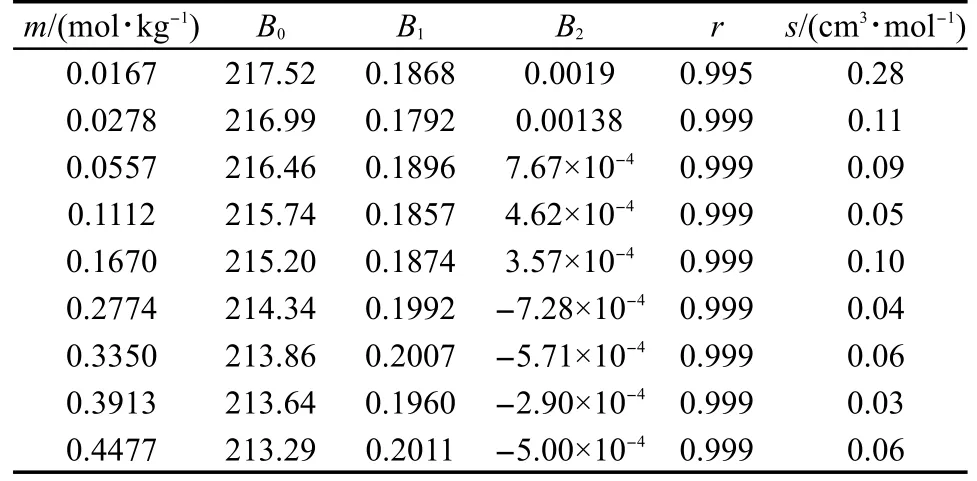
表4 [C5mim][Pro]水溶液的表观摩尔体积实验值对(T-298.15)作拟合得到的各参数值(B0,B1,B2)Table 4 Parameter values(B0,B1,B2)of the fitting for the apparent molar volume for aqueous[C5mim][Pro] and(T-298.15)
溶质的表观摩尔膨胀率ϕE的定义为:21

把经验方程(5)代入方程(6)中得到计算ϕE的工作方程:
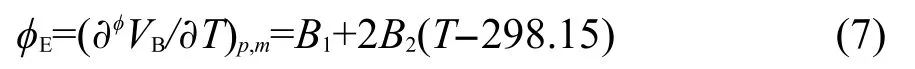
将用方程(7)计算得到的ϕE值列入Supporting Information的表S4中.
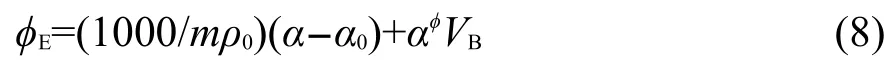
Harned和Owen21推导出计算溶质表观摩尔膨胀率ϕE的方程:其中ρ0和α0分别是水的密度和热膨胀系数.将利用方程(8)计算得到的ϕE(Est)值列入Supporting Information的表S5中.用表S5中的ϕE(Est)对表S4中对应的ϕE值作图,能得到很好的直线,其斜率接近1,截距接近零并且相关系数r=0.997(见图2).这说明表S5中ϕE(Est)和表S4的ϕE是高度相关并十分近似的.
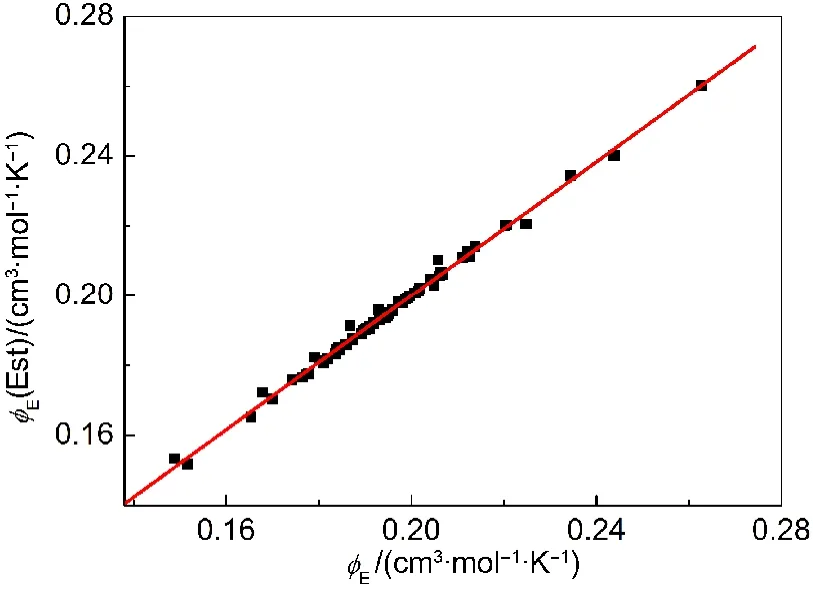
图2 从方程(8)得到的ϕE(Est)对由方程(7)计算的ϕE作图Fig.2 Plot of ϕE(Est)from Eq.(8)vs ϕEfrom Eq.(7)
3.3 [C5mim][Pro]水溶液的表面张力与浓度和温度的关系
从表2中数据可以看出,在指定温度下, [C5mim][Pro]离子液体水溶液的表面张力γ随溶液的浓度m呈线性变化,可用下面的经验方程表示:

其中Ci是经验参数.用γ对m作图,可得到一组很好的直线,相关系数都在0.999以上.将γ对m线性拟合得到的参数值列入表5中.从表5中数据可见,C0随温度呈线性变化,而C1基本不随温度变化,可用下面的经验方程表示:
将方程(10-1)和(10-2)代入方程(9)中,得到了预测[C5mim][Pro]离子液体水溶液表面张力的工作方程:
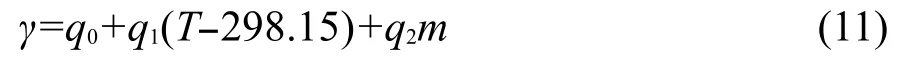
通过工作方程拟合可以得到q0=72.01,q1=-0.1341, q2=-22.84,相关系数r=0.9994,标准偏差s=0.07.将利用工作方程预测的[C5mim][Pro]离子液体水溶液的表面张力γPrd列入Supporting Information表S6中.用表面张力预测值γPrd对表2中实验值γ作图(见图3),得到一条很好的直线,其斜率接近1,截距接近零,线性拟合相关系数为0.999.说明γPrd和γ高度相关并十分相似.
3.4 用半经验的等张比容方法预测[C5mim][Pro]水溶液的表面张力
虽然用半经验方法预测的离子液体的性质不能算是准确的物理化学数据,但这些预测值常常能为科学研究指出方向.在众多的半经验方法中等张比容是最简单的一种.等张比容是一个相对古老的概念,其定义为:18,19
表5 根据经验方程(9)拟合得到的参数值(C0,C1)、相关系数及标准偏差Table 5 Parameter values(C0,C1)of the fitting according to Eq.(9),the linear correlation coefficient,and the standard deviation
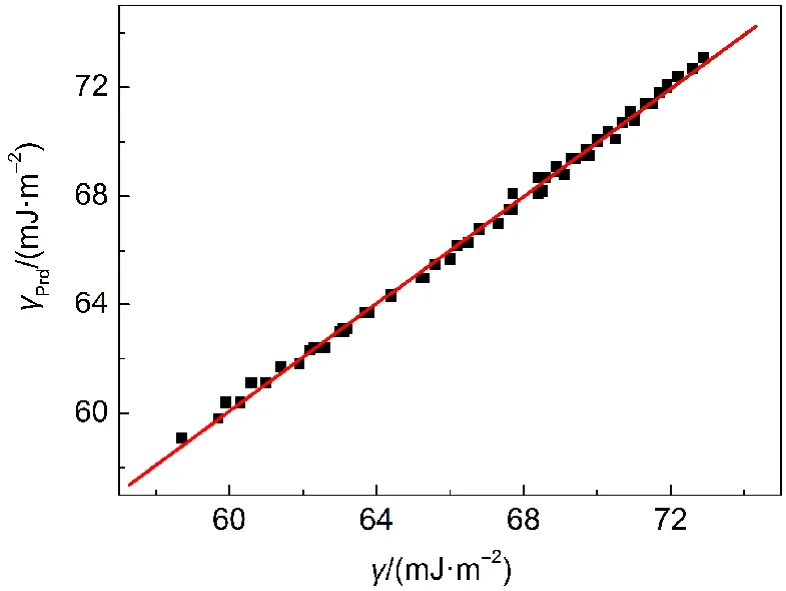
图3 利用工作方程(11)预测的[C5mim][Pro]水溶液表面张力γPrd对实验值γ作图Fig.3 Plot of γPrdpredicted by Eq.(11)vs γ obtained from experiments for aqueous[C5mim][Pro]

其中γ是表面张力,M是摩尔质量,ρ是密度,V是摩尔体积.
2008年Balasubrahmanyam20指出等张比容概念可以推广到溶液中,溶液的等张比容Pm与溶质的等张比容Psolute和溶剂的等张比容Psolvent之间关系为:

其中x为溶质的摩尔分数,其值可从质量摩尔浓度换算得到,x=mMA/(1000+mMA),其中MA是溶剂水的摩尔质量.26
丙酸离子液体水溶液的等张比容实验值P可用方程(12)计算,摩尔质量M应该采用溶液的平均摩尔质量Mm:

应用方程(12)和(14)计算了288.15-318.15 K温度范围内[C5mim][Pro]水溶液等张比容的实验值.将293.15和313.15 K的数据列入表6中,其余温度的数据列入Supporting Information表S7中.通常人们都认为等张比容与温度无关,18,19但是,从表6和表S7数据可见,随着温度升高,溶液等张比容的实验值缓慢降低.另外,将溶液等张比容的实验值与Balasubrahmanyam20给出的方程(13)计算值比较,我们发现两者的偏差超过了实验误差,方程(13)计算得到的等张比容值Pm只能看作是一个近似值,因为它没有考虑溶液中溶质-溶剂相互作用.为此,我们将(P-Pm)看作代表溶质-溶剂相互作用对等张比容的贡献,将计算得到的(P-Pm)=ΔP的值列入表6和表S7中.从表6和表S7可见,ΔP是负值,说明在水溶液中离子液体的离子发生了水化,原水化层中水分子被离子静电压缩而体积减小.我们还发现(PPm)的值与溶液的离子强度成正比,其经验公式为:27

其中Ap为经验常数,它代表溶液中溶质-溶剂间相互作用的大小.利用实验数据可得到方程(15)中Ap的平均值.有了Ap就可以利用方程(15)准确地预测任何浓度[C5mim][Pro]水溶液的等张比容P(Est),进而结合溶液的密度,估算出溶液的表面张力并将估算值γ(Est)列入表6中.图4是估算的表面张力γ(Est)对相应的实验值γ作图,从图4可见,估算值与实验值很好一致,拟合直线的斜率为0.97,相关系数为0.996,与用经验方程(11)的预测结果相差不多,误差范围在±0.50 mJ·m-2,这也表明用等张比容估算溶液的物理化学性质是一种可行的方法.
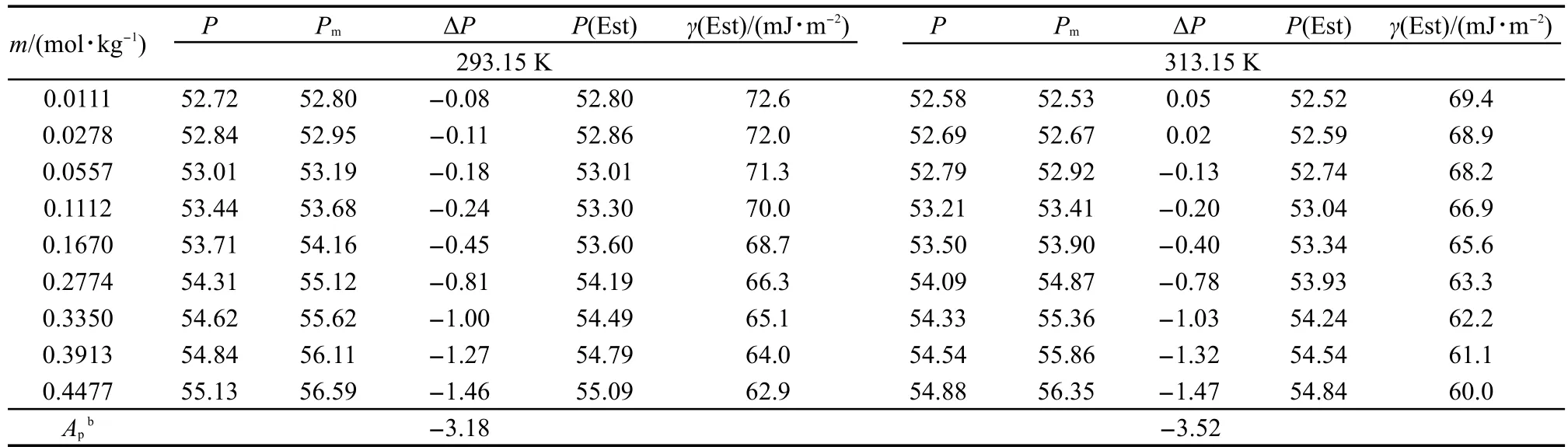
表6 293.15和313.15 K下[C5mim][Pro]水溶液的等张比容Table 6 Parachor of aqueous[C5mim][Pro]at 293.15 and 313.15 K
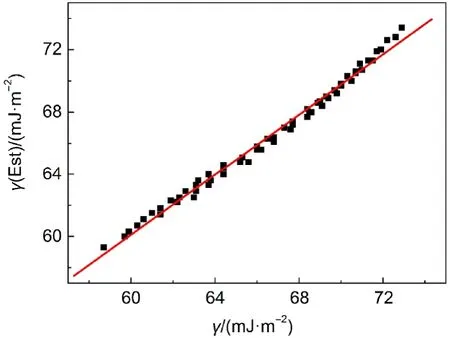
图4 等张比容半经验方法估算的[C5mim][Pro]水溶液表面张力γ(Est)对实验值γ作图Fig.4 Plot of the estimated surface tension γ(Est)for aqueous[C5mim][Pro]in terms of semi-emirical method of parachor vs their experimental γ values
4 结论
合成了1-戊基-3-甲基咪唑丙酸盐离子液体[C5mim][Pro],在288.15-318.15 K温度范围,每间隔5.00 K,测定了浓度为0.01-0.50 mol·kg-1的[C5mim][Pro]水溶液的密度和表面张力,计算了不同浓度、不同温度下溶液的热膨胀系数、表观摩尔体积和等张比容;根据密度实验数据计算了该溶液不同温度下不同浓度的溶质表观摩尔膨胀率,与Harned-Owen方程计算结果很好一致.本文提出了一个预测溶液表面张力的经验方程,其预测结果与溶液表面张力实验值在误差范围内很好地一致,另外也用等张比容半经验方法预测了溶液的表面张力,其结果与本文提出的经验方程法类似,这也表明等张比容半经验方法也可以用来估算溶液性质.
Supporting Information:available free of charge via the internet at http://www.whxb.pku.edu.cn.
(1) Zhao,H.;Jackson,L.;Song,Z.;Olubajo,O.Tetrahedron: Asymmetry2006,17,2491.doi:10.1016/j.tetasy.2006.09.009
(2) Zang,H.;Su,Q.;Mo,Y.;Cheng,B.W.;Jun,S.Ultrasonics Sonochemistry2010,17,749.doi:10.1016/j. ultsonch.2010.01.015
(3) Moniruzzaman,M.;Tahara,Y.;Tamura,M.;Kamiyaab,N.; Goto,M.Chem.Commun.2010,46,1452.
(4) Chakraborti,A.K.;Roy,S.R.J.Am.Chem.Soc.2009,131,6903.
(5) Xu,A.;Wang,J.;Zhang,Y.;Chen,Q.Ind.Eng.Chem.Res.2012,51,3458.doi:10.1021/ie201345t
(6) Ma,X.X.;Wei,J.;Zhang,Q.B.;Tian,F.;Feng,Y.Y.;Guan,W.Ind.Eng.Chem.Res.2013,52,9490.doi:10.1021/ie401130d
(7) Hong,M.;Liu,R.J.;Yang,H.X.;Guan,W.;Tong,J.;Yang,J. Z.J.Chem.Thermodynamics2014,70,214.doi:10.1016/j. jct.2013.11.004
(8) Rilo,E.;Pico,J.;García-Garabal,S.;Varela,L.M.;Cabeza,O.Fluid Phase Equilib.2009,285,83.
(9) Carolina,B.S.;Jesús,G.F.J.Chem.Eng.Data2010,55, 2905.doi:10.1021/je900962v
(10) Liu,W.W.;Zhao,T.Y.;Zhang,Y.M.;Wang,H.P.;Yu,M.F.J.Sol.Chem.2006,35,1337.doi:10.1007/s10953-006-9064-7
(11) Ries,L.A.S.;doAmaral,F.A.;Matos,K.;Martini,E.M.A.;de Souza,M.O.;de Souza,R.F.Polyhedron2008,27,3287.doi: 10.1016/j.poly.2008.07.029
(12) Fawcett,W.R.Liquids,Solutions,and Interfaces;Oxford University Press:New York,2004.
(13) Xu,W.G.;Li,C.;Liu,R.J.;Yang,H.X.;Tong,J.;Yang,J.Z.Ind.Eng.Chem.Res.2014,53,9959.doi:10.1021/ie501240t
(14) Tong,J.;Li,J.B.;Zhang,Q.G.;Yang,J.Z.Acta Chim.Sin.2007,65,315.[佟 静,李景斌,张庆国,杨家振,化学学报,2007,65,315.]
(15) Yang,J.Z.;Li,J.B.;Tong,J.;Hong,M.Acta Chim.Sin.2007,65,655.[杨家振,李景斌,佟 静,洪 梅,化学学报,2007,65,655.]
(16) Tong,J.;Hong,M.;Chen,Y.;Wang,H.;Yang,J.Z.J.Chem. Eng.Data2012,57(8),2265.doi:10.1021/je300161h
(17) Tong,J.;Ma,X.;Kong,Y.X.;Chen,Y.;Guan,W.;Yang,J.Z.J.Phys.Chem.B2012,116,5971.doi:10.1021/jp301985g
(18) Deetlefs,M.;Seddon,K.R.;Shara,M.Phys.Chem.Chem. Phys.2006,8,642.doi:10.1039/b513453f
(19) Sugden,S.J.Chem.Soc.Trans.1924,125,32.doi:10.1039/ ct9242500032
(20) Balasubrahmanyam,S.N.Curr.Sci.2008,94(12),1650.
(21) Harned,H.S.;Owen,B.B.The Physical Chemistry of Electrolyte Solutions,3rd ed.;Reinhild:New York,1958.
(22) Wilkes,J.S.;Levisky,J.A.;Wilson,R.A.;Hussey,C.L.Inorg. Chem.1982,21,1263.doi:10.1021/ic00133a078
(23) Huddleston,J.G.;Visser,A.E.;Reichert,W.M.;Willauer,H. D.;Broker,G.A.;Rogers,R.D.Green Chem.2001,3,156.doi: 10.1039/b103275p
(24) Fukumoto,K.;Yoshizawa,M.;Ohno,H.J.Am.Chem.Soc.2005,127(8),2398.doi:10.1021/ja043451i
(25) Lide,D.R.Handbook of Chemistry and Physics,82nd ed.;CRC Press:Boca Raton,2001.
(26) Hong,Z.Q.Introduction to the Theory of Electrolyte Solution,revised edition;Science Press:Beijing,1983;pp 86-87.[黄子卿.电解质溶液理论导论.修订版.北京:科学出版社,1983: 86-87.]
(27) Tong,J.;Kong,Y.X.;Wang,P.P.;Dai,L.L.;Yang,J.Z.Sci. China2012,42(6),776. [佟 静,孔玉霞,王盼盼,代丽丽,杨家振.中国科学,2012,42(6),776.]
Volume and Surface Properties of Aqueous[C5mim][Pro]at 288.15 to 318.15 K
LI Chi YANG Hong-Xu LIU Ru-Jing YANG Qi TONG Jing*YANG Jia-Zhen
(Key Laboratory of Green Synthesis and Preparative Chemistry of Advanced Materials,Liaoning University, Shenyang 110036,Liaoning Provence,P.R.China)
The density and surface tension of aqueous 1-pentyl-3-methylimidazolium propionate([C5mim][Pro]) of various molarities were determined at 288.15 to 318.15 K,and the coefficient of thermal expansion,the apparent molar volume,and the parachor for these solutions were calculated.The values of the apparent molar expansibility of solute obtained from data of the apparent molar volume are in good agreement with the values calculated by Harned-Owen equation.The empirical equation of the parachor was used to estimate the parachor and surface tensions of the solutions.Estimated values were within the experimental error of experimental values.
Aqueous ionic liquid;Density;Surface tension;Apparent molar volume;Parachor; Propionate
O642
10.3866/PKU.WHXB201411063www.whxb.pku.edu.cn
Received:September 11,2014;Revised:November 5,2014;Published on Web:November 6,2014.
∗Corresponding author.Email:tongjinglnu@sina.com;Tel:+86-24-86870976.
This project was supported by the National Natural Science Foundation of China(21273003),Education Bureau of Liaoning Province,China (LJQ2013001),Liaoning BaiQianWan Talents Program,China(2013921029),and Foundation of 211 Project for Innovative Talents Training, Liaoning University,China.
国家自然科学基金(21273003),辽宁教育厅(LJQ2013001),辽宁省百千万人才(2013921029)及辽宁大学创新人才培养基金项目资助

