桃叶珊瑚苷对急性脑出血大鼠脑组织IL-1β及NF-κB的影响*
刘秋庭姚 靓涂鄂文谭 莉李晓辉王 照胡 丹
(1.湖南省脑科医院,湖南 长沙 410007;2.湖南中医药大学临床医学院,湖南 长沙410007)
·研究报告·
桃叶珊瑚苷对急性脑出血大鼠脑组织IL-1β及NF-κB的影响*
刘秋庭1姚 靓2涂鄂文1谭 莉1李晓辉1王 照1胡 丹2
(1.湖南省脑科医院,湖南 长沙 410007;2.湖南中医药大学临床医学院,湖南 长沙410007)
目的观察桃叶珊瑚苷对急性脑出血大鼠血肿周围组织白介素-1β(IL-1β)及核转录因子-κB(NF-κB)表达的影响,探讨桃叶珊瑚苷保护脑出血后神经元损伤的机制。方法健康SD大鼠90只按随机数字表法随机分为假手术组、脑出血组、桃叶珊瑚苷组。脑出血组及桃叶珊瑚苷组于大鼠尾壳核区注入自体非肝素抗凝动脉血,建立脑出血动物模型,假手术组于相同部位注入0.9%氯化钠注射液。造模成功后,桃叶珊瑚苷组于术后2 h给予桃叶珊瑚苷4.2 mg/kg,腹腔注射,每日1次。而假手术组及脑出血组在同样时间给予相同剂量0.9%氯化钠注射液。每组设置12 h、2 d、3 d、5 d、7 d等5个时间点,Longa评分法评估神经功能缺损,免疫组化方法检测血肿周围脑组织中IL-1β和NF-κB的表达。结果与脑出血组比较,桃叶珊瑚苷组血肿周围IL-1β和NF-κB表达水平明显下降(P<0.05)。结论桃叶珊瑚苷对脑出血后神经元损伤具有保护作用,其机制可能与抑制 IL-1β和NF-κB的表达有关。
脑出血 桃叶珊瑚苷IL-1β NF-κB
脑出血(ICH)是神经内科一种具有高致死率及致残率的多发病和常见病。目前临床上除运用传统脱水药物治疗外,治疗手段较少。ICH急性期脑组织发生一系列的病理生理变化,其中炎症反应在ICH后继发性脑损伤中发挥了重要作用[1]。核转录因子-κB(NF-κB)是一种具有多向转录调节作用的蛋白质,通过诱导多种炎症因子表达,在脑缺血及细胞凋亡中起着中心环节的作用[2]。本实验通过观察桃叶珊瑚苷对ICH大鼠血肿周围脑组织白介素-1β(IL-1β)和NF-κB表达及神经功能缺损评分的影响,观察其对脑出血后继发性脑损害的保护作用,以探索脑出血治疗的新思路。现报告如下。
1 材料与方法
1.1 动物 健康雄性SD大鼠90只,购于上海斯莱克实验动物有限公司,体质量250~270 g。
1.2 药物与试剂 桃叶珊瑚苷购于四川维克奇生物科技有限公司。免抗大鼠IL-1β和NF-κB免疫组化试剂盒购于武汉博士德生物试剂公司;通用型二抗免疫组化试剂盒购于北京中山金桥生物试剂公司。
1.3 分组与造模 将大鼠按随机数字表法随机分成假手术组、脑出血组、桃叶珊瑚苷组,每组30只。治疗组于造模后2 h给予桃叶珊瑚苷4.2 mg/kg,腹腔注射,每日1次[3]。假手术组及脑出血组在同样时间给予相同剂量的0.9%氯化钠注射液。参照Rosenberg等报道的方法制备大鼠脑出血模型。用10%水合氯醛腹腔麻醉大鼠 (400 mg/kg),将其俯卧位固定在立体定位仪上,调节门齿托的高度,使大鼠前囟前、后囟处于同一水平,沿头皮正中切一长10 mm切口,无菌操作暴露前囟,定位于前囟前0.2 mm,中线向右旁开3 mm处钻一直径为0.5 mm的小孔,进针深度为5.5 mm(即尾壳核位置)。取大鼠尾静脉自体抗凝血50 μL,用微量进样器在8~10 min内缓慢、多次、少量注入,注血结束后留针10 min后缓慢退针,局部用骨蜡封闭后缝合皮肤。假手术组于相同部位注入等量无菌0.9%氯化钠注射液。以术后见明显肢体瘫痪,大鼠脑切片中有明显的圆形、椭圆形或不规则形的血肿存在为模型成功标准,不符合以上标准及死亡者剔除。所有操作均在无菌条件下进行,术毕将大鼠放回笼中饲养,自由活动进食进水。
1.4 观察指标 1)大鼠神经功能缺损评价。参照Longa 5级评分法[4],对神经功能评分。0级:无体征,记0分。1级:动物不能完全伸直其前肢,记1分。2级:动物一侧肢体瘫痪,有追尾现象,记2分。3级:动物不能站立或打滚,记3分。4级:无自发性活动,有意识障碍记4分。2)免疫组织化学染色检测IL-1β和NF-κB的表达。每组设置12 h、2 d、3 d、5 d、7 d等5个时间点,每个时间点6只大鼠。在相应时间点用水合氯醛深度麻醉大鼠,剑突下横切口,沿膈肌与胸廓交界处剪开膈肌,暴露心脏,于心尖向上进针,插入升主动脉,固定针头,剪开右心耳,快速滴入37℃0.9%氯化钠注射液100 mL,至右心耳流出液体变清亮,后用4%的多聚甲醛(0.1 mmol/L PBS配制,pH 7.2~7.4)灌注(10 mL/min),先快后慢,约250 mL。断头开颅取全脑,去除嗅脑、小脑和低位脑干,将脑组织置于浓度为4%的多聚甲醛中固定48 h。于穿刺针点为中心分别向前、后各移1.0 mm将脑组织冠状切开,修成包含出血区及周边区的4 mm、厚约2 mm的脑片,常规石蜡包埋,然后在切片机上连续切片,片厚2 μm,行IL-1β和NF-κB免疫组化染色。切片常规脱蜡至水,0.01 M柠檬酸钠缓冲液微波修复10 min;滴加一抗,4℃过夜,PBS液漂洗2 min×3次;加二抗,37℃孵育30 min,PBS漂洗2 min× 3次;DAB显色,中性树胶封片。在400倍视野下,用计算机图像分析系统软件随机观察并计数血肿周围4个不重复视野的不同时间段大脑IL-1β和NF-κB阳性细胞数,取其平均值。
1.5 统计学处理 应用SPSSl3.0统计软件进行分析。计量资料以(±s)表示,进行单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组神经功能缺损评分比较 见表1。假手术组无明显神经功能缺损,脑出血组与桃叶珊瑚苷组神经功能缺损呈现先上升后下降的趋势,都于术后3 d达高峰,其中,桃叶珊瑚苷组神经功能缺损程度评分显著低于脑出血组(P<0.05)。
表1 各组大鼠不同时间点神经功能缺损评分比较(分,±s)
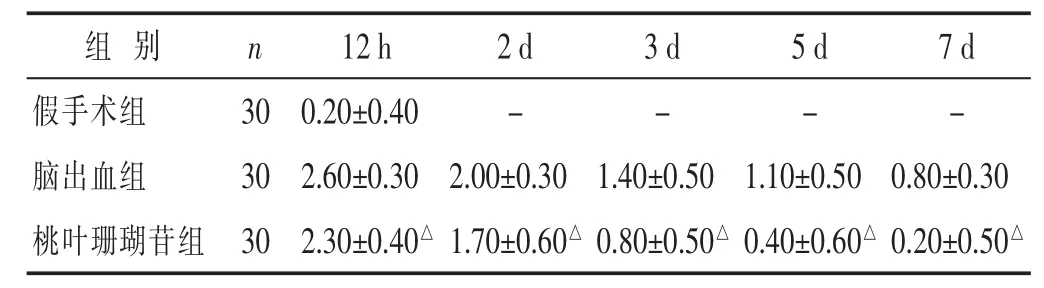
表1 各组大鼠不同时间点神经功能缺损评分比较(分,±s)
与脑出血组比较,△P<0.05。
组别 n 1 2 h 2 d 3 d 5 d 7 d假手术组 3 0脑出血组 3 0 0 . 2 0 ± 0 . 4 0 - -2 . 6 0 ± 0 . 3 0 2 . 0 0 ± 0 . 3 0 1 . 4 0 ± 0 . 5 0 --1 . 1 0 ± 0 . 5 0 0 . 8 0 ± 0 . 3 0桃叶珊瑚苷组 3 0 2 . 3 0 ± 0 . 4 0△1 . 7 0 ± 0 . 6 0△0 . 8 0 ± 0 . 5 0△0 . 4 0 ± 0 . 6 0△0 . 2 0 ± 0 . 5 0△
2.2 各组血肿周围脑组织IL-1β表达的比较 见表2。假手术组仅见少量淡黄色阳性染色细胞,同组各时间点比较差异无统计学意义(P>0.05)。术后12 h脑出血组及桃叶珊瑚苷组脑血肿区域即出现黄色淡染细胞,术后3 d两组IL-1β免疫反应达高峰,可见黄褐色深染的IL-1β阳性神经细胞,组间比较,桃叶珊瑚苷组其阳性细胞数明显少于脑出血组(P<0.05)。
表2 各组血肿周围脑组织IL-1β表达比较(ng/L,±s)
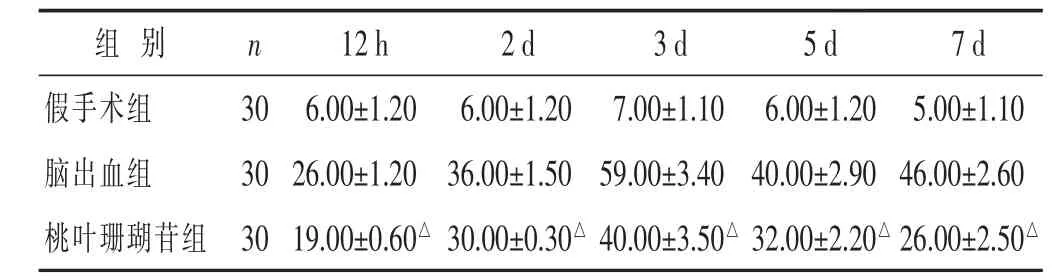
表2 各组血肿周围脑组织IL-1β表达比较(ng/L,±s)
与脑出血组同期比较,△P<0.05。下同。
组别 n 1 2 h 2 d 3 d 5 d 7 d假手术组 3 0脑出血组 3 0 6 . 0 0 ± 1 . 2 0 6 . 0 0 ± 1 . 2 0 7 . 0 0 ± 1 . 1 0 2 6 . 0 0 ± 1 . 2 0 3 6 . 0 0 ± 1 . 5 0 5 9 . 0 0 ± 3 . 4 0 6 . 0 0 ± 1 . 2 0 5 . 0 0 ± 1 . 1 0 4 0 . 0 0 ± 2 . 9 0 4 6 . 0 0 ± 2 . 6 0桃叶珊瑚苷组 3 0 1 9 . 0 0 ± 0 . 6 0△3 0 . 0 0 ± 0 . 3 0△4 0 . 0 0 ± 3 . 5 0△3 2 . 0 0 ± 2 . 2 0△2 6 . 0 0 ± 2 . 5 0△
2.3 各组血肿周围脑组织NF-κB表达的比较 见表3。假手术组大鼠脑内NF-κβ阳性表达极少,脑出血组见较多NF-κB p65阳性表达,与脑出血组比较,桃叶珊瑚苷组各时间点NF-κβ p65阳性细胞数显著减少(P<0.05)。
表3 各组脑血肿周围NF-κβ数目情况比较(±s)
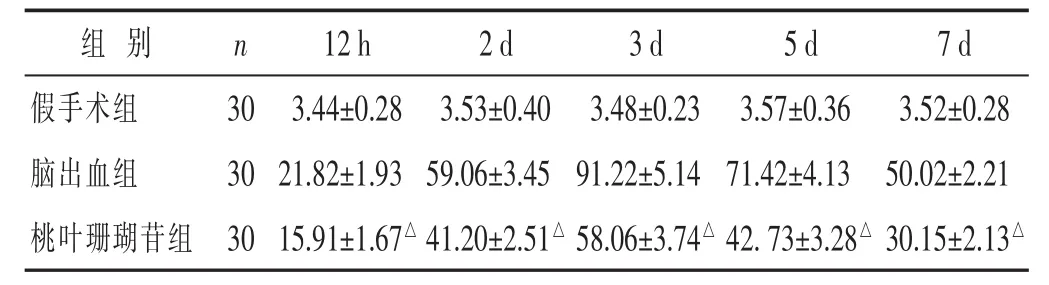
表3 各组脑血肿周围NF-κβ数目情况比较(±s)
组别 n 1 2 h 2 d 3 d 5 d 7 d假手术组 3 0脑出血组 3 0 3 . 4 4 ± 0 . 2 8 3 . 5 3 ± 0 . 4 0 3 . 4 8 ± 0 . 2 3 2 1 . 8 2 ± 1 . 9 3 5 9 . 0 6 ± 3 . 4 5 9 1 . 2 2 ± 5 . 1 4 3 . 5 7 ± 0 . 3 6 3 . 5 2 ± 0 . 2 8 7 1 . 4 2 ± 4 . 1 3 5 0 . 0 2 ± 2 . 2 1桃叶珊瑚苷组 3 0 1 5 . 9 1 ± 1 . 6 7△4 1 . 2 0 ± 2 . 5 1△5 8 . 0 6 ± 3 . 7 4△4 2 . 7 3 ± 3 . 2 8△3 0 . 1 5 ± 2 . 1 3△
2.4 NF-κB、IL-1β及神经功能缺损评分的相关性经Spesrman等级相关分析,NF-κB和IL-1β呈正相关(r=0.94,P<0.01),NF-κB和神经功能缺损评分呈正相关(r=0.93,P<0.01)。
3 讨 论
桃叶珊瑚苷是一种环烯醚帖类化合物,具有多种生物学活性,如降血压、肝脏保护、抗炎、抗微生物、止痛、通便、抗肿瘤等,尤其是能够缓解由脑病引起的损伤[5-6]。本实验结果显示:桃叶珊瑚苷组神经功能缺损评分较脑出血组明显降低,提示桃叶珊瑚苷有明显的神经保护作用。
NF-κB是一种具有多向转录调节作用的蛋白质,主要由NF-κB p50和NF-κB p65组成的异源性二聚体,广泛存在于血管内皮细胞、小胶质细胞、星形胶质细胞和少突胶质细胞。当机体受到特定刺激时,如炎症递质、紫外线等,通过白介素-1(IL-1)、肿瘤坏死因子-α(TNF-α)介导的一系列信号途径,导致IκB蛋白磷酸化降解,使NF-κB恢复活性,从而调控ICAM-1、TNF-α等炎性因子的转录,参与炎症反应、细胞凋亡等重要的病理生理过程[7]。研究表明,ICH急性期IL-1β在血清和脑脊液中的表达明显增高,并于出血后2~3 d达高峰;用重组IL-1β向大鼠脑内注射,发现注射通道周围出现炎症细胞浸润和水肿形成,继续给予大剂量注射,脑水肿更明显。因此,IL-1β是通过炎症反应及增加血脑屏障通透性,引起脑水肿,使其成为ICH后炎症反应的重要标志[8]。本实验结果显示,大鼠脑出血后脑组织IL-1β和大鼠神经功能缺损评分呈正相关,IL-1β和NF-κB的表达水平也显著相关,由此推断NF-κB可能通过调控IL-1β的转录,产生免疫应答和炎症反应,导致继发性脑神经损伤。
桃叶珊瑚苷具有抗炎作用,在由抗原刺激的大鼠嗜碱性白细胞(RBL-2H3 mast)培养中发现,桃叶珊瑚苷可抑制由抗原刺激产生的TNF-α和IL-1等炎症因子的基因表达与蛋白合成;同时,桃叶珊瑚苷能抑制NF-κB的亚单位由细胞胞浆内向核内的转位,并通过抑止κBα的磷酸化阻止Iκ-Bα的降解,使胞浆内Iκ-Bα浓度升高,进而抑制NF-κβ活性,而下调TNF-α,产生抗炎效果[9]。本实验结果表明,桃叶珊瑚苷能有效减轻脑出血后继发性脑神经损伤,且明显抑制脑组织IL-1β表达,这提示IL-1β可能成为桃叶珊瑚苷通过抗炎来减轻继发性脑神经损伤的作用靶点。
[1] Xiang JZ,Hai Y,Shu CH.Brain edema after intracerebral hemorrhage in rats:the role of inflammation[J].Neurology Indian,2006,54(4):402-407.
[2] Yamamoto M,Takeda K.Role of nuclear I kappa B proteins in the regulation of host immune responses[J].Infect Chemother,2008,14(4):265-269.
[3] 金雷,薛宏宇,徐永平.桃叶珊瑚苷对糖尿病大鼠线粒体抗氧化作用[J].山西医药,2008,48(4):16-17.
[4] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebralartery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[5] An SJ,Pae HO,Oh GS,et al.Inhibition of TNF-α,IL-1,and IL-6 productions and NF-κB activation in lipopolysaccharide-activated RAW 264.7 macrophages by catalposide,an iridoid glycoside isolated from Catalpa ovata G[J].Don(Bignoniaceae).Int Immunopharmacol,2002,2(15):1173-1181.
[6] 薛宏宇,金礼吉,金雷.桃叶珊瑚苷在初级糖尿病脑病中的神经保护作用[J].中国科学,2008,38(7):599-605.
[7] Yamamoto M,Takeda K.Role of nuclear I kappa B proteins in the regulation of host immune responses[J].Infect Chemother,2008,14(4):265-269.
[8] Carhuapoma JR,Barker PB,Hanley DF,et al.Human brain hemorrhage:quantification of perihematoma edema by use of diffusion weighted MR imaging[J].Am J Neuroradiol,2002,23(8):1322-1326.
[9] Jeong HJ,Koo HN,Na HJ,et al.Inhibition of TNF-alpha and IL-6 production by Aucubin through blockade of NF-kappa B activation RBL-2H3mast cells[J].Cytokine,2002,18(5):252.
The Influence of Aucubin on IL-1β and NF-κβ Expression after Cerebral Hemorrhage in Rats
LIU Qiuting,YAO Liang,TU Ewen,et al.Brain Hospital of Hunan Province,Hunan,Changsha 410007,China
Objective:To explore the possible mechanism of Aucubin to neuroprotection by inhibiting the expression of IL-1β and NF-κB to reduce inflammatory response after cerebral hemorrhage and open up new ideas for questing cerebral hemorrhage treatment.Methods:90 adult male Sprague Dawley rats were randomly divided into the sham operation group,the cerebral hemorrhage group and the aucubin group.Autologous blood was injected into the rat caudate nucleus to prepare cerebral hemorrhage,and sham operation group injected with saline at the same site.Two hours after the surgery,the aucubin group was injected intraperitoneal with aucubin 4.2 mg/ kg once a day,each rat of the sham operation and cerebral hemorrhage rats was injected the same amount of saline.After surgery,each group was randomly divided into five time points,which were 12 h,2 d,3 d,5 d and 7 d.The neural function score of a model rat was evaluated by longa score.The expression of IL-1β and NF-κβ around the hematoma was tested by immunohistochemistry.Results:In the aucubin group,the number of IL-1β and NF-κβ around the hematoma decreased significantly at each time point,than the cerebral group.Conclusion:The aucubin has an evident protective effect on injured neuron after cerebral hemorrhage in rats.
Cerebral hemorrhage;Aucubin;IL-1β;NF-κβ
R285.5
A
1004-745X(2015)08-1327-03
10.3969/j.issn.1004-745X.2015.08.005
2015-03-24)
湖南省科技厅科技项目 (2013SK3214)

