血管紧张素Ⅱ和坎地沙坦对小鼠骨骼肌细胞C2C12胰岛素敏感性的影响
李 凡 谢 静 英明中 曾 强
解放军总医院国际医学中心,北京100853
血管紧张素Ⅱ和坎地沙坦对小鼠骨骼肌细胞C2C12胰岛素敏感性的影响
李 凡 谢 静 英明中 曾 强▲
解放军总医院国际医学中心,北京100853
目的研究血管紧张素Ⅱ和坎地沙坦对小鼠骨骼肌细胞(C2C12)胰岛素敏感性的影响及其机制。方法C2C12诱导分化成熟后,分为对照组(C组)、模型组(M组,AngⅡ0.1μmol/L)、坎地沙坦低剂量组(Can1组,坎地沙坦0.1μmol/L+AngⅡ0.1μmol/L)、坎地沙坦中剂量组(Can2组,坎地沙坦1μmol/L+AngⅡ0.1μmol/L)、坎地沙坦高剂量组(Can3组,坎地沙坦10μmol/L+AngⅡ0.1μmol/L)。各组细胞给予相应药物及胰岛素处理后,使用二氯荧光素二乙酸酯(DCFH-DA)检测细胞内活性氧(ROS)的生成水平,使用2-脱氧葡萄糖(2-NBDG)检测细胞对胰岛素的敏感性,并用RT-PCR法和Western印迹法分别检测各组细胞内的核转录因子-2(Nrf2)的mRNA及蛋白表达水平。结果与C组比较,M组ROS生成水平显著升高(P<0.01),摄取2-NBDG量显著降低(P<0.01);与M组比较,Can3组ROS生成水平显著减少(P<0.05),摄取2-NBDG量则显著增加(P<0.05)。M组Nrf2的mRNA及蛋白表达较C组显著降低(P<0.01),Can2组及Can3组Nrf2的mRNA及蛋白表达较M组显著升高(P<0.01或P<0.05)。结论AngⅡ通过下调C2C12中Nrf2的mRNA及蛋白表达,抑制Nrf2的抗氧化效应,增加ROS生成,引起骨骼肌细胞胰岛素抵抗;而坎地沙坦通过抑制AngⅡ的这种作用改善骨骼肌胰岛素抵抗。
坎地沙坦;血管紧张素Ⅱ;胰岛素抵抗;核转录因子-2;活性氧
胰岛素抵抗(insulin resistance,IR)是指机体对胰岛素的敏感性下降,导致细胞摄取和利用葡萄糖的效率降低,为了维持血糖稳定,机体代偿性分泌过多胰岛素造成高胰岛素血症的状态。IR是高血压与2型糖尿病的共同病理生理基础,是两者之间关联性的重要指标[1]。目前,已有多项临床试验结果证实,血管紧张素Ⅱ受体拮抗剂(angiotensinⅡ receptor blocker, ARB)类降压药可改善高血压患者的IR,从而降低该人群的2型糖尿病发病率[2-3]。本研究组之前的研究结果也显示,ARB类药物中的坎地沙坦可以改善高血压动物模型的胰岛素抵抗[4]。ARB的这种作用部分来源于对于细胞内活性氧(ROS)的抑制[5,11],但是其具体分子机制尚不清楚。由于骨骼肌是机体进行葡萄糖代谢的主要器官,因此本研究以小鼠成肌细胞(C2C12)为研究对象,通过检测血管紧张素Ⅱ(AngⅡ)和坎地沙坦对细胞内抗氧化反应元件的关键调控因子——Nrf2的影响,进一步探讨坎地沙坦改善骨骼肌细胞胰岛素抵抗的分子机制。现报道如下:
1 材料与方法
1.1 实验材料
小鼠C2C12由北京协和医学院基础学院细胞资源中心提供。坎地沙坦、AngⅡ和2-脱氧葡萄糖(2-NBDG)购自Sigma公司,活性氧检测试剂盒购自南京碧云天公司,M-MLV反转录试剂盒购自Takara公司,Real-time PCR扩增试剂盒购自北京中原公司,Nrf2多克隆抗体购自Santa Cruz公司,HPR标记的羊抗兔及羊抗鼠IgG购自北京中杉金桥生物技术公司。
1.2 方法
1.2.1 C2C12的培养、诱导分化及分组细胞加入含10%胎牛血清的DMEM培养基,置于37℃、含5%CO2的培养箱中培养,隔日换液,待细胞生长至70%~80%融合时按1∶4传代。C2C12细胞达80%左右融合时,移除DMEM 10%胎牛血清生长培养基,换用含2%马血清的DMEM培养基诱导分化,每24小时换液1次,7 d后分化成为成熟骨骼肌细胞。细胞鉴定后进行如下分组:对照组(C组,DMEM);模型组(M组,AngⅡ0.1μmol/L+DMEM);坎地沙坦低剂量组(Can1组),坎地沙坦0.1μmol/L+AngⅡ0.1μmol/L+DMEM);坎地沙坦中剂量组(Can2组,坎地沙坦1μmol/L+AngⅡ0.1μmol/L+DMEM);坎地沙坦高剂量组(Can3组,坎地沙坦10μmol/L+AngⅡ0.1μmol/L+DMEM)。
1.2.2 2-NBDG法检测葡萄糖吸收率C2C12培养第8天,细胞换液为无血清DMEM培养基100μL。按实验分组依次加入坎地沙坦、AngⅡ和胰岛素(10 nmol/L),并使坎地沙坦终浓度符合分组要求。每一种药物干预间隔时间为30min,并置于孵箱中。每组6个重复,无细胞为背景组。每孔细胞加入终浓度为150μg/mL 2-NBDG,孵育1h。室温下,400 r/min离心培养板5min。小心吸去上清后每孔加入200μL的Cell based assay buffer细胞缓冲液。室温下,400 r/min离心培养板5min,再每孔加入100μL的Cell based assay buffer细胞缓冲液。立即使用荧光分光光度计读板分析,读出细胞摄取的2-NBDG荧光值。激发光波长485 nm,发射光波长535 nm。以C组的荧光值为基准,各组与C组的比值为2-NBDG的摄取量,代表了细胞对胰岛素的敏感性。
1.2.3 二氯荧光素二乙酸酯(DCFH-DA)法检测ROS水平对数生长期的C2C12细胞接种于6孔板,DMEM培养基培养。去除细胞培养液后,每孔加入1mL稀释好的DCFH-DA,37℃孵育30 min后,加入AngⅡ并使其终浓度为0.1μmol/L。30 min后按实验分组加入不同浓度坎地沙坦,并使坎地沙坦终浓度符合分组要求,37℃孵育24 h后胰酶消化细胞并收集,1200 r/min离心3min,弃掉上清液。细胞溶于300μL的无血清DMEM培养基,吹打成细胞悬液。每100μL加入到1个96孔板中,使用488 nm激发波长,525 nm发射波长进行读板,检测荧光值,以C组的荧光值为基准,各组与C组的比值为ROS产生量。
1.2.4 Rea l-t ime PCR实验诱导成熟的C2C12换无血清DMEM,坎地沙坦、AngⅡ和胰岛素按分组加入,每一种药物干预间隔30 min,24 h后去除培养液,提取各组细胞总RNA,RT-PCR法反转录为cDNA。Nrf2引物由生工生物工程有限公司合成。引物设计如下:上游5'-CAGCAGGACATGGATTTGAT-3',下游5'-GCCTTCTCCTGTTCCTTCTG-3'。于PCR反应管内加入,反应总体积为20μL,其中上游及下游引物各0.5μL,cDNA1.5μL,SYBR Premix TaqTMⅡ10μL。于PCR仪(BIO-RAD,Inc)上进行扩增。反应参数:94℃2 min预变性;94℃15 s,60℃1 min,50个循环。获取各组样本的标准曲线,计算机分析Ct值,以C组为基准,与C组的比值为各组样本Nrf2 mRNA的表达量。
1.2.5 Wes tern b l ot实验各组细胞的干预处理步骤同Real-time PCR实验。24 h后倒掉细胞培养液,从待测样本中提取蛋白质,使用Bradford法测定蛋白含量。各组取相同质量的蛋白,变性后在聚丙烯酰胺凝胶上样进行电泳,电泳完毕后,将蛋白转移到硝酸纤维膜上,5%脱脂奶粉封闭,先后加入Nrf2及内参GAPDH的一抗及辣根过氧化物酶标记的二抗孵育,化学发光法(ECL法)显色,X线片记录结果,扫描蛋白条带的密度并使用IPP软件分析目的条带灰度,以内参GAPDH灰度为基准,与GAPDH的比值即为各组样本Nrf2蛋白的表达量。
1.3 统计学方法
采用统计软件SPSS 12.0对数据进行分析,正态分布计量资料以均数±标准差()表示多组间比较采用方差分析,两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 AngⅡ和坎地沙坦对C2C12细胞摄取2-NBDG的影响
与C组比较,M组C2C12摄取2-NBDG水平显著下降(P<0.01),提示AngⅡ能降低C2C12细胞对胰岛素的敏感性;而给予坎地沙坦干预后,C2C12摄取2-NBDG水平升高,其中Can3组的2-NBDG摄取量较M组增加(P<0.05),提示高剂量坎地沙坦能改善AngⅡ对C2C12细胞摄取2-NBDG的抑制作用。见图1。

图1 AngⅡ和坎地沙坦对C2C12摄取2-NBDG的影响
2.2 AngⅡ和坎地沙坦对C2C12产生ROS的影响
与C组相比,M组C2C12内ROS含量显著升高(P<0.01)。而给予坎地沙坦干预后,ROS生成有下降趋势,其中Can3组的ROS含量显著低于模型组,差异有统计学意义(P<0.05),提示高剂量坎地沙坦能抑制AngⅡ诱导的ROS产生。见图2。

图2 AngⅡ和坎地沙坦对C2C12产生ROS的影响
2.3 AngⅡ和坎地沙坦对N rf2mRNA表达的影响
Real-time PCR结果显示,与C组比较,M组的Nrf2 mRNA的表达显著降低(P<0.01);与M组比较,坎地沙坦各组的Nrf2 mRNA表达均呈上升趋势。其中,Can2组及Can3组与M组的差异有统计学意义(P<0.05或P<0.01)。见图3。
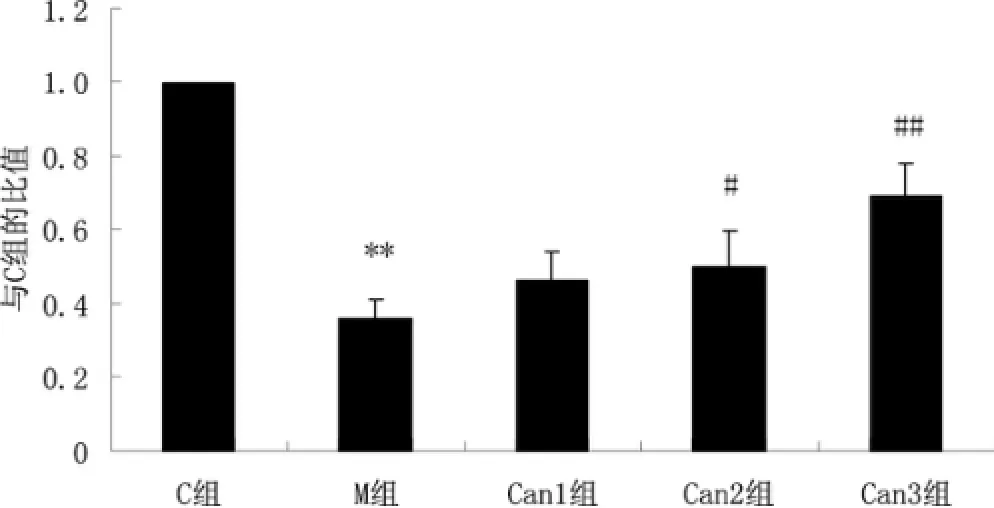
图3 AngⅡ和坎地沙坦对Nrf2m RNA表达的影响
2.4 AngⅡ和坎地沙坦对N rf2蛋白表达的影响
Western-blot实验结果显示,与C组比较,M组的Nrf2蛋白表达量显著降低(P<0.01);与M组比较,3个坎地沙坦组的Nrf2蛋白表达量有升高趋势。其中,Can2组及Can3组与M组的差异有统计学意义(P<0.05或P<0.01)。见图4~5。

图4 AngⅡ和坎地沙坦对Nrf2蛋白表达的影响

图5 AngⅡ和坎地沙坦对Nrf2蛋白表达的影响
3 讨论
近年来,随着对ROS族研究的深入,证实了大量ROS的产生是导致细胞氧化应激损伤的重要机制之一,而氧化应激损害在形成胰岛素抵抗的病理生理过程中起重要作用[6,7]。有研究表明,正常个体发生氧化应激时,细胞会通过活化抗氧化系统分子信号通道来增加抗氧化酶类的生成,以应对ROS生成的增加。而对于高血压的个体,细胞内抗氧化系统的分子信号反应能力下降,则只会加重ROS介导的胰岛素信号通路损害,加重IR[12]。本研究中,通过给予C2C12一定浓度的AngⅡ,观察到M组C2C12内ROS表达显著增加,而该组细胞的2-NBDG摄取显著下降,出现了IR。因此,本研究组认为高血压个体中肾素-血管紧张素系统过度激活提高了AngⅡ的水平,这在一定程度上影响了骨骼肌细胞内的氧化应激平衡,这与Xin等[8]研究结果一致,其原因可能与AngⅡ增加细胞内NAD(P)H氧化酶表达有关。
目前研究认为,Nrf2是细胞抗内源性氧化应激的重要中枢调节者,在细胞介导的抗氧化应激防御反应中具有重要的作用[13]。因此,高血压状态下细胞抗氧化能力下降,以及由此产生的胰岛素信号通路损害,很可能与Nrf2的功能异常有关。结合研究组之前的研究,本研究组认为高血压状态下AngⅡ的过度表达会造成ROS在骨骼肌的过度表达[9]。但是,ARB类药物改善糖代谢、降低骨骼肌胰岛素抵抗的效应是否与Nrf2在骨骼肌内表达的改变有关尚未见研究报道。
在正常情况下,内源性抗氧化物酶[如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)等]是防止氧化应激产生细胞损伤的第一道防线,这些内源性抗氧化物酶通过清除过量ROS来平衡机体内的氧化过程[10],而产生这一生物抗氧化应激反应的防御机制主要是通过抗氧化反应元件(antioxidant response element,ARE)。ARE是许多抗氧化基因上游中的顺式作用增强元件,而Nrf2正是通过介导ARE参与调节编码抗氧化蛋白而发挥作用[14]。在正常情况下,Nrf2与Kelch样环氧氯丙烷相关蛋白1(Keap1)偶联,并与肌动蛋白细胞骨架结合锚定于质;当受到ROS或其他亲核剂信号攻击后,Nrf2与Keapl解偶联后被激活转位进人细胞核中,与Maf蛋白结合成异二聚体,异二聚体与基因中的ARE结合后激活了Nrf2/ARE信号通路以及其下游的抗氧化蛋白,有效清除体内产生的自由基,发挥细胞保护作用[15]。因此,当细胞内Nrf2表达下调时,无法正常介导ARE的抗过氧化调控作用,使得细胞内ROS表达增加。
本研究表明,在AngⅡ存在的状况下,M组C2C12细胞内的Nrf2的表达受到抑制,ROS生成增加,胰岛素敏感性减低。给予坎地沙坦处理可以有效对抗这种抑制作用,显著增加Nrt2的表达,同时ROS的水平下降,IR得到改善。以上结果提示坎地沙坦通过对AngⅡ的抑制上调了Nrf2的表达,继而通过Nrf2/ARE途径发挥对抗氧化应激的作用,使细胞内ROS有所降低,减轻了ROS对胰岛素分子信号传导通路的影响,恢复和改善由于ROS过度增加而损害的PI3K、Akt等胰岛素信号传导分子的磷酸化功能,从而使胰岛素能发挥正常的促进细胞摄取葡萄糖的功能。
综合上所述,坎地沙坦对骨骼肌细胞胰岛素敏感性的保护机制部分来源于减少AngⅡ对Nrf2表达的抑制作用。但是Nrf/ARE的抗氧化机制比较复杂,还有待于进一步研究以得到更多的证据支持。
[1]Lastra G,Dhuper S,Johnson MS,et al.Salt,aldosterone,and insulin resistance:impact on the cardiovascular system[J]. Nat Rev Cardiol,2010,7(10):577-584.
[2]Ogihara T,Nakao K,Fukui T,et al.Candesartan antihypertensive survival evaluation in Japan trial group.Effects of candesartan compared with amlodipine in hypertensive patients with high cardiovascular risks:candesartan antihypertensive survival evaluation in Japan trial[J].Hypertension,2008,51(2):393-398.
[3]Julius S,WeberMA,Kjeldsen SE,etal.The valsartan antihypertensive long-term use evaluation(VALUE)trial: outcomes in patients receivingmonotherapy[J].Hypertension,2006,48(3):385-391.
[4]李凡,叶兰,孟剑湃,等.坎地沙坦对自发性高血压大鼠胰岛素敏感性及炎性因子的影响[J].贵阳医学院学报,2012,37(3):263-266.
[5]Zhou MS,Schulman IH,Raij L.Role ofangiotensinⅡand oxidative stress in vascular insulin resistance linked to hypertension[J].Am JPhysiol Heart Circ Physiol,2009,296 (3):H833-H839.
[6]Wei Y,Chen K,Whaley-Connell AT,et al.Skeletalmuscle insulin resistance:role of inflammatory cytokines and reactive oxygen species[J].Am JPhysiol,2008,294(3):R673-R680.
[7]Zhang J,Wu W,Li D,et al.Overactivation of NF-κB impairs insulin sensitivity and mediates palmitate-induced insulin resistance in C2C12 skeletalmuscle cells[J].Endocrine,2010,37(1):157-166.
[8]Xin Y,Niu T,Wang W,et al.Triterpenoid dihydro-CDDO-trifluoroethyl amide protects againstmaladaptive cardiac remodeling and dysfunction in mice:a critical role of Nrf2[J].PLoSOne,2012,7(9):e44899.
[9]Nguyen T,Nioi P,Picket CB.The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress[J].J Biol Chem,2009,284(20):13291-13295.
[10]HeH,Xu J,Xu Y,eta1.Cardioprotective effects of saponins from Panax japonicus on acute myocardial ischemia against oxidative stresstriggered damage and cardiac cell death in rats[J].J Ethnopharmacol,2012,140(1):73-82.
[11]Ogawa S,Matsushima M,Mori T,et al.Identification of the stages of diabetic nephropathy at which angiotensin Ⅱ receptor blockers most effectively suppress albuminuria[J]. Am J Hypertens,2013,26(9):1064-1069.
[12]Matsuda M,Shimomura I.Increased oxidative stress in obesity:implications for metabolic syndrome,diabetes,hypertension,dyslipidemia,atherosclerosis,and cancer[J]. Obes Res Clin Pract,2013,7(5):e330-e341.
[13]Olagnier D,Peri S,Steel C,etal.Cellular oxidative stress response controls the antiviral and apoptotic programs in dengue virus-infected dendritic cells[J].PloS Pathog,2014,10(12):e1004566.
[14]Wu Q,Zhang XS,Wang HD,et al.Astaxanthin activates nuclear factor erythroid-related factor 2 and the antioxidant responsive element(Nrf2-ARE)pathway in the brain after subarachonid hemorrhage in rats and attenuates early brain injury[J].MarDrugs,2014,12(12):6125-6141.
[15]Saso L,Firuzi O.Pharmacological applications of antioxidants:lights and shadows[J].Curr Drug Targets,2014,15(13):1177-1199.
Effects of Angiotensin Ⅱ and Candesartan on insulin sensitivity of mouse C2C12 myotubes
LI Fan XIE Jing YING Mingzhong ZENG Qiang▲
International Medical Center,Chinese PLA General Hospital,Beijing 100853,China
Objective To investigate the effects of Candesartan and Angiotensin Ⅱ (AngⅡ)on insulin sensitivity of mouse C2C12 myotubes,and discuss the possible mechanism.MethodsMature C2C12 myotubes were divided into 4 groups:control group(group C),model group(group M,AngⅡ0.1μmol/L),low dose Candesartan group(Can1 group, Candesartan 0.1μmol/L+AngⅡ0.1μmol/L),mild dose Candesartan group(Can2 group,Candesartan 1μmol/L+AngⅡ0.1μmol/L)and high dose Candesartan group(Can3 group,Candesartan 10μmol/L+AngⅡ0.1μmol/L).After the intervention of angiotensinⅡand insulin,the uptake of 2-deoxyglucose(2-NBDG)by C2C12 myotubes was measured in each group as well as the level of reactive oxygen species(ROS).The mRNA and protein expression of Nrf2 were measured by RT-PCR and Western blotting assay.ResultsCompared with the group C,the uptake of 2-NBDG in the group M was significantly decreased(P<0.01),the mRNA and protein expression of Nrf2 in group M was significantly decreased(P<0.01),at the same time,the level of ROS was increased significantly(P<0.01).Compared with group M,the uptake of 2-NBGD was increased obviously in Can3 group(P<0.05).The mRNA and protein expression of Nrf2 in group M were decreased than those in group C(P<0.01),the mRNA and protein expression of Nrf2 in the Can2 group and Can3 group were significantly increased than those in group M(P<0.01 or P<0.05).ConclusionAngiotensin Ⅱ can cause the insulin resistance of the skeletal muscle cells by reducing the mRNA and protein expression of Nrf2,controling Nrf2 oxidation effect,increasing ROS produce;Candesartan can improve skeletal muscle cells insulin resistance by reverse the effect of Ang Ⅱ on Nrf2 and improve the overload of ROS in the cells.
Candesartan;AngiotensionⅡ,Insulin resistance;Nrf2;Reactive oxygen species
R544.1
A
1673-7210(2015)03(a)-0014-05
2014-11-10本文编辑:苏畅)
北京市自然科学基金项目(编号7122171)。
▲通讯作者

