棉铃虫核型多角体病毒感染对宿主昆虫GST活性及其表达水平的影响
黄诗迪,黄彩萍,于 欢,王 敦
(西北农林科技大学 旱区作物逆境生物学国家重点实验室,陕西 杨凌712100)
棉铃虫核型多角体病毒感染对宿主昆虫GST活性及其表达水平的影响
黄诗迪,黄彩萍,于 欢,王 敦
(西北农林科技大学 旱区作物逆境生物学国家重点实验室,陕西 杨凌712100)
【目的】 研究棉铃虫核型多角体病毒(HearNPV)感染宿主昆虫后对宿主谷胱甘肽S-转移酶(GST)活性与基因表达水平的影响,明确病毒在侵染宿主过程中对宿主昆虫GST的调控作用。【方法】 采用50和100 PIB/只2种剂量的HearNPV病毒感染3龄棉铃虫,测定感染后不同时间试虫中肠GST活性与其编码基因的表达水平,对比分析病毒感染与未感染健康试虫的GST活性及其编码基因表达水平的差异。【结果】 棉铃虫在HearNPV感染初期,GST活性显著提高,同时GST表达水平显著上调;随着感染时间的推移,GST活性与其编码基因的表达水平均显著下降,表明病毒感染后对宿主昆虫GST活性的影响与其对GST表达水平的调控相关。【结论】 HearNPV感染棉铃虫过程中,病毒入侵能够激活宿主GST基因的表达,但病毒的持续感染最终会抑制GST编码基因的表达水平。
棉铃虫核型多角体病毒(HearNPV);谷胱甘肽S-转移酶(GST);GST基因;表达水平
棉铃虫核型多角体病毒(Helicoverpaarmigeranucleopolyhedrovirus,HearNPV)是重要农业害虫棉铃虫(Helicoverpaarmigera)的特异性病原微生物,具有专一、高效的防治效果。截至目前,国内已经获得HearNPV全基因组序列的毒株有C1和G4 2个分离株[1-2],在其功能基因组学和生物防治方面取得了显著的研究进展[3-10],并且HearNPV已经被成功地商业化,作为生物农药得到了广泛的应用[11]。但目前关于HearNPV对棉铃虫的侵染病理学的研究相对较少,见诸报道的只有2篇文献:张忠信等[12]于1998年报道了病毒感染对棉铃虫生长发育与生殖力的影响,之后于欢等[13]于2012年指出,HearNPV感染棉铃虫后能够下调碱性磷酸酶(ALP)的表达水平。
众所周知,病毒属于严格的细胞内寄生生物,不具备自身的能量、代谢、蛋白翻译与酶系统,昆虫病毒作为一类重要的生物杀虫剂,其在侵染宿主昆虫过程中也会参与宿主的生理、生化代谢。杆状病毒感染宿主昆虫过程中,除了上述对宿主昆虫生长发育、ALP活性产生影响外,尚不明确其是否还对宿主昆虫其他代谢途径和重要酶类存在影响。
谷胱甘肽S-转移酶(Glutathione S-transferase,GST)是生物体内重要的解毒酶系之一,广泛存在于动物、植物和微生物中,也是昆虫防御功能相关的重要水解酶。昆虫GST基因对农药代谢解毒和内源物质代谢具有重要作用,GST的变化是昆虫对农药产生抗药性的途径之一[14]。除ALP之外,HearNPV感染棉铃虫后是否对宿主中肠GST产生影响尚未见研究报道。为此,本研究通过GST活性的测定及相关基因表达的分析,研究病毒感染对宿主中肠GST的调控作用,旨在深入理解HearNPV对棉铃虫侵染的病理机制。
1 材料与方法
1.1 试虫与病毒
棉铃虫(H.armigera)1龄幼虫来源于中科白云生物技术有限公司(北京),于自然光照、23~25 ℃室温条件下人工饲料饲养。饲养至2龄幼虫蜕皮后,挑选大小均匀的试虫饥饿过夜,于第2天用于生物测定。
棉铃虫核型多角体病毒 C1株,由浙江大学张传溪教授馈赠,并由西北农林科技大学植物保护学院分子病毒学实验室扩繁保存。
1.2 病毒感染处理
将3龄健康试虫900只随机分为3组:1组为对照(CK),无病毒感染;其余2组均为病毒感染处理组,染毒量分别为50和100 PIB/只。每组300只,每个重复100只,共3个重复。试虫感染病毒约5 d后死亡率显著上升,因此本试验测定时间段选在4 d以内,以确保测定阶段多数试虫存活。对照和感染病毒组试虫在感染后6,12,24,48,72,96 h 时,分别随机取试虫40只,每10只为1个样本,用于测定GST活性(3个重复,共30只)和制备总RNA(1个重复,但后续RT-PCR测定3次)。
1.3 GST活性的测定
采用Booth等[15]的方法测定GST活性。将1.2节感染后不同时间选取的30头活虫随机分为3个重复(10只为1个重复),在冰盘上解剖出中肠(去掉围食膜)放入玻璃匀浆器中,加入一定量事先放入冰箱中预冷的内含10 mmol/L还原型谷胱甘肽的Tris-HCl缓冲液(pH8.9),在冰浴上充分匀浆后,4 ℃下10 000×g离心15 min,取上清液作为粗酶液。 准备2组干净的具塞试管,分别加入提取的酶液0.1 mL,再加入1.4 mL Tris-HCl缓冲液(0.1 mol/L pH8.9),在25 ℃下水浴10 min,立刻加入60 μL 30 mmol/L 2,4-二硝基氯苯,在紫外分光光度计上比色测定3 min内酶活性(OD340 nm)的变化量。测定3次取平均值,最后计算3个重复的平均值。
1.4 GST基因的RT-PCR分析
取1.2节感染后不同时间的10头活虫中肠,立即加液氮研磨,用Trizol试剂(购自TaKaRa公司)按照试剂盒说明书提取试虫总RNA。将总RNA溶于50 μL DEPC处理的双蒸水中,加DNaseⅠ(购自TaKaRa公司)消化除去基因组DNA,存于-80 ℃冰箱待用。用PrimeScriptTMRT reagent试剂盒(购自TaKaRa公司)制备cDNA(20 μL体系),依次加入6 μL RNase Free H2O、4 μL 5×PrimeScript Buffer、0.5 μL oligo dT引物、0.5 μL随机引物、10 μL RNA,最后加入1 μL逆转录酶,充分混匀后,37 ℃反应15 min,85 ℃处理5 s,制得cDNA,于-20 ℃冰箱保存。
参考GenBank中的GST序列(AY058242)设计qPCR引物GST2-F(5′-GTTTGGACTGGGTGGAGACAAT-3′)和GST2-R(5′-CCTCTGCAAGAGTTCTGGGTAA-3′);以GAPDH基因为内参,参考GenBank中已知的GAPDH序列( JF417983.1)设计qPCR引物GFAPDH-F(5′-AGAGGGTGGTGCTAAGAAGGTCA-3′)和GFAPDH-R(5′-CCAGAGGAGCGAGGCAGTTGGTT-3′);用SYBR Premix ExTaqⅡ(Perfect Real Time)(购自TaKaRa公司)试剂盒,按厂商提供的操作步骤进行RT-PCR。每个样本重复测定3次,结果取平均值。
1.5 数据分析
基因相对表达量的计算采用2-ΔΔCT法[16]。数据分析时,采用SPSS Statistics 17.0求均值、标准误,用LSD法进行多重比较。GST活性和表达量数据通过Graphpad Prism 5绘图。
2 结果与分析
2.1 棉铃虫感染HearNPV对GST活性的影响
由图1可见,棉铃虫感染其病原病毒HearNPV后,在50和100 PIB/只的感染剂量下,其中肠GST活性均呈先升高后下降的趋势。感染后6 h时,感染组和对照(非感染组)之间均无显著差异;直至感染后12 h时,被感染试虫的GST活性与对照相比均显著升高(P<0.05),但50和100 PIB/只感染剂量处理间并无显著差异;感染后24 h时,与对照相比,2种感染剂量被感染试虫的GST活性均极显著升高(P<0.01);在感染后48 h时,无论感染剂量高低,被感染试虫的GST活性与对照相比均无显著差异;至感染后72 h时,高低2种感染剂量出现不同的变化,低感染剂量组(50 PIB/只)试虫的GST活性与对照相比无显著差异,而高感染剂量组(100 PIB/只)试虫的GST活性与对照相比显著下降;感染96 h时,与对照相比高低2种感染剂量处理试虫的GST活性均极显著降低(P<0.01)。以上数据显示:棉铃虫在受其病原病毒感染后,感染初期其GST活性呈现升高趋势,但随感染时间的推移GST活性被显著抑制。

图1 感染HearNPV后不同时间棉铃虫GST活性的变化*表示差异显著(P<0. 05),**表示差异极显著(P<0.01), 以下同
2.2 棉铃虫感染HearNPV对GST表达水平的影响
由图2可见,HearNPV感染棉铃虫后6 h,在50 PIB/只的低感染剂量下,棉铃虫中肠GST表达水平与对照相比略有增高,但差异并不明显;而高剂量(100 PIB/只)感染后,GST表达水平与对照相比显著增高(P<0.05)。感染后12 h,无论感染剂量高低,病毒感染试虫的GST表达水平与对照相比均极显著增高(P<0.01)。持续到感染后24 h,高剂量感染组试虫的GST表达水平与对照相比显著增高(P<0.05),而低剂量感染试虫的GST表达水平与对照相比仍为极显著增高(P<0.01)。至感染后48 h,低剂量感染组试虫的GST表达水平与对照相比无显著差异,但高剂量感染组试虫的GST表达水平较对照显著降低(P<0.05)。持续感染72 h以后,无论感染剂量高低,病毒感染试虫的GST表达水平与对照相比均极显著降低(P<0.01)。以上数据说明,病毒感染能够调控宿主昆虫的GST表达水平,感染初期表现为上调作用,但随着病毒感染时间的推移,宿主昆虫的GST表达水平显著下调。
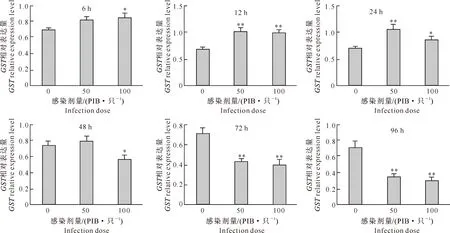
图2 感染HearNPV后不同时间棉铃虫GST基因相对表达量的变化
综合酶活性和基因表达水平的的变化来看,病毒感染宿主昆虫后,GST活性首先被激活,并呈现出显著升高趋势,伴随GST活性的升高,其编码基因的表达水平也呈上调趋势。随病毒感染时间的延长,GST活性最终显著降低,而GST基因转录水平也被显著抑制。无论病毒感染剂量高低,GST活性及其编码基因表达水平的变化趋势表现一致,即GST活性在病毒感染过程中先被激活后被抑制,其编码基因表达水平也具有相同的变化趋势。
3 结论与讨论
本研究中HearNPV病毒感染其宿主昆虫棉铃虫后,感染初期宿主昆虫中肠的GST活性显著升高,但从感染后48 h开始,GST活性被逐渐抑制直至极显著低于未感染的病毒对照。基因表达分析表明,病毒感染对GST编码基因表达水平的影响与其对GST活性的影响表现一致。谷胱甘肽S-转移酶(GST)是昆虫体内的一类与抗性有关的初级代谢及次级代谢酶系。谷胱甘肽(GSH)广泛分布于昆虫的各种细胞中,参与细胞运输、保护作用以及许多外源化合物有关的代谢,反应涉及的关键酶是GST。GST能使有害的亲电物质与内源的还原型谷胱甘肽 (GSH)结合,参与转运体内重要的脂类化合物,能为谷胱甘肽的S原子提供电子催化亲核反应。亲电性底物包括内源性物质 (如环氧化物、过氧化物、氧化代谢产生的有活性的直链烯类)及外源性物质 (如杀虫剂等有毒物质),在亲电物质与GSH结合后将其排出体外,保护体内的蛋白质和核酸等[17]。昆虫病毒作为其宿主的病原微生物,在侵染过程中会参与宿的主机体代谢、诱导宿主产生一些不利于病毒侵染与增殖的代谢产物,以增强宿主对病原微生物的抵御作用,削弱病毒的侵染能力,而这些物质同样也对宿主有害,这可能是病毒感染初期诱导GST基因表达量升高的原因之一[14],而后期宿主昆虫GST的下调作用则可能与病毒感染造成虫体衰弱、细胞代谢紊乱有关,这与于欢等[13]的研究结果类似。是否还有其他的调控机制,如何更深一步了解昆虫病原微生物与宿主昆虫的互作应答机制,都有待进一步深入研究。
[1] Chen X W,Ijkel W F J,Tarchini R,et al.The sequence of theHelicoverpaarmigerasingle nucleocapsid nucleopolyhedrovirus genome [J].Journal of General Virology,2001,82:241-257.
[2] Zhang C X,Ma X C,Guo Z J.Comparison of the complete genome sequence between C1 and G4 isolates of theHelicoverpaarmigerasingle nucleocapsid nucleopolyhedrovirus [J].Virology,2005,333:190-199.
[3] Dong C S,Li D,Long G,et al.Identification of functional domains required for HearNPV P10 filament formation [J].Virology,2005,338:112-120.
[4] Wang D,Zhang C X.HearSNPVorf83 encodes a late,nonstru-ctural protein with an active chitin-binding domain [J].Virus Research,2006,117:237-243.
[5] 王 敦,严兴成,Kumar S,等.棉铃虫核型多角体病毒ORF33基因的原核表达和在宿主细胞中亚细胞定位 [J].微生物学报,2006,46(1):60-62.
Wang D,Yan X C,Kumar S,et al.Bacterial expression and cellular localization ofHelicoverpaarmigeranucleopolyhedrovirus Orf33 in infected host cells [J].Acta Microbiologica Sinica,2006,46(1):60-62.(in English)
[6] Wang D,Zhang C X.Helicoverpaarmigeranucleopolyhedrovirusorf80 encodes a late,nonstructural protein [J].Journal of Biochemistry and Molecular Biology,2007,40(1):65-71.
[7] Deng F,Wang R R,Fang M G,et al.Proteomics analysis ofHelicoverpaarmigerasingle nucleocapsid nucleopolyhedrovirus identified two new occlusion-derived virus-associated proteins,HA44 and HA100 [J].Journal of Virology,2007,81(17):9377-9385.
[8] Pan X Y,Long G,Wang R R,et al.Deletion of aHelicoverpaarmigeranucleopolyhedrovirus gene encoding a virion structural protein (ORF107) increases the budded virion titre and reducesinvivoinfectivity [J].Journal of General Virology,2007,88:3307-3316.
[9] 李 坚,刘 强,王玉芹,等.棉铃虫核型多角体病毒orf86基因的原核表达、抗体制备与免疫印迹检测 [J].微生物学通报,2010,37(10):1447-1450.
Li J,Liu Q,Wang Y Q,et al.Prokaryotic expression,ereparation of polyclonal antibody and immunodetection of HearNPVorf86 [J].Microbiology China,2010,37(10):1447-1450.(in Chinese)
[10] 项林平,刘晓芸,田强强,等.棉铃虫核型多角体病毒几丁质酶的原核表达及其协同增效作用 [J].西北农林科技大学学报:自然科学版,2011,39(2):87-92.
Xiang L P,Liu X Y,Tian Q Q,et al.Expression of HearNPV chitinase gene inE.coliand its enhancement on HearNPV virulence [J].Journal of Northwest A&F University:Natural Science Edition,2011,39(2):87-92.(in Chinese)
[11] 秦启联,程清泉,郑建峰,等.科云牌棉铃虫核型多角体病毒生物农药的规模化生产和应用 [J].生物技术通报,2008(S1):467-470.
Qin Q L,Cheng Q Q,Zheng J F,et al.Production and application ofHelicoverpaarmigeranucleopolyhedrovirus bio-pesticides trademarked KEYUN on large scale [J].Biotechnology Bulletin,2008(S1):467-470.(in Chinese)
[12] 张忠信,孙修炼,张光裕.棉铃虫核型多角体病毒对宿主昆虫的弱化作用 [J].植物保护学报,1998,25(3):204-208.
Zhang Z X,Sun X L,Zhang G Y.The debilitation of HaNPV on cotton bollworm [J].Journal of Plant Protection,1998,25(3):204-208.(in Chinese)
[13] 于 欢,吕婷婷,李晓峰,等.HearNPV侵染对棉铃虫中肠碱性磷酸酶活性及表达水平的影响 [J].西北农林科技大学学报:自然科学版,2012,40(12):127-130.
Yu H,Lü T T,Li X F,et al.Effect of HearNPV infection on the enzyme activity and gene expression of alkaline phosphatase from midgut ofHelicoverpaarmigera[J].Journal of Northwest A&F University:Nat Sci Ed,2012,40(12):127-130.(in Chinese)
[14] 李亚红,余志涛,张学尧,等.昆虫谷胱甘肽S-转移酶农药解毒与内源代谢研究进展 [EB/OL].[2014-04-21].http://www.paper.edu.cn/releasepaper/content/201404-279.
Li Y H,Yu Z T,Zhang X Y,et al.The progess in the research of insect GST on insecticide detoxification and endogenous metabolism [EB/OL].[2014-04-21].http://www.paper.edu.cn/releasepaper/content/201404-279.(in Chinese)
[15] Booth G M,Connor J,Metcalf R A,et al.A comparative study of the effects of selective inhibitors on esterase isozymes from the mosquitoAnophelespunctipennis[J].Comp Biochem Physiol B,1973,44:1185-1195.
[16] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J].Methods,2001,25:402-408.
[17] 陈凤菊,高希武.昆虫谷胱甘肽S-转移酶的基因结构及其表达调控 [J].昆虫学报,2005,48(4):600-608.
Chen F J,Gao X W.Gene structure and expression regulation of glutathione S-transferase genes in insects [J].Acta Entomologica Sinica,2005,48(4):600-608.(in Chinese)
Effect ofHelicoverpaarmigeranucleopolyhedrovirus infection on GST activity andGSTexpression on host insect
HUANG Shi-di,HUANG Cai-ping,YU Huan,WANG Dun
(StateKeyLaboratoryofCropStressBiologyforAridAreas,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 The effect ofHelicoverpaarmigeranucleopolyhedrovirus (HearNPV) infection on enzyme activity and gene expression of Glutathione S-transferase (GST) of host insect was studied to understand the role of virus in regulating host GST after infection. 【Method】 The GST enzyme activity and gene expression of 3 years oldH.armigerainfected with virus at doses of 50 and 100 PIB per insect were determined at different times.Then the viral infection groups and control group were compared to reveal the differences in enzyme activity and gene expression of GST.【Result】 GST activity and its gene expression level were up-regulated significantly at the beginning of HearNPV infection.Over time,both were down-regulated,indicating that effect on GST activity by viral infection was related to its expression level.【Conclusion】 The viral invasion to host cell triggeredGSTexpression and increased enzyme activity at the beginning.ButGSTexpression was inhibited by persistent infection over time.
Helicoverpaarmigeranucleopolyhedrovirus (HearNPV);GST;GSTgene;expression level
时间:2015-10-13 08:46
10.13207/j.cnki.jnwafu.2015.11.019
2014-03-24
国家自然科学基金项目(31270691,31170609)
黄诗迪(1987-),女,河北廊坊人,在读硕士,主要从事昆虫病毒分子生物学研究。E-mail:huangshidi2008@163.com
王 敦(1973-),男,青海西宁人,教授,博士,主要从事昆虫生化与分子生物学、昆虫病毒分子生物学与生物防治研究。E-mail:wanghande@nwsuaf.edu.cn
S476.13
A
1671-9387(2015)11-0129-05
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151013.0846.038.html

