肾积水后缺氧诱导因子-1、血管内皮生长因子、微小RNA-210的动态表达*
刘亚明,邓 君,匡仁锐,崔苏萍
(南昌大学第一附属医院泌尿外科 330006)
论著·基础研究
肾积水后缺氧诱导因子-1、血管内皮生长因子、微小RNA-210的动态表达*
刘亚明,邓 君,匡仁锐,崔苏萍△
(南昌大学第一附属医院泌尿外科 330006)
目的观察小鼠肾积水后缺氧诱导因子-1(HIF-1)、血管内皮生长因子(VEGF)、微小RNA(miRNA)-210在不同时间点的表达变化并探讨其调控机制。方法采用丝线结扎单侧输尿管的方法制备急性完全性单侧肾积水模型(UUO模型),分为假手术对照组和单侧肾积水组,于单侧肾积水后2、5、9、14 d分别颈椎脱臼处死。采用实时荧光定量PCR检测肾积水后患肾各时间点HIF-1 mRNA 、VEGF mRNA及miRNA-210的表达变化,采用Western blot方法检测肾积水后各时间点HIF-1蛋白的表达变化。结果HIF-1 mRNA表达水平在肾积水后表达量逐渐上调(P<0.05)。VEGF mRNA及miRNA-210表达水平在肾积水后2 d升高并达到高峰,于UUO后5、9、14 d表达量逐渐下调(P<0.05)。HIF-1蛋白表达量逐渐上调。结论肾积水后HIF-1 mRNA及蛋白表达逐步上调,VEGF mRNA及miRNA-210表达一过性上调,可能与肾积水后肾皮质被压迫机体对缺氧、缺血产生适应性反应有关。
缺氧诱导因子-1;血管内皮生长因子;微小RNA-210;单侧肾积水
微小RNA(miRNA)是在真核生物中发现的一类内源性的具有调控功能的非编码RNA,其能抑制或降低靶基因mRNA的翻译或使其表达量下调[1]。miRNA-210是一种具有缺氧诱导活性的miRNA,在缺氧条件下表达可上调[2]。缺氧诱导因子-1(HIF-1)是一随着细胞内氧浓度的变化而调节靶基因表达的转录激活因子[3]。血管内皮生长因子(VEGF)具有强烈的促进血管内皮细胞分裂、增殖以及诱导血管新生的作用。其是内皮细胞增生、存活因子,它通过内皮细胞的特殊受体促进血管新生,并在此过程中扮演着重要角色,是当前认为最为重要的促血管生成因子[4]。本研究旨在观察小鼠肾积水后miRNA-210及其下游基因HIF-1、VEGF的表达变化,探讨其在肾积水后血管新生中的调控作用,现将研究结果报道如下。
1 材料与方法
1.1 材料 健康BALB/C系雄性小鼠25只,体质量(23±2)g,由南昌大学医学院动物科学部提供。在动物实验室按同一标准适应性饲养1周后,分为假手术(Sham)组、单侧肾积水(UUO)2、5、9、14 d组,每组分别5只。
1.2 方法
1.2.1 单侧肾积水模型制备 用4%水合氯醛以1 mL/100 mg腹腔注射麻醉后,行腹中线切口,找到左肾肾蒂,沿肾蒂向下移行找到左侧输尿管,在输尿管上1/3处两次结扎并剪断输尿管,以防逆行性感染,操作完毕后逐层缝合[5]。分别饲养2、5、9、14 d后颈椎脱臼处死,取其左肾做进一步分析。所有个体按相同操作完成。(1)UUO 2、5、9、14 d组行左侧输尿管结扎术后继续饲养2、5、9、14 d;(2)Sham组不结扎左侧输尿管,其余平行操作。
1.2.2 实时荧光定量PCR(RT-PCR)法检测miRNA-210的表达变化 采用 mirVanaTMmiRNA Isolation Kit试剂盒提取实验组肾组织miRNA,参照说明书将miRNA-210逆转录后行RT-PCR[SYBR®Premix Ex TaqTM(Tli RNaseH Plus)]检测miRNA-210的表达变化。miRNA-210逆转录所采用试剂盒为 PrimeScriptTMRT reagent Kit,TaKaRa。检测系统为:StepOneTMSoftware v2.0,内参为U6。反应条件:95 ℃,30 s;95 ℃,5 s;60 ℃,30 s;40个循环。Sham组肾组织为对照,△△CT=[Ct(实验组)-Ct(实验组U6)]-[Ct(对照组)-Ct(对照组U6)],用2-△△CT值表示基因的相对表达量。
1.2.3 RT-PCR检测HIF-1、VEGF mRNA的表达变化 用Trizol法提取肾脏标本总RNA。用紫外分光光度计检测RNA纯度,取OD260/OD280为1.8~2.0的总RNA样本进行逆转录,逆转录步骤按照试剂盒说明书操作,所用试剂盒为:PrimeScriptTMRT reagent Kit,TaKaRa。所得结果为CDNA。参照说明书,逆转录后行RT-PCR[所用试剂为:SYBR®Premix Ex TaqTM(Tli RNaseH Plus)]检测HIF-1mRNA、VEGFmRNA的表达变化。检测系统为:StepOneTMSoftware v2.0,内参为GAPDH。反应条件:95 ℃,30 s;95 ℃,5 s,60 ℃,30 s;40个循环。假手术组肾组织为对照组 ,△△CT=[Ct(实验组)-Ct(实验组GADPH)]-[Ct(对照组)-Ct(对照组GAPDH)],用2-△△CT值表示基因的相对表达量。VEGF mRNA上游引物:5′-GAA GCT CAT CTC TCC TAT GTG CTG GC-3′;下游引物:5′- CCT GGT GGA CAT CTT CCA GGA GTA CC-3′;HIF-1 mRNA上游引物:5′- AGC CTG ATG CTC TCA CTC TGC -3′;下游引物:5′-TGT GTC ATC GCT GCC AAA A-3′; GAPDH mRNA上游引物:5′-GGC ATG GAC TGT GGT CAT GAG -3′;下游引物:5′-TGC ACC ACC ACC TGC TTA GC-3′。以上引物均有广州锐博生物科技有限公司合成。
1.2.4 Western blot检测HIF-1在蛋白水平上的表达变化 取出各组的肾组织,质量约为100 mg,用组织电动匀浆器在冰浴中研磨成浆,加入组织蛋白裂解液1 mL,组织蛋白酶抑制剂1 μL,冰浴20 min,4 ℃下12 000×g离心20 min,用BCA蛋白浓度检测试剂盒检测各组蛋白浓度并将各组蛋白浓度调节一致,按照1∶5的比例将蛋白样品与蛋白上样缓冲液混匀并于100 ℃水浴煮沸5 min。各样本均取50 μg总蛋白经10%十二烷基-聚丙烯酰氨凝胶电泳(SDS-PAGE)后转移至PVDF膜上,5%脱脂奶粉封闭后,用HIF-1特异性一抗(1∶300稀释的小鼠抗小鼠 HIF-1抗体)孵育,4 ℃过夜。二抗(辣根过氧化物酶标记的山羊抗小鼠IgG 1∶5 000)室温孵育1 h后加入 ECL显色底物,暗室曝光,最后通过QuantityOne软件进行图像分析,并按得出的数据进行统计学分析。
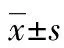
2 结 果
2.1 RT-PCR检测HIF-1 mRNA、VEGF mRNA、miRNA-210的表达变化 HIF-1 mRNA在UUO 2、5、9、14 d组表达逐渐上调,分别为Sham组的(2.16±0.23)、(2.69±0.24)、(3.10±0.52)、(4.22±0.44)倍,与Sham组比较,差异均有统计学意义(P<0.05),见图1;VEGF mRNA在UUO后2、5 d组均表达上调,分别约为Sham组的(2.20±0.19)、(1.13±0.06)倍,在UUO 9、14 d组均表达下调,分别为Sham组的(0.35±0.05)、(0.17±0.02)倍,与Sham组,差异均有统计学意义(P<0.05),见图2;miRNA-210在UUO 2、5 d组均表达上调,分别为Sham组的(4.81±0.55)、(1.81±0.10)倍,在UUO 9、14 d组均表达下调,分别为Sham组的(0.88±0.05)、(0.23±0.01)倍,与Sham组比较,差异均有统计学意义(P<0.05),见图3。
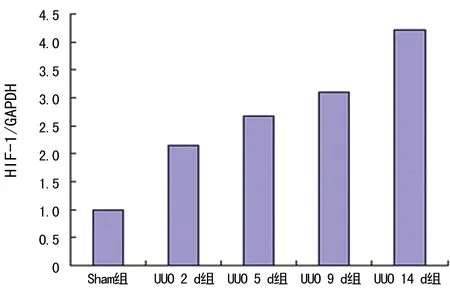
图1 肾积水后HIF-1 mRNA在各时间段的表达变化

图2 肾积水后VEGF在各时间段的表达变化

图3 肾积水后microRNA-210在各时间段的表达变化
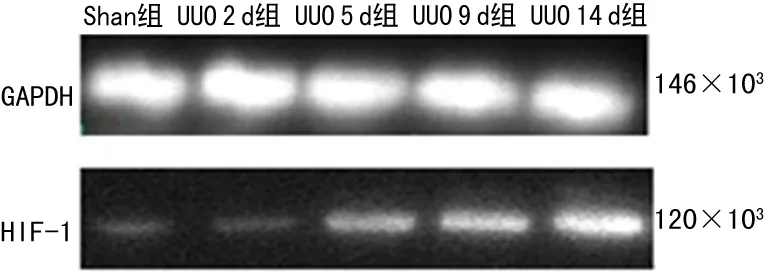
图4 肾积水后HIF-1蛋白在各时间段的表达变化
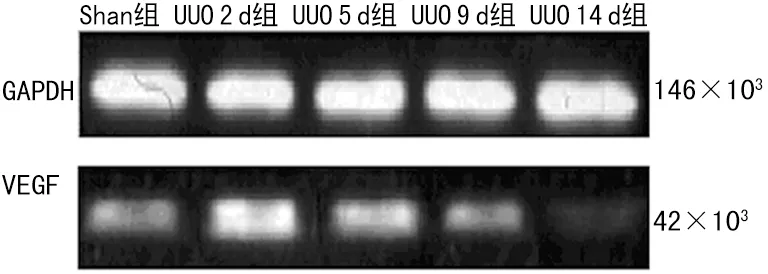
图5 肾积水后VEGF蛋白在各时间段的表达变化
2.2 Western-blot检测HIF-1、VEGF蛋白的表达变化 HIF-1蛋白条带在UUO 2、5、9、14 d组较Sham组蛋白条带逐步加深;VEGF蛋白条带在UUO 2 d组蛋白条带最深,随着UUO时间的延长蛋白条带逐渐变浅,见图4、5。
3 讨 论
肾积水是由于尿路梗阻而引起的肾盂肾盏扩张并伴有肾组织的萎缩,如果引起肾积水的因素不能得到解除,囤积在肾盂及盂盏内的尿液就会越来越多,并压迫肾脏皮髓质,引起皮髓质内血液循环压力增大使得肾内血流量速度减慢甚至停止,从而引起肾组织缺血缺氧[6]。因此尽快解除引起肾积水的因素,对于肾功能的保护起着极为重要的作用。在肾脏积水后肾组织中HIF-1的表达会随着时间的延长而逐渐上调[6],上述观点在肾缺血再灌注模型中同样得到证实[7]。
miRNA-210是一种具有缺氧诱导活性的miRNA,通过下调靶基因Ephrin-A3的表达而影响下游基因发挥生物作用[8]。在缺氧的情况下通过Akt-p53通路使miRNA-210表达上调[9]。Kelly等[10]发现,在常氧条件下脯氨酸羟化酶在甘油-3磷酸脱氢酶-1(GPD1L)作用下使HIF-1蛋白中的两个脯氨酸羟化,而引起HIF-1蛋白的降解,而miRNA-210可以抑制GPD1L,使脯氨酸羟化酶不能发挥作用而引起HIF-1不被降解而上调。
VEGF是一种促内皮细胞生成血管因子,可由肾小球内皮细胞和肾小球脏层细胞生成,能促进内皮细胞迁移、增生、增强内皮细胞通透性及血管生成维持[11]。研究表明,在缺氧情况下miRNA-210能促进内皮细胞的敏感性。并能促进体外培养的脐静脉内皮细胞的血管新生[12-13]。
本研究结果显示,在小鼠UUO模型中,肾组织的HIF-1表达水平在UUO后表达量逐渐上调,VEGF表达变化趋势与miRNA-210的变化趋势呈现一过性上调。那么为什么HIF-1α与miRNA-210、VEGF的表达不一致,笔者推测可能产生HIF-1α的细胞与产生miRNA-210、VEGF的细胞有区别,二者对缺氧耐受力不同,产生HIF-1α的细胞可以很好地耐受缺氧,并能不断产生HIF-1α,而产生miRNA-210和VEGF的细胞也具有缺氧耐受力,但仅在一定范围内随缺氧程度增加而产生增多,超过一定阈值会因为细胞或组织耐受力下降而产生下降,而出现一过性升高的情况。另外出现这种情况也有可能是因为HIF-1α降解速度较慢,虽然随时间延长HIF-1α累积量增多,但净产生量却随时间延长而减少,而miRNA-210和VEGF由于不稳定或衰减速率较快,产生降解速率减慢而表现出下调。
这与Fasanaro等[13]及Chang等[14]的报道相一致,进一步证实了miRNA-210调控VEGF并促进血管新生。本实验初步阐明了UUO后miRNA-210、HIF-1、VEGF的表达变化趋势,通过小鼠急性UUO模型观察三者的关系,不难看出具有缺氧诱导活性的miRNA-210在血管新生方面发挥着举足轻重的作用,其具体调控机制仍有待于进一步研究。
[1]Zhang B,Stellwag EJ,Pan X.Large-scale genome analysis reveals unique features of microRNAs[J].Gene,2009,443(1/2):100-109.
[2]Zaccagnini G,Maimone B,Di Stefano V,et al.Hypoxia-induced miR-210 modulates tissue response to acute peripheral ischemia[J].Antioxid Redox Signal,2013,21(8):1177-1188.
[3]Ziello JE,Jovin IS,Huang Y.Hypoxia-inducible factor (HIF)-1 regulatory pathway and its potential for therapeutic intervention in malignancy and ischemia[J].Yale J Biol Med,2007,80(2):51-60.
[4]Byungsoo K,Jun C.VEGF expression in hypoxia and hyperglycemia:reciprocal effect on branching angiogenesis in epithelial-endothelial co-cultures[J].J Am Soc Nephrol,2002,13(8):2027-2036.
[5]Nath KA.Tubulointerstitial changes as a major determinant in the progression of renal damage[J].Am J Kidney Dis,1992,20(1):1-17.
[6]Stravodimos KG,Koritsiadis G,Lazaris AC,et al.Hydronephrosis promotes expression of hypoxia-inducible factor 1 alpha[J].Urol Int,2009,82(1):38-42.
[7]李贺,汪泱,刘芬,等.肾缺血再灌注损伤后缺氧诱导因子-1α及其靶基因miR-210、血管内皮生长因子的动态表达[J].中华实验外科杂志,2011,28(12):2074-2076.
[8]邓君,崔苏萍,阮琼芳,等.肾缺血再灌注损伤后miR-210及其靶基因的变化[J].中华实验外科杂志,2009,26(11):1512-1514.
[9]Mutharasan RK,Nagpal V,Ichikawa Y,et al.microRNA-210 is upregulated in hypoxic cardiomyocytes through Akt- and p53-dependent pathways and exerts cytoprotective effects[J].Am J Physiol Heart Circ Physiol,2011,301(4):H1519-1530.
[10]Kelly TJ,Souza AL,Clish CB,et al.A hypoxia-induced positive feedback loop promotes hypoxia-inducible factor 1α stability through miR-210 suppression of glycerol-3-phosphate dehydrogenase 1-like[J].Mol Cell Biol,2012,32(4):2696-2706.
[11]Ushio-Fukai M,Nakamura Y.Reactive oxygen species and angiogenesis:NADPH oxidase as target for cancar therapy[J].Cancer Lett,2008,266(1):37-52.
[12]Lou Y,Gao F,Xie A,et al.MicroRNA-210 modified human umbilical vein endothelial cells induce capillary formation[J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2012,26(5):587-591.
[13]Fasanaro P,D′Alessandra Y,Di Stefano V,et al.MicroRNA-210 modulates endothelial cell response to hypoxia and inhibits the receptor tyrosine kinase ligand ephrin-A3[J].J Biol Chem,2008,283(23):15878-15883.
[14]Chang W,Lee CY,Park JH,et al.Survival of hypoxic human mesenchymal stem cells is enhanced by a positive feedback loop involving miR-210 and hypoxia-inducible factor 1[J].J Vet Sci,2013,14(1):69-76.
Dynamic changes of the expression of HIF-1,VEGF and miRNA-210 in the kidney after unilateral ureteral occlusion*
LiuYaming,DengJun,KuangRenrui,CuiSuping△
(DepartmentofUrology,theFirstAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330006,China)
Objective To observe the expression of inducible factor 1(HIF-1),vascular endothelial growth factor(VEGF) and miRNA-210 and explore the regulatory mechanism after unilateral ureteral occlusion (UUO).MethodsUUO models are made by ligation unilateral ureteral with silk,and they were divided into sham group and UUO group.All the mice were sacrificed by cervical dislocation after 2,5,9 and 14 d of UUO.The kidney samples were examined for HIF-1 mRNA,VEGF mRNA and miRNA-210 by quantitative real time reverse transcription polymerase chain reaction (RT-PCR),and HIF-1 protein by Western blot.ResultsThe expression level of HIF-1 mRNA was gradually raised after UUO (P<0.05),and compared with the sham group,the expression level of VEGF mRNA and miRNA-210 were up regulated after 2 d of UUO and down regulated after 5,9 and 14 d of UUO compared with the sham group (P<0.05);the expression level of HIF-1 protein increased after UUO compared to the sham group.ConclusionThe results of the level of HIF-1 protein increased and VEGF mRNA and miRNA-210 were up regulated,which might be related to the adaptive response of kidney hypoxia and ischemia after UUO.
hypoxia inducible factor 1;vascular endothelial growth factor;micro RNA 210;unilateral ureteral occlusion
10.3969/j.issn.1671-8348.2015.30.007
江西省科技厅支撑计划(20111BBG70025-1);江西省自然科学基金(2010GZY0314)。
:刘亚明(1988-),硕士,住院医师,主要从事腔镜泌尿外科工作。△
,Tel:18970862506;E-mail:yfycsp@sina.com。
R692.2
A
1671-8348(2015)30-4196-03
2015-03-02
2015-05-16)

