体液调控神经元在调控秀丽线虫固有免疫中的研究进展
马安然
(东南大学医学院临床医学系,南京210009)
体液调控神经元在调控秀丽线虫固有免疫中的研究进展
马安然
(东南大学医学院临床医学系,南京210009)
秀丽隐杆线虫在受到病原菌感染时,会迅速激活固有免疫。神经免疫间的交流可以通过神经系统释放神经递质、神经肽及激素来调控固有免疫反应,包括已知的多巴胺信号通路、TGF-β信号通路和胰岛素信号通路。近年来的研究表明,NPR-1神经环路也参与固有免疫的调控,并且三个体液调控神经元AQR、PQR和URX是通过NPR-1神经环路调节固有免疫的。线虫的神经系统只有302个神经元,结构也相对简单,线虫的npr-1基因可编码与哺乳动物神经肽Y(neuropeptide Y,NPY)具有受体相似的GPCR,这些优势为研究高等生物神经免疫间交流的分子机制提供了基础。本文就体液调控神经元在调控秀丽线虫固有免疫方面展开讨论,希望可以为高等生物神经免疫间的调节机制提供重要的思路和方法。
秀丽隐杆线虫;神经免疫交流;NPR-1神经环路;体液调控神经元
秀丽隐杆线虫(Caenorhabditis elegans)是一类生活在温度恒定的土壤中,以细菌为食的线虫类生物[1]。其个体小,长度约1mm,通体透明,可用Ca2+成像技术检测神经元的活化[2]。1963年,Brenner[3]提出了将线虫作为模式生物用于动物神经发育的研究,线虫是第一个完成基因组全序列测定的多细胞生物,可提供构建整个动物所用的全部遗传信息。截至2012年,线虫体内所有神经元之间的实触连接和神经通路网络模式都已绘制完成[4-5],这更加有利于研究神经环路对行为和有机体生命活动的调节,当然也包括固有免疫。此外,线虫的神经系统相对简单、基因操作方便、生长周期短(在实验室20°C的情况下,繁殖一代平均要3.5d[1]),是用于研究动物感觉和行为的常用模式动物。线虫能感受外界环境的变化,在应对病原菌感染时,可诱导固有免疫包括分泌抗菌肽、溶菌酶、凝集素等。
1 体液调控神经元在固有免疫中的功能
1.1 体液调控神经元
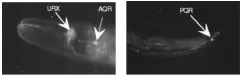
图1 体液调控神经元(gcy-32::gfp)AQR、URX位于头部,PQR位于尾部Fig.1 Body fluid neurons(gcy-32::gfp),AQR、URX located at head, PQR at tail
体液调控神经元包括AQR、PQR和URX。线虫呈蠕虫状、两侧对称、无分节,有四条主要的表皮索状组织及一个充满体液的假体腔[6],而AQR、PQR、URX是除了CEP之外直接暴露于体腔液中的神经元,因此被称为体液调控神经元[7]。AQR和PQR的感觉纤毛末端直接暴露于体腔液中,而URX没有纤毛结构的末端于是伸入头部最前端[8],如图1所示。
1.2 体液调控神经元主要感受高氧环境
线虫的神经系统共有302个神经元[3],每个神经元都有其特点,基于电镜三位重建的结果显示,按照神经元的形态、神经连接及位置将线虫302个神经元分为118类,每一类中神经元的数目为1~13[9-11]。
线虫神经元按其功能可分为三类,分别为感觉神经元、中间神经元和运动神经元。感觉神经元的感器可以分为两类,一类具有向外开口的通道,这类通道使部分神经结构直接暴露在外界化学环境中,另一类则没有通道结构。前者主要是化学感受器,后者主要是机械感受器及其他一些未知功能的感受器[12]。
本文主要叙述感受氧浓度的化学感受器。土壤中存在不间断的大肠杆菌代谢活动,导致土壤局部气体浓度变动,线虫要在土壤中生存就必须要感受环境中的气体浓度,如O2和CO2的变化。实验证明线虫对中氧气浓度(5%~12%)有极强的偏好性,而对过高或过低的氧浓度都表现出躲避效应[13]。作为需氧生物,线虫需要氧气来维持生存,同时也要躲避高氧对DNA和其他大分子的氧化损伤。最主要感受正常水平氧浓度的神经元是AQR、PQR、URX和BAG。
AQR、PQR和URX主要感受高氧环境,BAG则主要感受周围的低氧环境。遗传学和钙成像的实验表明,线虫对高氧的感受需要可溶性鸟苷酸环化酶GCY-35的参与,对低氧的感受需要GCY-31和GCY-33的参与[14]。升高氧气浓度在BAG中激发一个钙上升,而降低氧气浓度则在AQR中激发一个钙上升[15-16]。氧气调节线虫的聚集行为,并形成社会性进食行为,聚集在一起的社会性进食行为可被氧气浓度降低所抑制,URX、AQR和PQR在形成社会性进食中起到关键作用,并很可能是氧气调节社会性进食的关键神经元[17-18]。
2 NPR-1在调控线虫固有免疫中的作用
2.1 NPR-1神经环路
自然条件下,NPR-1仅有2个等位基因在215位点上的氨基酸有所不同,分别是NPR-1(215V)和NPR-1(215F)。N2线虫基因是NPR-1(215V),而npr-1突变体(ad609)的是NPR-1(215F),NPR-1 (215V)的活性比NPR-1(215F)强得多[19]。
因为体液调控神经元的活性要GCY-35、TAX-2和TAX-4的参与,因此NPR-1可以通过抑制GCY-35、TAX-2和TAX-4的活性来抑制AQR、PQR和URX。当线虫为NPR-1(215F)时,对AQR、PQR和URX的抑制作用降低,也就促进了线虫对高氧的躲避。而高氧是npr-1突变体形成聚集行为最重要的因素,为了躲避高氧损伤,npr-1突变体聚集在PA14菌落的边缘,因为那里是细菌浓度最高、氧浓度最低的地方,也因此增加了对PA14的易感性,从而抑制了固有免疫[19],如图2所示。
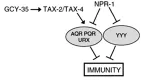
图2 调控秀丽线虫固有免疫的NPR-1神经环路模式图Fig.2 NPR-1 nerves circuit model of regulating of innate immunity in Caenorhabditis Elegans
2.2 NPR-1对线虫固有免疫的调控
当有食物时,线虫可以分散进食也可以社会性进食,这是由NPR-1神经环路所调控的。NPR-1(215F)和NPR-1功能丧失型线虫会产生聚集行为,成群聚集在细菌菌苔的边缘,而含有NPR-1(215V)的N2线虫没有这样的行为,但对PA14具有菌落逃逸行为[17]。如图3所示。

图3 NPR-1功能丧失型线虫增加对PA14的易感性Fig.3 NPR-1 function-loss type elegans promotes munity to PA14
Styer和Reddy两个研究组的研究发现,npr-1突变体(ad609)线虫比N2线虫对PA14的易感性增加[18-19]。为了检测N2线虫和npr-1突变体线虫(ad609)的运动行为差异是否会影响他们对PA14的易感性,两个研究组都利用了满菌落分析方法。即将PA14涂满整个板子,这样做是为了限制了npr-1突变体线虫(ad609)成群地聚集在细菌菌落的边缘和N2线虫菌落逃逸行为,然后检测这两种株系线虫对PA14的易感性。Reddy等[19]发现npr-1突变体(ad609)线虫与N2线虫相比,对PA14的易感性无明显差别,Styer等[18]研究发现N2线虫在PA14满菌落上的死亡率明显高于在培养基中央涂一块PA14,而npr-1突变体线虫(ad609)并没什么差别。这说明N2线虫的菌落逃逸行为是造成易感性差异的原因。但同时,他利用满菌落发现npr-1突变体线虫(ad609)比N2线虫易受PA14感染,综合以上结果他认为,运动行为的差异只是导致易感性差别的一个原因而不是全部原因。Styer等[18]还发现NPR-1调节多种固有免疫基因的表达,因此他认为NPR-1不仅可以调节线虫的运动行为,也可以直接调节线虫的固有免疫来调控它对致病菌的易感性。但同时,Reddy等[19]发现npr-1突变体在PA14感染后的24h,肠道内的积累情况比N2线虫要严重得多,但在涂满PA14的测试条件下没有区别。因此他认为npr-1突变体(ad609)线虫和N2线虫对致病菌易感性的差异是依赖其行为差异的。为了进一步研究NPR-1是否参与调控固有免疫的靶点基因及其信号通路,Capra等[20]做了全基因组微阵列分析。结果表明,npr-1突变以后差别表达的基因大部分是参与固有免疫调控的,并且被DAF-16、DBL-1和PMK-1/p38 MAPK信号通路所调控。Aballay等[21]发现PMK-1通路相关基因在npr-1突变体(ad609)线虫中的活性远低于N2线虫,全基因组微阵列分析证明了npr-1调控秀丽线虫的固有免疫相关基因,并且不依赖于致病菌的逃逸行为。
NPR-1至少表达在20多种神经元中,包括鸟苷
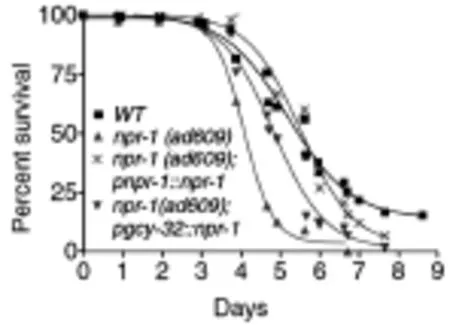
图4 插入gcy-32启动子后npr-1突变体线虫(ad609)对PA14的易感性降低Fig.4munity of npr-1 mutant elegans to PA14 decline after inserted the gcy-32 promoter
酸环化酶GCY-35表达的神经元AQR、PQR和 URX,为了证明AQR、PQR和URX参与了NPR-1神经环路对固有免疫的调控,Styer等[18]用egl-1表达在gcy-36启动子(特异性表达在AQR、PQR和URX)杀死AQR、PQR和URX神经元感染PA14后,易感性明显降低。推测AQR、PQR和URX神经元是可以抑制秀丽线虫固有免疫反应的。此外,他还用gcy-32这个启动子的特异性启动npr-1在AQR、PQR和URX的表达,结果发现,插入了gcy-32启动子的线虫对PA14的易感性降低了,如图4所示。综合以上结果,说明AQR、PQR和URX是通过npr-1神经环路调节固有免疫的。
Tiewen Liu等[14]利用激光切除的方式切除URX后,线虫的寿命从13.3±0.4d下降到10.4±0.4d,和对照组相比,URX切除的线虫表型和繁殖行为没有明显改变,因此这种寿命的减少并不是由于缺陷。进一步研究GCY-35和GCY-36这两种可以介导URX感受高氧环境的鸟苷酸环化酶,发现GCY-35和GCY-36突变体线虫的寿命显著降低。将GCY-35和GCY-36的cDNA分别置于两者的启动子下发现突变体的表型得到恢复。
遗传学研究表明NPR-1对神经元AQR、PQR和URX活性的抑制要有可溶性的鸟苷酸环化酶GCY-35、TAX-2和TAX-4的共同参与,TAX-2和TAX-4蛋白是cGMP门控离子通道的2个亚基[21]。研究者还发现这三个神经元的活性能选择性地被一种钾离子通道EGL-2功能增强型突变体所抑制,这种突变体也能抑制线虫的聚集行为。因此推测这些神经元的作用是依赖于cGMP门控离子通道的[18]。
2.3 讨论
笔者认为,NPR-1至少能从2种机制抑制固有免疫。NPR-1可以通过调控线虫的行为来调节它对致病菌的易感性,也能直接调节线虫的固有免疫反应。这些发现为研究高等生物神经免疫间的分子交流机制提供了基础。哺乳动物的NPY可通过交感神经系统来调节免疫反应[22],虽然线虫缺乏编码NPY的基因,但线虫的基因组可编码多种作为NPR-1配体的神经肽,推测这些神经肽有一些与NPY相似的功能。实际上,FMRF酰胺相关神经肽FLP-18和FLP-21在调节氧传感中就是NPR-1的内源性配体[23]。因此,相关神经肽在固有免疫中的作用有待于进一步研究。
3 展望
虽然已有研究表明,线虫神经免疫间的相互作用主要依赖于胰岛素信号通路、多巴胺信号通路、TGF-β信号通路和NPR-1神经环路,但这些信号通路的研究仍需深入。例如,npr-1基因具体是如何抑制三个体液调控神经元的,AQR、PQR和URX三个神经元分别对固有免疫有什么作用,低氧诱导因子(HIF-1)是否能与GCYs以相似的通路共同调节线虫的固有免疫,等等。Chen D等[24]研究发现,激活HIF-1能延长线虫的寿命,Mehta R等[25]利用HIF-1功能增强型RNAi(去除egl-9,egl-9编码一种使HIF-1降解的酶)使线虫的寿命延长了,利用这种HIF-1功能增强型RNAi能缓解GCY突变体的表型,如图5所示。相信随着线虫神经免疫间相互作用的研究不断深入,最终将为人类高等生物神经免疫间的调节机制提供重要的思路和方法。

图5 HIF-1功能增强型RNAi能缓解GCY突变体的表型Fig.5HIF-1 function enhanced RNAi can relieve the phenotype of GCY mutant
[1]Kurz C L,Tan M W.Regulation of aging and innate immunity in C.elegans[J]. Agingcell,2004,3(4):185-193.
[2]Dittman J.Worm watching:imaging nervous system structure and function in Caenorhabditis elegans[J].Advances in genetics,2009,(65):39-78.
[3]Kosinski R A,Zaremba M.Dynamics of the model of the caenorhabditis elegans neural network[J].ACTAPHYSICAPOLONICASERIESB,2007,38(6):2201.
[4]J.G.White E S J N.The Structure of the Nervous System of the Nematode Caenorhabditis elegans(The Mind of a Worm[J].Phil.Trans.R.Soc.Lond.B, 1986,31(4):1-340.
[5]Jabr F.The Connectome Debate:Is Mapping the Mind of a Worm Worth It?[J]. 2014,(08):95.
[6]Alberts B,Johnson A,Lewis J,et al.Molecular Biology of the Cell(5th ed.)[M]. Garland Science,2007:1321.
[7]Juliet C.Coates M D B.Antagonistic pathways in neurons exposed to body fluid regulate social feeding in Caenorhabditis elegans[J].letters to nature,2002,41(9): 925-929.
[8]李照玉.感觉信号调节线虫进食的神经回路及短期饥饿调节线虫脂肪代谢的研究[D].武汉:华中科技大学,2011.
[9]Chen B L,Hall D H,Chklovskii D B.Wiring optimization can relate neuronal structure and function[J].Proc Natl Acad Sci USA,2006,103(12):4723-4728.
[10]Perez-Escudero A,de Polavieja G G.Optimally wired subnetwork determines neuroanatomy of Caenorhabditis elegans[J].Proc Natl Acad Sci U S A,2007,104 (43):17180-17185.
[11]Russellall DH H A.The Posterior Nervous System of the Nematode Caenorhabditis elegans:Serial Reconstruction of Identified Neurons and Complete Pattern of Synaptic Interactions[J].The Journal of Neuroscience,1991,11(1):1-22.
[12]Bargmann CI.Chemosensation in C.elegans[J].Worm Book:The online Review ofC.elegans Biology[Internet].Pasadena(CA):Worm Book;2005-.,2006:1-26.
[13]White J Q,Nicholas TJ,Gritton J,et al.The SensoryCircuitryfor sexual attraction in C.elegans Males[J].Current Biology,2007,17(21):1847-1857.
[14]Tiewen Liu,Dongsheng Cai.Counterbalance between BAG and URX neurons via guanylate cyclases controls lifespan homeostasis in C.elegans.The EMBO Journal 2013(32):1529-1542
[15]Biron D,Wasserman S,Thomas J H,et al.An olfactory neuron responds stochastically to temperature and modulates Caenorhabditis elegans thermotactic behavior[J].Proc Natl Acad Sci USA,2008,105(31):11002-11007.
[16]Bretscher A J,Kodama-Namba E,Busch K E,et al.Temperature,oxygen,and salt-sensing neurons in C.elegans are carbon dioxide sensors that control avoidance behavior[J].Neuron,2011,69(6):1099-1113.
[17]Juliet C.Coates MD B.Antagonistic pathways in neurons exposed to body fluid regulate social feedingin Caenorhabditis elegans[J].letters tonature,2002,(419): 925-929.
[18]Styer K L,Singh V,MacoskoE,et al.Innate immunity in Caenorhabditis elegans is regulated by neurons expressing NPR-1/GPCR[J].Science,2008,322(5900): 460-464.
[19]Reddy K C,Andersen E C,Kruglyak L,et al.A polymorphism in npr-1 is a behavioral determinant of pathogen susceptibility in C.elegans[J].Science, 2009,323(5912):382-384.
[20]Capra E J,Skrovanek S M,Kruglyak L.Comparative developmental expression profiling of two C.elegans isolates[J].Plo Sone,2008,3(12):4055.
[21]Aballay A.Neural regulation of immunity:role of NPR-1 in pathogen avoidance and regulation of innate immunity[J].Cell Cycle,2009,8(7):966-969.
[22]Rogers C,Reale V,Kim K,et al.Inhibition of Caenorhabditis elegans social feeding by FMRFamide-related peptide activation of NPR-1[J].Nature neuroscience,2003,6(11):1178-1185.
[23]Elenkov I J,Wilder R L,Chrousos G P,et al.The sympathetic nerve-an integrative interface between two supersystems:the brain and the immune system[J].Pharmacological reviews,2000,52(4):595-638.
[24]Thomas E L,Kapahi P.HIF-1 modulates dietary restriction-mediated lifespan extension via IRE-1 in Caenorhabditis elegans[J].2009,(09):201-202.
[25]Mehta R,Steinkraus K A,Sutphin G L,et al.Proteasomal regulation of the hypoxic response modulates aging in C.elegans[J].Science,2009,324(5931): 1196-1198.
Research progress of body fluid neurons in the regulation of innate immunity in Caenorhabditis Elegans
MAAn-Ran
(Department ofclinical medicine,School of medicine,Southeast university,Nanjing210000,China)
Caenorhabditis elegans would rapidly activate innate immunity once being infected with pathogens.Neuro-immune interactions which are through the nervous system to release such as neurotransmitters,neuropeptides and hormones to regulate the innate immune response.Those pathways include known dopamine signaling pathway,TGF-β signaling pathway and insulin signaling pathways.Recent studies show that NPR-1 neural circuits are also involved in the regulation of innate immunity and three neurons AQR,PQR and URX exposed to body fluid are under the regulation of NPR-1 neural circuits.Elegans nervous system has only 302 neurons and the structure is relatively simple and the npr-1 gene of elegans can encode GPCR which is similar to the mammalian neuropeptide Y(neuropeptideY,NPY)receptor,providing an edge for studying higher organisms on neuro-immune interactions.Research progress in relation tothe field has been reviewed in present paper.
Caenorhabditis elegans;neuro-immune interactions;NPR-1 neural circuit;neurons exposed to body fluid
Q291
A
1674-8646(2015)09-0008-04
2015-07-15
东南大学基于教师科研的SRTP项目(项目编号:T15412007)
马安然(1994-),女,江苏南京人,主要从事临床医学研究。

