环带小薄孔菌发酵液的化学成分研究
合力强,杨晓艳,冯 涛,李正辉,董泽军,刘吉开*
1中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室,昆明 650201;2中国科学院大学,北京 100049;3 昆明理工大学,昆明 650500
环带小薄孔菌(Antrodiella zonata),属于平革菌科(Phanerochaetaceae)薄孔菌属(Antrodiella)的一种木栖寄生高等真菌,覆瓦状叠生,菌盖具同心环带,菌肉革质,厚可达4 mm。在我国主要分布在安徽、重庆、福建、广东、广西、贵州、河南、湖北、湖南、四川、云南、浙江等地的阔叶林区,通常生长在阔叶树的活立木、死树和倒木上,作药用具有抗细菌和抗肿瘤等功效[1]。该菌曾经被命名为鲑贝革盖菌(Coriolus consors),后由戴玉成等菌物学家根据新近的研究成果和最新命名法规进行订正,将其修正为环带小薄孔菌(Antrodiella zonata)[2]。据文献[3]报道,早在1969 年就从该菌发酵液中分离得到具有抗菌活性的革盖菌素(coriolin),为了进一步研究其次生代谢产物,找寻更好的活性化合物,我们对该菌发酵液进行了系统的化学成分研究,从其乙酸乙酯萃取浸膏中分离得到8 个化合物,其中化合物1 为新化合物。
1 仪器与材料
比旋光度值由Horbia SEPA-300 旋光仪测定;IR 由Bruker Tensor27 型红外光谱仪测定(KBr 压片);ESI-MS 由Xevo TQ-S 质谱仪和Bruker HCT/Esquire 质谱仪测定;高分辨质谱HR ESI-MS 由Agilent G6230 TOF 质谱仪测定;1H NMR 和13C NMR 由Bruker AV-600 和Ascend 600 测定,内标为TMS;柱层析硅胶(80~100 目和200~300 目)和薄层层析材料均为青岛海洋化工厂生产;制备型MPLC 为Büchi 公司产品,由Büchi fraction collector C-660、Büchi pump module C-605 和Büchi manager C-615 组成(Büchi Labortechnik AG,Flawil,Switzerland),分析型和制备型HPLC 为Agilent 1100 HPLC,色谱柱为Agilent Zorbax SB-C18(4.6 mm ×150 mm,5 μm)和YMC(9.4 mm ×150 mm,5 μm)柱;Sephadex LH-20为Amersham Biosciences 公司产品;RP-18(40~63 μm)为德国Merck 公司产品。显色方法为254、365 nm 荧光,10%硫酸乙醇溶液和硫酸香草醛处理后加热及碘蒸气显色。
环带小薄孔菌(Antrodiella zonata)于2012 年9月采自广东省始兴县车八岭保护区,由北京林业大学戴玉成教授鉴定。
2 培养与发酵
由昆明植物研究所李正辉工程师采用斜面转摇瓶液体培养的方法对该菌种进行发酵培养。培养基:葡萄糖5%,猪肉蛋白胨0.15%,酵母粉0.5%,KH2PO4和MgSO4各0.05%,150 rpm,24 ℃暗培养25 d,发酵液总量为20 L。
3 提取与分离
环带小薄孔菌发酵液(20 L)滤除菌丝体后浓缩至1 L,用乙酸乙酯萃取三次,合并提取液蒸干得浸膏5.6 g。用制备型MPLC 进行粗分,甲醇-水(0%→100%)梯度洗脱得到A~F 组分。组分B(甲醇-水20%)先上凝胶Sephadex LH-20(甲醇)柱,再经制备型HPLC,用乙腈-水(5%~20%)梯度洗脱,纯化得到化合物6(11.0 mg)、7(8.5 mg)。组分D(甲醇-水60%)经正相硅胶柱层析,用甲醇-氯仿溶剂系统(50 ∶1 →10 ∶1)梯度洗脱,后用制备型HPLC (乙腈-水15%~40%)分离,再经凝胶Sephadex LH-20(丙酮)纯化得化合物1(1.8 mg)、2(6.0 mg)、3(3.5 mg)、8(15.0 mg)。组分E(甲醇-水80%)先上凝胶Sephadex LH-20(甲醇-氯仿1∶1)柱层析,再经正相柱色谱(石油醚-丙酮10∶1)等度洗脱,最后再次利用凝胶Sephadex LH-20(甲醇-氯仿1∶1)纯化,得化合物4(5.0 mg)、5(7.0 mg)。
4 结构鉴定
化合物1 的分子式由其HR-ESI-MS m/z 281.1732[M +Na]+(calcd for C14H26O4Na,281.1729)确定为C14H26O4,不饱和度为2。其红外在3445 cm-1和1634 cm-1处的吸收峰暗示该化合物含有羟基和羰基。从其13C NMR(DEPT)谱中可以看出含有一个CO,两个连氧CH,一个连氧CH2,五个CH2、三个CH3和两个季碳。羰基占了1 个不饱和度,由于碳谱显示不含双键,推测另一不饱和度只能是成环。分子含4 个氧,其中之一为羰基,另外3 个推测为羟基。
根据其1H-1H COSY 信号:H-12 (δH3.50,2H,t,J=6.0 Hz)与H-11 (δH1.45,2H,m)相关,H-11(δH1.45,2H,m)与H-10b (δH1.17,1H,m)相关可确定C-10、C-11、C-12 相连,且C-12 连有羟基;H-6(δH3.44,1H,ddd,J=11.7,4.8,3.0 Hz)与H-5(δH3.90,1H,m)、H-7a (δH1.67,1H,m)、H-7b (δH1.52,1H,m)相关且H-5 (δH3.90,1H,m)与H-6(δH3.44,1H,ddd,J=11.7,4.8,3.0 Hz)、H-4a(δH2.56,1H,ddd,J=14.5,3.6,3.6 Hz)、H-4b(δH1.69,1H,m)相关可确定C-4、C-5、C-6、C-7 相连,且C-5、C-6 各连有一个羟基。再根据其HMBC信号:H-1 (δH2.24,3H,s)与C-2 (δC215.8,s)、C-3(δC56.1,s)相关表明羰基在2 位;H-4b (δH1.69,1H,m)、H-5 (δH3.90,1H,m)与C-3 (δC56.1,s)相关,表明C-3 与C-4 相连;H-4b (δH1.69,1H,m)与C-9 (δC38.7,s)相关表明C-9 只能与C-3 相连;H-8a(δH2.21,1H,m)与C-3 (δC56.1,s)、C-7 (δC26.8,t)相关表明C-3、C-7、C-8 相连;H-10b (δH1.17,1H,m)、H-13 (δH0.88,3H,s)、H-14 (δH0.91,3H,s)与C-9 (δC38.7,s)相关表明C-9 与C-10、C-13、C-14 相连,由此化合物1 确定为薄孔菌素(因为同属的其他种还有可能含有类似结构的化合物,所以根据该种真菌的属名来命名化合物1,称其为薄孔菌素;英文则采用antrodiellone,属名去掉尾字母a 加上酮的后缀one)。再根据其ROSEY 信号,如图1 所示,可判断该化合物的相对构型为环上两个羟基与甲基酮位于同侧。
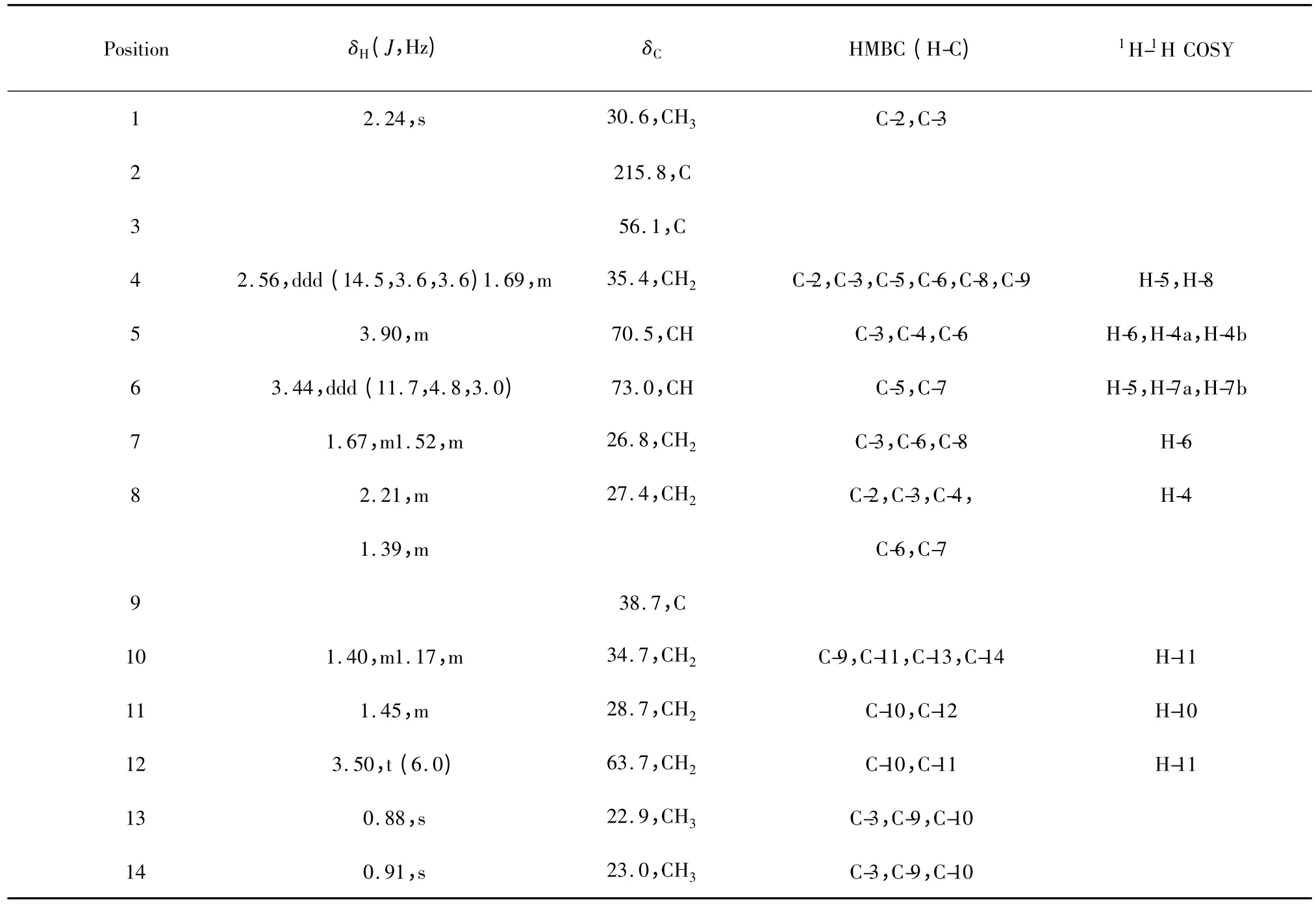
表1 化合物1 的1D 和2D NMR 数据(600/150 MHz,CD3OD)Table 1 1D and 2D NMR data of 1 at 600/150 MHz,respectively,in CD3OD
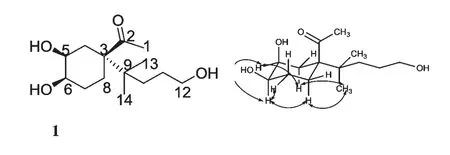
图1 化合物1 的结构和ROESY 相关Fig.1 Chemical structure and ROESY correlations of 1
化合物1 经旋光仪测得旋光值为-3.52,怀疑该化合物为外消旋体,于是分别采用普通正相柱和手性柱进行HPLC 分析,分析测试条件如下,色谱柱型号:1、普通柱SunFire Prep Silica(4.6 mm ×150 mm,5 μm);2、手性柱CHIRALPAK AD-H(4.6 mm×250 mm,5 μm),流速:1 mL/min,流动相:异丙醇-正己烷(20∶80)等度洗脱,检测波长:254 nm。
结果如图2 所示,图2(A)为普通正相柱分析结果,仅出现一个峰,相同条件下手性柱分析(图2B)却出现两个峰,表明该化合物为外消旋体,但由于量少无法拆分,只能通过ROSEY 来确定其相对构型(图2 峰保留时间较短是由于普通柱柱长较手性柱短所造成)。
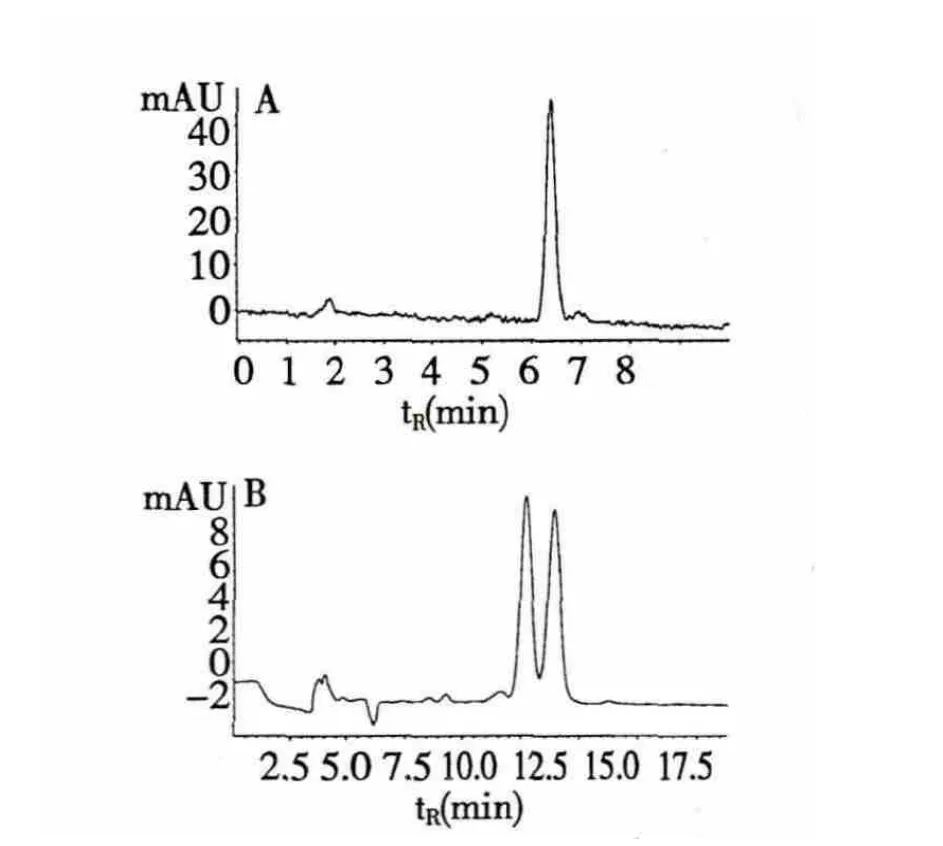
图2 化合物1 普通正相柱(A)与手性柱(B)分析的HPLC 色谱图Fig.2 HPLC chromatograms of compound 1 under normal phase column (A)and chiral column (B)
化合物2 C29H46O3;白色粉末;ESI-MS (positive)m/z 465 [M+Na]+;1H NMR (CDCl3,600 MHz)δ:5.22 (1H,dd,J=15.2,7.2 Hz,H-23),5.18 (1H,dd,J=15.3,7.7 Hz,H-22),4.16 (1H,d,J=2.6 Hz,H-7),3.93 (1H,m,H-3),3.41(3H,s,OCH3),3.20 (1H,d,J=3.1 Hz,H-6),1.21-~2.51 (20H,m,甾体母核),1.02 (3H,d,J=6.7 Hz,H-21),0.92 (3H,d,J=6.8 Hz,H-28),0.87 (3H,s,H-18),0.86 (3H,s,H-19),0.84 (3H,d,J=6.7 Hz,H-26),0.82 (3H,d,J=6.8 Hz,H-27);13C NMR (CDCl3,150 MHz)δ:153.3 (s,C-14),135.3 (d,C-22),132.1 (d,C-23),122.5 (s,C-8),72.6 (d,C-7),68.8 (d,C-3),65.2 (s,C-5),58.5 (d,C-6),56.7 (d,C-17),54.5 (q,OCH3),42.8 (d,C-24),40.2 (d,C-9),39.6 (t,C-4),39.3(d,C-20),36.5 (t,C-12),35.9 (s,C-10),33.1 (d,C-25),32.1 (t,C-1),31.2 (t,C-2),27.2 (t,C-16),24.9 (t,C-15),21.2 (q,C-21),20.0 (q,C-26),19.7 (q,C-27),19.2 (t,C-11),18.2 (q,C-18),17.6 (q,C-28),16.5 (q,C-19)。上述数据与文献[4]报道一致,确定该化合物为22E-7α-methoxy-5α,6α-epoxyergosta-8(14),22-dien-3β-ol。
化合物3 C29H48O3;无色针晶;ESI-MS (positive)m/z467 [M+Na]+;1H NMR (CD3OD,600 MHz)δ:5.40 (1H,m,H-7),5.24 (1H,dd,J=15.2,7.0 Hz,H-23),5.20 (1H,dd,J=15.2,7.5 Hz,H-22),3.96 (1H,m,H-3),3.37 (3H,s,OCH3),3.15 (1H,d,J=4.8 Hz,H-6),1.29-2.12(22H,m,甾体母核),1.05 (3H,d,J=6.7 Hz,H-21),0.98 (3H,s,H-19),0.95 (3H,d,J=6.8 Hz,H-28),0.87 (3H,d,J=6.8 Hz,H-27),0.85 (3H,d,J=6.8 Hz,H-26),0.62 (3H,s,H-18);13C NMR(CD3OD,150 MHz)δ:144.5 (s,C-8),137.0 (d,C-22),133.2 (d,C-23),116.0 (d,C-7),83.9 (d,C-6),77.0 (s,C-5),68.3 (d,C-3),58.2 (q,OCH3),57.4 (d,C-17),56.1 (d,C-14),44.7 (s,C-13),44.4 (d,C-9),43.8 (d,C-24),41.8 (d,C-20),40.7 (t,C-12),40.6 (t,C-4),38.3 (s,C-10),34.4(d,C-25),33.7 (t,C-1),31.7 (t,C-2),29.2 (t,C-16),24.0 (t,C-15),23.0 (t,C-11),21.7 (q,C-27),20.5 (q,C-26),20.1 (q,C-21),18.8 (q,C-19),18.2 (q,C-28),12.7 (q,C-18)。上述数据与文献[5]报道一致,确定该化合物为3β,5α-dihydroxy-6β-methoxyergosta-7,22-diene。
化合物4 C11H10BrNO2;白色针晶;ESI-MS(negative)m/z 188[M-Br]-;1H NMR (CD3OD,600 MHz)δ:8.06 (1H,d,J=7.3 Hz,H-4),7.95 (1H,s,H-2),7.44 (1H,d,J=1.2 Hz,H-7),7.19 (1H,dd,J=7.3,1.2 Hz,H-5),4.36 (2H,q,CH2),1.42(3H,t,CH3);13C NMR (CD3OD,150 MHz)δ:167.6(s,C-8),138.2 (s,C-7a),133.2 (d,C-2),127.3(s,C-3a),123.7 (s,C-6),22.5 (d,C-5),121.9(d,C-4),113.0 (d,C-7),108.5 (s,C-3),60.8 (t,CH2),14.9 (q,CH3)。上述数据与文献[6,7]报道一致,确定该化合物为6-bromo-1H-indole-3-carboxylic acid ethyl ester。
化合物5 C9H6BrNO2;黄色固体;ESI-MS(negative)m/z 160 [M-Br]-;1H NMR (CD3OD,600 MHz)δ:8.06 (1H,d,J=7.3 Hz,H-4),7.95 (1H,S,H-2),7.44 (1H,d,J=1.2 Hz,H-7),7.19 (1H,dd,J=7.3,1.2Hz,H-5)。上述数据与文献[8]报道一致,确定该化合物为6-bromo-1H-indole-3-carboxylic acid。
化合物6 C8H10O2;淡黄色针晶;1H NMR(CD3OD,600 MHz)δ:7.03 (2H,d,J=8.1 Hz,H-2,6),6.70 (2H,d,J=8.1 Hz,H-3,5),3.68 (2H,t,J=7.3 Hz,H-8),2.71 (2H,t,J=7.3 Hz,H-7)。上述数据与文献[9]报道一致,确定该化合物为对羟基苯乙醇。
化合物7 C7H8O3;黄色油状物;ESI-MS (positive)m/z 141 [M+H]+;1H NMR (CD3OD,600 MHz)δ:9.53 (1H,s,CHO),7.40 (1H,d,J=3.5 Hz,H-3),6.60 (1H,d,J=3.5 Hz,H-4),3.67(2H,t,H-7),2.58 (2H,t,H-6);13C NMR (CD3OD,150 MHz)δ:179.5 (d,CHO),175.0 (s,C-5),163.2 (s,C-2),124.9 (d,C-3),110.9 (d,C-4),57.6 (t,C-7),30.1 (t,C-6)。上述数据与文献[10]报道一致,确定该化合物为5-羟乙基糠醛。
化合物8 C11H20N2O2;无色针晶;1H NMR(CD3OD,600 MHz)δ:3.95 (1H,m,H-3),3.78(1H,m,H-6),2.23 (1H,m,H-7),2.06 (1H,m,H-11),1.75 (1H,m,H-10a),1.61 (1H,m,H-10b),1.05 (3H,d,J=7.1 Hz,H-8),0.95-0.98 (9H,m,H-9,12,13);13C NMR (CD3OD,150 MHz)δ:171.3(s,C-2),169.7 (s,C-5),61.5 (d,C-6),54.4 (d,C-3),46.0 (t,C-10),33.7 (d,C-7),25.3 (d,C-11),23.6 (q,C-13),21.8 (q,C-12),19.3 (q,C-8),17.8 (q,C-9)。上述数据与文献[11]报道一致,确定该化合物为环-(亮-缬)二肽。
1 Dai YC (戴玉成),BAU Tolgor (图力古尔),Cui BK (崔宝凯),et al.Illustrations of Medicinal Fungi in China (中国药用真菌图志).Harbin:Northeast Forestry University Press,2013.48-49.
2 Dai YC (戴玉成),Yang ZL (杨祝良).A revised checklist of medicinal fungi in China.Mycosystema (菌物学报),2008,27:801-824.
3 Takeuchi T,Iinuma H,Iwanaga J,et al.Coriolin,A new basidiomycetes antibiotic.J Antibiot,1969,22:215-217.
4 Gao H,Hong K,Chen GD,et al.New oxidized sterols from aspergillus awamori and the endo-boat conformation adopted by the cyclohexene oxide system.Magn Reson Chem,2010,48:38-43.
5 Kwon HC,Zee SD,Cho SY,et al.Cytotoxic ergosterols from Paecilomyces sp.J300.Arch Pharm Res,2002,25:851-855.
6 Ibrahim SR,Mohamed GA,Fouad MA,et al.Iotrochotamides I and II:new ceramides from the Indonesia sponge Iotrochota purpurea.Nat Prod Res,2009,23:86-92.
7 Wang RP,Lin HW,Li LZ,et al.Monoindole alkaloids from a marine sponge Mycale fibrexilis.Biochem Syst Ecol,2012,43:210-213.
8 Li L,Deng Z,Fu H,et al.Chemical constituents from the marine sponge Iotrochoto birotulata.Pharm,2003,58:680-681.
9 Li J (李军),Zhang SX (张淑霞),Guo HQ (郭华强),et al.Extraction and determination of hydroxy phenylethanol compound in Syringa oblata Lindl Bark.Chemistry and Adhesion (化学与粘合),2008,30:37-39.
10 Gordon JC,Silks LA,Sutton AD,et al.Collias,D.I.Compounds and methods for the production of long chain hydrocarbons from biological sources.WO2013040311A1,2013.
11 Gao H (高昊),Tang JS (唐金山),Hong K (洪葵),et al.Cyclic dipeptides and nucleosides of mangrove fungus Aspergillus awamori.Chin Tradit Herb Drugs(中草药),2008,39:502-504.

