焦磷酸抑制聚T模板CuNPs合成的非标记荧光探针用于碱性磷酸酯酶活性的测定
来倩倩
(浙江省碳材料温州大学化学与材料工程学院碳材料技术研究重点实验室,浙江 温州 325027)
碱性磷酸酯酶(ALP)是一种广泛分布在人体各个组织中的蛋白酶[1]。它作为一种常用的生物标记物在酶免疫测定、基因分析、组织化学的染色等方面被应用于检测蛋白质、药物、核酸和其它分析物。由于ALP酶去磷酸化的底物分布比较广泛,所以对于不同的去磷酸化底物,ALP酶表现出来的作用不同。临床上,人体血清中ALP酶含量的多少与很多疾病有关,比如骨骼、肝胆系统的疾病等[2-5]。此外,ALP酶与其他一些酶是同源的,并表现出一部分同样的催化性能[6]。因此,采用自然底物代替人工合成的显色底物对ALP酶的活性进行测定,也许能够更加快速直接地研究出ALP酶的相关功能[7]。然而,大量的天然底物中只有少量的含磷酸基团的底物被认可并充当ALP的底物,焦磷酸(PPi)就是这些被确认的底物中的一种。有报道[8-9]指出PPi充当ALP酶底物时,所需的最适pH值比较低,水解速度也比较慢。由于焦磷酸(PPi)能够抑制骨骼的矿化,所以,在机体组织中ALP酶可以催化PPi水解,进而使骨组织中的PPi的浓度维持在一个特定的范围内,确保骨骼正常的矿化[10]。PPi同样也可以抑制血管的钙化,可以通过ALP酶对PPi的催化水解来调节并预防血管的过度钙化[11]。因此,PPi作为ALP酶的天然底物,对ALP酶的分析检测具有重要的影响意义。
传统的用来评估ALP酶催化PPi水解能力的方法主要是依据对水解所得磷酸根(Pi)的比色分析或者是对PPi中的磷(P)进行放射性标记以充当检测所需的信号标记[12-13]。这些方法大多操作起来比较复杂,而且有的方法还需要标记,获得的信号的灵敏度还比较低。因此,目前急需发展一些简单快速、灵敏度高、选择性好的非标记的光学检测方法用来研究ALP酶对底物PPi的水解作用。但是这些已有的报道[14]主要是通过溶液中电解质的共轭作用产生的,溶液中带电荷的物质对其的干扰比较大,得到的信号也比较弱。
近年来,纳米技术发展飞速,采用纳米材料作为分子探针对生物分子进行定量和定性的分析越来越引起研究者们的关注。随着聚T链可以作为合成荧光铜纳米颗粒的模板这一文献的报道[15],这种新型的材料可以用来作为荧光指示探针,应用于生物传感器中。本文中基于焦磷酸(PPi)对以聚T链为模板的荧光铜纳米颗粒的形成具有很强的抑制作用,发展了一种非标记的荧光增强的方法,用于碱性磷酸酯酶活性的检测。相比其他传统的检测ALP酶活性的方法,该方法不仅直接在均相溶液中就可进行,而且该方法选择性好,所需时间短,成本低廉,灵敏度高。其检测下限达到0.5U·L-1。
1 实验原理
本章中报道了一种利用聚T链模板合成的荧光CuNPs作为信号转换的指标协助焦磷酸(PPi)对CuNPs合成的抑制作用,发展了一种非标记的光学检测方法用于ALP酶活性的检测。如图1所示,该方法旨在利用焦磷酸与二价铜离子之间很强的络合作用来抑制单链DNA与二价铜离子的相互作用,进而不能够合成铜纳米颗粒,导致荧光信号降低。但当ALP酶存在的条件下,ALP酶可以使PPi水解,进而PPi就不能与二价铜离子发生络合作用。在聚T模板链的存在下,二价铜离子被抗坏血酸还原,形成具有荧光的铜纳米颗粒,进而荧光恢复,并且荧光的恢复程度和ALP酶的浓度密切相关。

图1 碱性磷酸酯酶活性荧光检测方法的原理
2 实验部分
2.1 聚T链和PPi对Cu2+竞争反应
Cu2+不仅能够与聚T链模板合成CuNPs,而且还可以与焦磷酸发生络合反应形成络合物,所以我们要首先研究哪种作用力比较强。在10mM Tris-HCl(pH 7.4,100mM NaCl)的缓冲溶液中加入40μL的Cu2+和不同浓度的焦磷酸(PPi)于37℃下水浴50min。然后,加入事先制备好的含有40μL抗坏血酸钠和1μM的聚T模板链的混合溶液。避光反应10min后,进行荧光测定。
2.2 测定ALP酶的活性
在 10mM Tris-HCl(pH 7.4,100mM NaCl)的缓冲溶液中加入40μL的Cu2+、固定浓度的焦磷酸(PPi)和不同浓度的ALP酶,37℃下水浴50min。再加入事先制备好的含有40μL抗坏血酸钠和1μM的聚T模板链的混合溶液。避光反应10min后,进行荧光测定。
2.3 荧光光谱检测
本章实验中的光谱测量均在Fluoro Max-4荧光光谱仪上测定,采用最大容量为400μL的比色皿盛放待测液,激发波长为350nm,发射峰的扫描范围从540nm到680nm。通过荧光光谱仪测定得到的结果,均是从大于3次的重复实验中获得。
3 结果与讨论
3.1 实验的可行性分析
图2是不同反应条件下的荧光光谱图。由图2可知,当体系中焦磷酸和磷酸根离子都不存在时,在350nm的激发波长下,可以观测到在625nm处有一个很强的荧光吸收峰。当加入500μM的磷酸一氢根离子或500μM的磷酸二氢根离子时,荧光强度几乎不变。但当有焦磷酸存在时,所观测的荧光信号明显减弱。这说明了只有焦磷酸可以抑制二价铜离子在聚T链上被抗坏血酸还原。同时可观测到,当200μM的焦磷酸和30U·L-1的碱性磷酸酯酶同时存在时,荧光信号得到了部分恢复。这些结果都说明了焦磷酸抑制聚T模板链合成的铜纳米粒子作为荧光探针用于检测碱性磷酸酯酶的活性这一方法是可行的。

图2 在不同反应条件下的荧光光谱图
从上到下的反应条件是:1)PPi和磷酸根离子都不存在时;2)500μM的HPO42-存在时;3)500μM 的 H2PO4-存 在 时;4)200μM 的 焦 磷 酸和30U·L-1的碱性磷酸酯酶同时存在时;5)只有200μM的焦磷酸存在。其他反应条件都一样。
3.2 实验条件的优化
图3是有无焦磷酸存在的条件下,焦磷酸的抑制作用对二价铜离子浓度的影响。由图3可知,随着二价铜离子浓度的增加,荧光强度逐渐增加,并且在二价铜离子的浓度达到100μM时,有最大的荧光强度差。图4是碱性磷酸酯酶的反应时间的优化。由图4可知,随着水浴时间的加长,测得的荧光强度逐渐增强。在水浴时间为50min的时候,荧光强度达到最强,并且再增加水浴时间发现荧光强度不再发生变化。由图5、图6可知,随着焦磷酸浓度逐渐增加,荧光强度逐渐减弱,当焦磷酸的浓度达到200μM时,荧光强度趋于平稳。所以,最佳铜离子浓度、焦磷酸的浓度、酶反应时间分别为100μM、200μM、50min。

图3 有无焦磷酸存在条件下,焦磷酸的抑制作用对二价铜离子浓度的影响
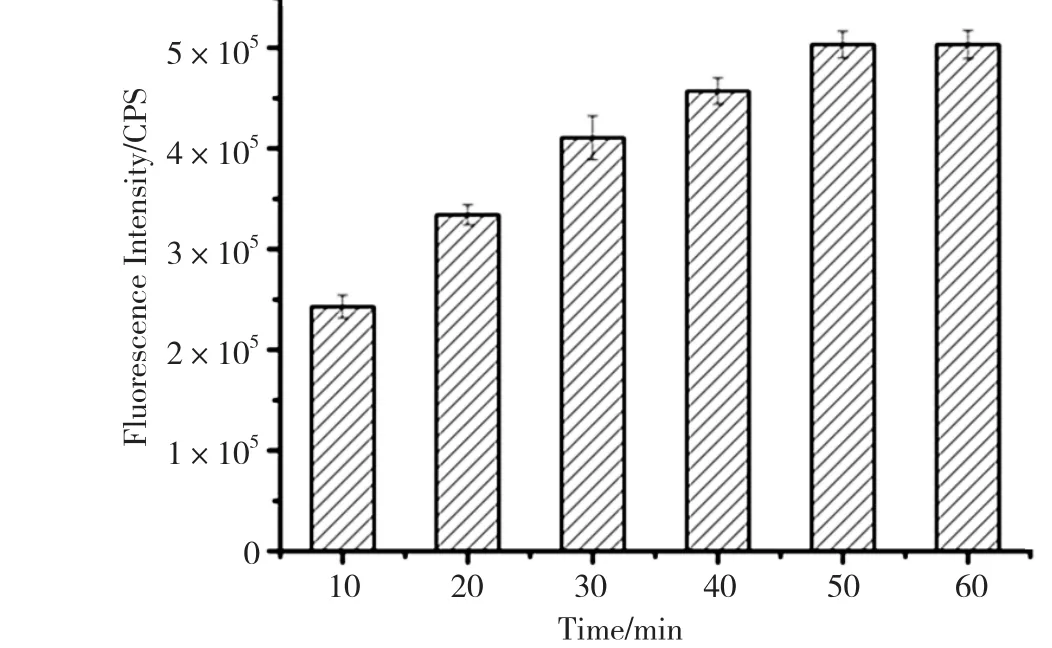
图4 碱性磷酸酯酶的反应时间的优化
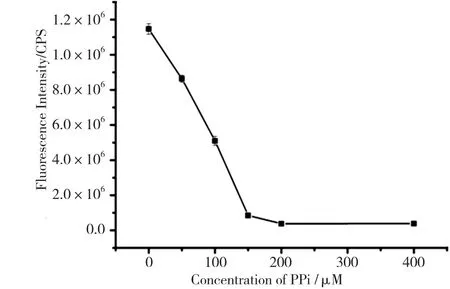
图5 荧光强度与焦磷酸浓度之间的线性关系图

图6 不同浓度焦磷酸的条件下,所测得的荧光光谱图
3.3 ALP酶活性的研究
如图7所示,在最佳的实验条件下观察在不同的ALP浓度条件下测得的荧光光谱图,发现,在625nm位置的荧光强度随着ALP浓度的增加而增加。所得的校准曲线如图8、9所示,当ALP的含量在0.5~20U·L-1之间时,荧光强度与ALP的浓度成正比。检测到的最低下限为0.5U·L-1。与其他同样的检测ALP的方法相比[16-17],该方法的检测限要低些,重现性也比较好些。

图7 在不同的ALP酶浓度的条件下测得的荧光光谱图

图8 ALP酶的校准曲线

图9 荧光强度与ALP酶浓度的对数之间的线性关系(每组实验都至少重复3次)
4 结论
碱性磷酸酯酶(ALP)是人体多种组织中的一种重要的酶,对多种疾病的临床诊断具有重要的意义。因此,本文中基于焦磷酸(PPi)对以聚T链为模板的荧光铜纳米颗粒的形成具有很强的抑制作用,发展了一种非标记的荧光增强的方法用于碱性磷酸酯酶活性的检测。
该方法旨在利用焦磷酸与二价铜离子之间的强络合作用来抑制单链DNA与二价铜离子之间的结合作用,进而不能够合成铜纳米颗粒,导致荧光信号降低。但当ALP存在的条件下,ALP可以使PPi水解,进而PPi就不能与二价铜离子发生络合作用。在聚T模板链的存在下,二价铜离子被抗坏血酸还原,形成具有荧光的铜纳米颗粒,进而荧光恢复。
该方法不仅直接在均相溶液中就可进行,而且该方法选择性好,所需时间短,成本低廉,灵敏度高。其检测下限达到0.5U∙L-1。
[1] Coleman J E. Structure and mechanism of alkaline phosphatase[J]. Annual review of biophysics and biomolecular structure, 1992, 21(1): 441-483.
[2] Couttenye M M, D’haese P C, Van Hoof V O, et al. Low serum levels of alkaline phosphatase of bone origin: a good marker of adynamic bone disease in haemodialysis patients[J]. Nephrology Dialysis Transplantation, 1996,11(6): 1065-1072.
[3] Gomez B, Ardakani S, Ju J, et al. Monoclonal antibody assay for measuring bone-specific alkaline phosphatase activity in serum[J]. Clinical chemistry, 1995, 41(11): 1560-1566.
[4] Magnusson P, Larsson L, Magnusson M, et al. Isoforms of bone alkaline phosphatase: characterization and origin in human trabecular and cortical bone[J]. Journal of Bone and Mineral Research, 1999, 14(11): 1926-1933.
[5] 何谓霞,张晓雷,刘芃芃,等. 实验性佝偻症对鸡血清,肠,肝,肾,骨中碱性磷酸酶活性的影响[J]. 畜牧兽医学报,1987,18(2):99-103.
[6] Hill C S, Wolfert R L. The preparation of monoclonal antibodies which react preferentially with human bone alkaline phosphatase and not liver alkaline phosphatase[J].Clinica chimica acta., 1990, 186(2): 315-320.
[7] Wilson P D, Smith G P, Peters T J. Pyridoxal 5’-phosphate:a possible physiological substrate for alkaline phosphatase in human neutrophils[J]. The Histochemical Journal, 1983,15(3): 257-264.
[8] Fernley H N. Mammalian alkaline phosphatases[J]. The enzympes, hydrolysis: other CN bonds phophate esters,1971(4): 417-447.
[9] Adler L. Properties of alkaline phosphatase of the halotolerant yeast Debaryomyces hansenii [J]. Biochimicaet Biophysica Acta (BBA)-Enzymology, 1978, 522(1): 113-121.
[10] Rosalki S B, Foo A Y. Two new methods for separating and quantifying bone and liver alkaline phosphatase isoenzymes in plasma[J]. Clinical chemistry, 1984, 30(7): 1182-1186.
[11] Lomashvili K A, Cobbs S, Hennigar R A, et al. Phosphateinduced vascular calcification: role of pyrophosphate and osteopontin [J]. Journal of the American Society of Nephrology, 2004, 15(6): 1392-1401.
[12] Heinonen J K, Lahti R J. A new and convenient colorimetric determination of inorganic orthophosphate and its application to the assay of inorganic pyrophosphatase[J].Analytical biochemistry, 1981, 113(2): 313-317.
[13] Fernley H N, Bisaz S. Studies on alkaline phosphatase.Phosphorylation of calf intestinal alkaline phosphatase by 32 P-labelled pyrophosphate[J]. Biochem. J., 1968(107):279-283.
[14] Liu Y, Schanze K S. Conjugated polyelectrolyte-based realtime fluorescence assay for alkaline phosphatase with pyrophosphate as substrate[J]. Analytical chemistry, 2008,80(22): 8605-8612.
[15] Qing Z, He X, He D, et al. Poly (thymine)-Templated Selective Formation of Fluorescent Copper Nanoparticles[J].Angewandte Chemie International Edition, 2013, 52(37):9719-9722.
[16] 焦奎瀛,孙伟,王海玉.以对硝基磷酸苯酯为底物电化学分析法检测碱性磷酸酯酶[J]. 分析化学,2001(10):1174-1177.
[17] Blake M S, Johnston K H, Russell-Jones G J, et al. A rapid,sensitive method for detection of alkaline phosphataseconjugated anti-antibody on Western blots[J]. Analytical biochemistry, 1984, 136(1): 175-179.

