新式线栓法建立大鼠局灶性脑缺血再灌注模型的建立
范瑞娟 罗亚非 孙玉凤
【摘要】目的:在Zea Longa线栓法的基础上,对现有的改良线栓法进一步改进,为建立更加稳定的局灶性脑缺血再灌注模型提供参考。方法:30只雄性SD大鼠随机分Zea Longa线栓法组、改良线栓法组、新式线栓法组三组,每组10只。比较上述3组大鼠局灶性脑缺血再灌注模型的制作时间,及再灌注24h后大鼠的神经功能评分、脑梗死体积率及动物死亡率等指标,评价经过再改进后的新式线栓法制作的大鼠局灶性脑缺血再灌注模型的有效性。结果:Zea Longa线栓法组、改良线栓法组、新式线栓法组大鼠的神经功能评分、脑梗死体积率,模型成功率无明显差异(P>0.01),但新式线栓法组的模型制作时间及大鼠死亡率明显低于Zea Longa线栓法组和改良线栓法组。结论:经过进一步改进的新式线栓法可以有效缩短模型制作时间,减少动物死亡率,优于Zea Longa线栓法组、改良线栓法组,使大脑中动脉阻塞再灌注模型的建立更加简易稳定。
【关键词】线栓法;局灶性脑缺血再灌注;模型研究
【中图分类号】R-332【文献标志码】 A【文章编号】1007-8517(2014)02-0026-02
缺血性脑血管疾病已成为现代社会致死、致残的最主要疾病之一,而抑制再灌注损伤是缺血性脑血管疾病治疗的重要环节,开展对脑缺血再灌注损伤模型、损伤机制、防治的研究具有重要意义。其中,最为首要的是建立有效的脑缺血再灌注模型。而大脑中动脉(MCA)为临床上缺血性脑损伤的易患部位,故大脑中动脉阻断(MCAO)模型被广泛用于脑梗塞的研究[1]。
制备MCAO模型的方法有很多种,迄今主要包括光化学法,三氯化铁法,线栓法,自体血栓法,电流损伤法,自发性MCAO等[2]。其中线栓法制备的大鼠局灶性脑缺血模型是目前公认的较为理想的局灶性脑缺血模型.它具有不开颅,损伤小,重复性好的优点,并可准确控制缺血和再灌注的时间,因此应用范围广泛[3]。但是我们在实验过程中发现,Longa线栓法模型因为要分离结扎翼腭动脉,游离颈外动脉,损伤大,动物死亡率高,模型成功率低。而现阶段的改良模型因为要游离结扎颈外动脉,手术损伤仍然较大,操作时间偏长,动物死亡率仍然较高。因此我们对模型进行了进一步的改进,使手术更简洁,操作时间更短,动物死亡率更低,模型更具稳定性。
1材料与方法
1.1实验动物及分组30只SPF级雄性SD大鼠,体重250~300g,随机分为Longa线栓法组、改良线栓法组、新式线栓法组,每组10只。由长沙市天勤生物技术有限公司提供,生产许可证:SCXK(湘)2009-0012。
1.2试剂及线栓准备TTC染色剂由贵州博奥瑞杰生物科技有限公司提供;栓线由北京沙东生物技术有限公司提供,线身直径0.26mm,头端包被多聚赖氨酸,线头直径0.36±0.02mm,线长40mm,和球端相距19~20mm处有黑色标记。
1.3方法
1.3.1术前准备实验前对大鼠适应性喂养一周,自由饮水进食。术前12h禁食,自由饮水。3℅水合氯醛1ml/100g腹腔注射麻醉大鼠,仰卧位固定,颈前区备皮,常规消毒。
1.3.2模型制备Zea Longa线栓法组[4]:参照Zea Longa线栓法制备大鼠MCAO模型,颈正中线切口,钝性分离,暴露右侧胸锁乳突肌和胸骨舌骨肌之间的三角区域,沿胸锁乳突肌内侧分离肌肉筋膜,暴露颈总动脉(CCA),颈外动脉(ECA),颈内动脉(ICA)。电凝器电凝ECA的分支,结扎翼腭动脉(PPA),并在ECA近心端、远心端分别穿线,远心端系紧,近心端系一松结备用, 用微动脉夹暂时夹闭CCA与ECA,在ECA的两线间剪一小口,将栓线经小口插入颈外动脉并送入颈内动脉;改良线栓法组[5]:颈正中切口,暴露右侧CCA、ICA和ECA,电凝ECA与ICA之间的交通支,结扎并游离ECA,确保ECA残端长度不少于0.5 cm。以微动脉夹暂时阻断CCA及ICA血流,用眼科剪于ECA 残端作一纵行小切口,将线栓从右侧ECA残端插入ICA,轻轻牵拉ECA残端,使其与ICA成一条直线,调整线栓角度,使线栓弧度水平向外,与颈前正中线呈45度水平向外的夹角,移去夹闭ICA的动脉夹,轻轻将线栓送入颅内,栓塞成功后,结扎ECA残端,移去CCA上的微动脉夹,观察无活动性出血后关闭切口。新式线栓法组:颈正中线切口3~4cm,钝性分离,暴露右侧胸锁乳突肌和胸骨舌骨肌之间的三角区域,沿胸锁乳突肌内侧分离肌肉筋膜,暴露CCA,在CCA的近心端和远心端分别穿线,近心端系紧,距此节1cm处的远心端系一松节备用,在CCA近ICA分叉处以微动脉夹暂时夹闭,在CCA的两线间,距CCA分叉处5mm左右,剪一斜行45°小口,松开分叉处微动脉夹进行插线,在栓线标记接近CCA与ICA分叉处或遇阻力感时停止。
1.3.3神经功能评分参照Garcia神经功能评分[6]标准,评价大鼠的神经行为学,包括以下6项:自主运动;四肢运动对称性;前爪伸展性;攀爬运动;肢体本体感觉;触须反应。采用双盲法于术后24小时评分并记录。
1.3.4TTC染色及脑梗死体积率测定 于缺血再灌注24h后麻醉剪下头部,取出脑组织,置于脑模具中,沿视交叉向后平均切成5片,将其放入2%TTC的磷酸盐缓冲液,于37℃温箱中染色30min,再用4%多聚甲醛固定并摄片。
1.3.5观测指标记录从切口至插入栓线模型制作的时间;分析动物死亡原因,统计死亡率;于造模24h后对存活大鼠进行神经功能评分,统计模型成功率;用Image-Pro-Plus软件测量TTC染色后脑梗死体积率。
1.3.6模型成功标准神经功能评分为4~12 分,存活超过24h,取大脑无蛛网膜下腔出血,大脑冠状切面TTC染色可见明显苍白梗死区者为造模成功。
1.3.7统计学分析各组计量资料均采用SPSS19.0统计学软件进行处理,数据以“均数±标准差”(x±s)表示,数据呈正态分布时进行单因素方差分析,不呈正态分布采用非参数检验。
2结果
2.1大鼠死亡情况Zea Longa线栓法组大鼠共10只,死亡5只,存活5只,其中2只疑因造模时间过长,在造模完成后2h内死亡,3只在24h内死亡,解剖有蛛网膜下腔出血。改良线栓法组大鼠10只,死亡3只,存活7只,1只因大失血死亡,2只在造模完成后24h内死亡,解剖一只有严重脑水肿,一只蛛网膜下腔出血。Zea Longa线栓法组大鼠死亡率为50%,改良线栓法组大鼠为30%。新式线栓法组大鼠10只,存活10只,但有一只因栓线反复进退致血管痉挛,导致栓线深度未达到,造模失败,但没有大鼠死亡。就大鼠死亡情况而言,新式线栓法组优于Zea Longa线栓法组和改良线栓法组。
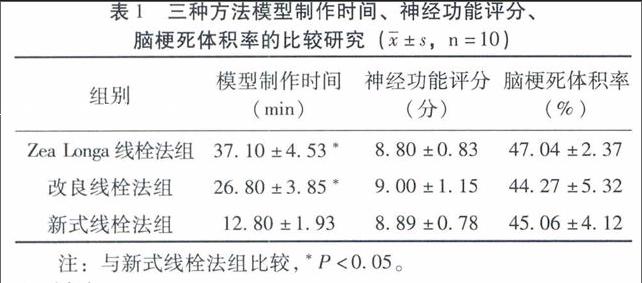
2.2模型制作时间、神经功能评分、脑梗死体积率实验结果表明,新式线栓法组与Zea Longa线栓法组和改良线栓法组比较,神经功能评分、脑梗死体积率差异无统计学意义(P>0.05);造模时间比较,新式线栓法组的模型制作时间最少,差异有统计学意义(P<0.05)
3讨论
线栓法因为各种优点,成为了广大研究者最为青睐的方法之一。为了使模型成功率更高,更稳定,广大研究者对线栓法进行了诸多改进。笔者在传统线栓法的基础上,查阅相关文献,经反复实践并总结诸多改良线栓法,对线栓法进行了进一步改良,仅需分离一根血管,打两个手术结,夹一个微动脉夹,使模型的制作时间和大鼠的死亡率明显低于Zea Longa线栓法组和现有的改良线栓法组,进一步确保的模型制作的稳定。现将模型制作中的相关经验探讨如下,以期对各科研者有所帮助。
3.1大鼠的选择SD大鼠与Wistar大鼠差异不大,但是SD大鼠出血更少。选择SD大鼠使手术操作更容易[7]。因为雌激素对大脑具有保护作用,故选择雄性大鼠。低于250g的大鼠,血管太细,容易刺破血管,死亡率高,超过300g的大鼠的血管过粗,容易造成栓塞不完全,认为大鼠体重控制在250~300g为佳。
3.2线栓的选择栓线的选择主要有尼龙线和鱼线两种,制作方法主要有石蜡包被,硅胶包被,多聚萘胺酸包被,也有用指甲油包被的。我们主要采用多聚赖氨酸包被的渔线,购买成品,规格更为一致,对模型的影响因素更小。
3.3麻醉剂的选择选用3%的水合氯醛1ml/100g,安全有效。5分钟内起效,但是维持时间较短。需要在50min左右加补水合氯醛,剂量一般为总剂量的1/3。
3.4切口及分离的部位关于切口,广大研究者主要有三种观点:正中切口,右侧切口,右侧斜向正中切口。笔者选用正中切口,钝性分离,暴露右侧胸锁乳突肌和胸骨舌骨肌之间的三角区域,沿胸锁乳突肌内侧分离肌肉筋膜,暴露颈总动脉,颈外动脉,颈内动脉。视野清晰,出血少,损伤相对较小,通常1~2min即可完成,用时短。
3.5栓线的入路仅分离颈总动脉一根血管,有效降低了手术操作时间;在颈总动脉(CCA)的近心端和远心端分别穿线,近心端系紧,距此节1cm处的远心端系一松节备用;在颈总动脉(CCA)和颈内动脉(ICA)的分叉处以微动脉夹夹闭,仅使用一个动脉夹,大大减少了手术的损伤;在颈总动脉的两线间剪一斜行的45°小口进行插线,切口具有一定倾斜角度更有利于插线;在分离颈总动脉分叉处时,可提拉远心端的松节,更利于暴露交感神经干,以避免对其刺激,降低大鼠的死亡率,确保模型的稳定性。尤其适用于线栓法操作尚不熟练的研究者。
3.6术中大鼠的护理我们在长期的实践中发现,术中大鼠死亡的原因主要有三种:一是呼吸急促。原因可能与分离血管时牵拉甚至损伤迷走神经有关。仅分离颈总动脉近分叉处1mm的血管,可以有效减少对迷走神经的刺激及损伤;此外,采取分离血管前局部浸润利多卡因,使用剥离分针代替镊子,小心分离,有利于暂时降低迷走神经的敏感性,并且,在分离颈总动脉分叉部时可稍向上提拉颈总动脉远心端的松结,有利于避免刺激颈动脉窦,改善大鼠呼吸急促的问题。二是呼吸困难,主要与麻醉有关。首先麻醉后大鼠的舌部麻醉肿胀,术前应将大鼠舌部稍牵拉出并偏向一侧,以免堵塞气道。其次水合氯醛易增加呼吸道的分泌物,尤其造成痰液过多,文献报道麻醉前可适量注射阿托品(1支稀释成10ml,每只0.1ml)。但是,事实上,阿托品[8]是通过阻断M受体的作用抑制腺体分泌,会使气道分泌物变粘稠,而不是减少分泌,反而更容易形成痰痂,阻塞气道,效果不佳。我们采取密切观察,在大鼠有呼吸困难或者痰鸣音时予以吸痰处理,效果稳定。三是大出血,传统线栓法因为要从颈外动脉插线,故要分离并电凝其分支两到三条。现有的改良线栓法虽然不从颈外动脉插线,但是要结扎颈外动脉,有时也会涉及到颈外动脉与颈内动脉之间的分支。这些分支一旦破裂,极易造成大出血,导致大鼠因失血过多而死亡。而且颈总动脉分叉处有颈动脉窦,分离极易过度刺激神经或者造成损伤,增加大鼠的死亡率。我们改良的线栓法,因为只需要分离颈总动脉一条,故而避免了分支破裂而造成的出血,也避开了颈总动脉分杈处的分离,减少了动物的死亡率及造模失败的危险性。
3.7术后大鼠的护理造模完成后,栓线抽出,将松结系紧。局部使用抗生素浸润,避免感染。先缝合肌肉层再缝合皮肤。解除固定后,若大鼠还未清醒,还可对大鼠四肢及腹部进行按摩。术后24h大鼠宜单独喂养。
线栓法建立大鼠局灶性脑缺血再灌注的模型虽然得到了广泛的认可,技术发展也日益成熟,但是由于影响模型成功的因素很多,如何规范和优化手术操作,降低动物的死亡率,使大鼠的脑梗塞恒定,更能模拟人类的发病机理,仍是广大研究者亟待解决的问题,仍需要科研者不断探索总结,为建立更加稳定的模型而努力。
参考文献
[1]黄斌,王兴勇,匡凤梧,等. 线栓法制备Wistar大鼠局灶性脑缺血模型的实验研究[J].现代医药卫生,2005,21( 15):1935.
[2]包玉龙,杜桂林,张宏,等.大鼠脑血栓动物模型研究进展[J].实验动物学,2009,26(6):50-52.
[3]刘玉和,于春荣.线栓法制备大鼠局灶性脑缺血模型的研究[J].北京大学学报,2007,8(1):41-44.
[4]Longa EZ, Weinstein PR,Carlson S, et al.Reversible middle cerebral artery occlusion without craniectomy in rats.Stroke,1989,20(1):84-91.
[5]马志健,罗刚,易西南.脑缺血再灌注动物模型的制备与评价[J].海南医学院学报,2009,15(6):556-559.
[6]Julio HG,Simone W, Kai-Feng L, et al. Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats[J]. Stroke,1995, 26:627-635.
[7]龚彪,李长清,黄剑.SD大鼠线栓法局灶性脑缺血再灌注模型的改进[J].重庆医学,2006,35(4):314-315.
[8]凌保东.药理学[M].北京:高等教育出版社,2003:59.
(收稿日期:2013.12.01)