银杏酸C15:1在水中溶解度的测定及关联
杨小明,方洋洋,2,李月英,黄炳忠
(1.江苏大学食品与生物工程学院,江苏镇江212013;2.江苏大学化学化工学院,江苏镇江212013;3.江苏大学基础医学与医学技术学院,江苏镇江212013;4.丹徒区人民医院,江苏镇江212028)
银杏酸C15:1在水中溶解度的测定及关联
杨小明1,方洋洋1,2,李月英3,黄炳忠4
(1.江苏大学食品与生物工程学院,江苏镇江212013;2.江苏大学化学化工学院,江苏镇江212013;3.江苏大学基础医学与医学技术学院,江苏镇江212013;4.丹徒区人民医院,江苏镇江212028)
采用荧光光度法,通过固-液平衡装置测定了从288.15 K到313.15 K温度下银杏酸C15:1在水中的溶解度,并分别应用Apelblat模型及理想溶液模型对试验数据进行了关联,总平均相对误差分别为4.50%和2.44%.结果表明:银杏酸C15:1在水中的溶解度随温度的升高而增大,溶解度的理想溶液模型和Apelblat模型在文中的研究温度和溶解度范围内是适用的,而Apelblat模型的模拟结果要优于理想溶液模型的模拟结果,其溶解度关联值与试验值比较吻合.通过van′t Hoff方程计算出银杏酸C15:1在水中的溶解焓和溶解熵均为正值,表明银杏酸C15:1在水中的溶解过程为吸热过程.
银杏酸C15:1;荧光光度法;固液相平衡;溶解度;模型关联
银杏酸(ginkgolic acids,GA)属漆酚类物质,为6-烷/烯基水杨酸衍生物的同系混合物,存在于银杏的叶、果及外种皮中,以外种皮中含量为最高.从银杏外种皮中分离的银杏酸主要由5个同系物组成:C13:0,C15:0,C15:1,C17:1和C17:2,其质量分数依次为20.7%,3.3%,51.6%,21.1%和3.3%[1].
银杏酸能够有效抑制病原菌生长[2],对日本钉螺及鱼类寄生虫指环虫有强烈的杀灭作用[3-4],并能抑制肿瘤细胞增殖,诱导其凋亡[2,5].银杏酸为弱极性化合物,易溶于石油醚、正己烷等弱极性有机溶剂,在甲醇、乙醇中也有一定的溶解度,但水中溶解度很小[6].在水中的低溶解度,使其口服吸收差、生物利用度降低,影响其作为抗肿瘤药物,或作为杀钉螺、杀虫药物的使用.另外,银杏酸的常规分离纯化过程,如萃取、色谱过程以及注射液制剂中,均需了解其溶解特性,文献[6]报道了银杏酸同系混合物在部分有机溶剂及25℃纯水中的溶解度.由于银杏酸5个同系物侧链长度不同,各单体在水中的溶解度亦不完全相同,同系混合物的溶解度并不能准确代表各单体的溶解情况.因此文中采用荧光光度法对银杏酸同系物中含量最高的C15:1在不同温度条件纯水中的溶解度进行测定,同时采用经验方程和理想溶液模型对测定的溶解度数据进行关联[7].
1 材料与方法
1.1 试验原料和试剂
银杏酸C15:1(浅黄色固体,相对分子质量346,熔点40~41℃,实验室自制,HPLC纯度大于98%),水为二次蒸馏水,其他试剂均为分析纯,购自上海试剂公司.
1.2 主要仪器和设备
试验用仪器有DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司),BS124S电子分析天平(北京赛多利斯仪器系统有限公司),Cary Eclipse荧光分光光度计(Varian Australian Pty. Ltd).
1.3 银杏酸C15:1溶解度的测定方法
1.3.1 标准曲线的绘制
精确称取银杏酸C15:1,20.5 mg,加少量甲醇助溶后转移到250 mL容量瓶中,加水定溶得储备液以水定容.分别精确量取上述溶液0.07,0.10,0.25,0.50,1.00和1.50 mL,用水定溶到25 mL已精确称量的容量瓶中,再分别称取各容量瓶的质量,分别得0.223 0,0.329 9,0.826 7,1.654 9,3.307 1,4.959 6μg·g-1的澄清银杏酸水溶液.
设定激发波长为280.0 nm,发射波长为410.0 nm[7],分别测定不同质量比银杏酸溶液的荧光强度,将荧光强度与质量比作最小二乘法线性回归,得到回归方程:

式中:F为银杏酸水溶液的荧光强度;ρ为银杏酸的质量比,μg·g-1.相关系数为r2=0.999 3,线性范围为0.223 0~4.959 6μg·g-1.
1.3.2 平衡时间的确定
银杏酸C15:1-水体系达到平衡的时间通过以下方法确定[8]:在溶解槽中加入略过量的银杏酸C15:1和一定量的水,密闭后放入恒温槽中搅拌,调节恒温水浴温度为293.15 K,每隔一段时间取样测定液相组成,以分析结果不再变化的时间作为体系达到平衡的时间.取样前,为使固液充分分离,停止搅拌,静置12 h,使未溶的固体沉淀到溶解槽的底部,用注射器抽取少量上部清液,0.45μm微孔滤膜过滤后进行荧光测定,记录荧光强度,结果带入方程(1)计算得出该温度下银杏酸在水中的溶解度.
为了确保试验数据的准确性,试验重复3次,取3次平均值为最终的试验结果.所测的银杏酸C15:1在饱和溶液中某一温度下的摩尔分数溶解度xi表示为[9]

式中:m1和M1分别表示溶质的质量和摩尔质量;m2和M2分别表示溶剂的质量和摩尔质量.
1.3.3 不同温度下银杏酸的溶解度测定
按上述方法分别测定银杏酸C15:1在288.15~313.15 K下的溶解度.
1.4 关联方程
1.4.1 理想溶液模型
理想溶液模型是根据热力学原理描述固液平衡的普遍化溶解度方程[9],假定银杏酸C15:1溶液为理想溶液,且忽略溶液中溶质与其纯固体物质的等压热容差别,且三相点温度很接近大气压下的熔化点温度,可得到溶质摩尔分数x2与熔点温度Tm之间的关系[10]:

在远离临界点区域的有限温度范围内,ΔHm一般可视为常数,真实溶液中组分的活度因子γ2对温度不敏感,近似为1,则式(3)可表示为

式中:x2为溶质的摩尔分数;T为绝对温度;A,B为无因次参数.
1.4.2 Apelblat模型
Apelblat溶解度模型是假定溶液的热焓随温度线性变化,忽略了溶质活度系数的影响,从Clausius-Clapeyron方程推得溶解度随温度的变化关系[11]:

式中:x2为溶质的摩尔分数;T为绝对温度;A,B,C为无因次参数.
1.5 统计分析
运用t检验分别对银杏酸C15:1的试验值与各模型计算值进行显著性分析,统计分析利用应用软件Excel进行.
2 结果与讨论
2.1 平衡时间的确定
在293.15 K时测得银杏酸质量比随时间变化的关系如表1所示.由表1可见,体系在60 h后液相组成不再变化,即可认为是其在该温度下的溶解度.考虑到测量数据的方便,取平衡时间为72 h.试验中为确保溶解平衡的建立,恒温72 h后方可进行取样分析,取3次结果的平均值.

表1 银杏酸C15:1-水固液平衡浓度与时间的测定
2.2 试验数据及关联结果分析
在试验条件下,测定了288.15~313.15 K温度范围内银杏酸C15:1在水中的溶解度,并采用理想溶液模型和Apelblat模型方程,即公式(4)和(5)对试验数据进行关联.溶解度试验值与Apelblat模型和理想溶液模型回归计算值见表2.纯水体系的关联方程参数、相关系数、平均相对误差见表3.其中相对误差定义为

平均相对误差的定义为

式中:xexp为试验值;xcal为计算值;n为试验点数.
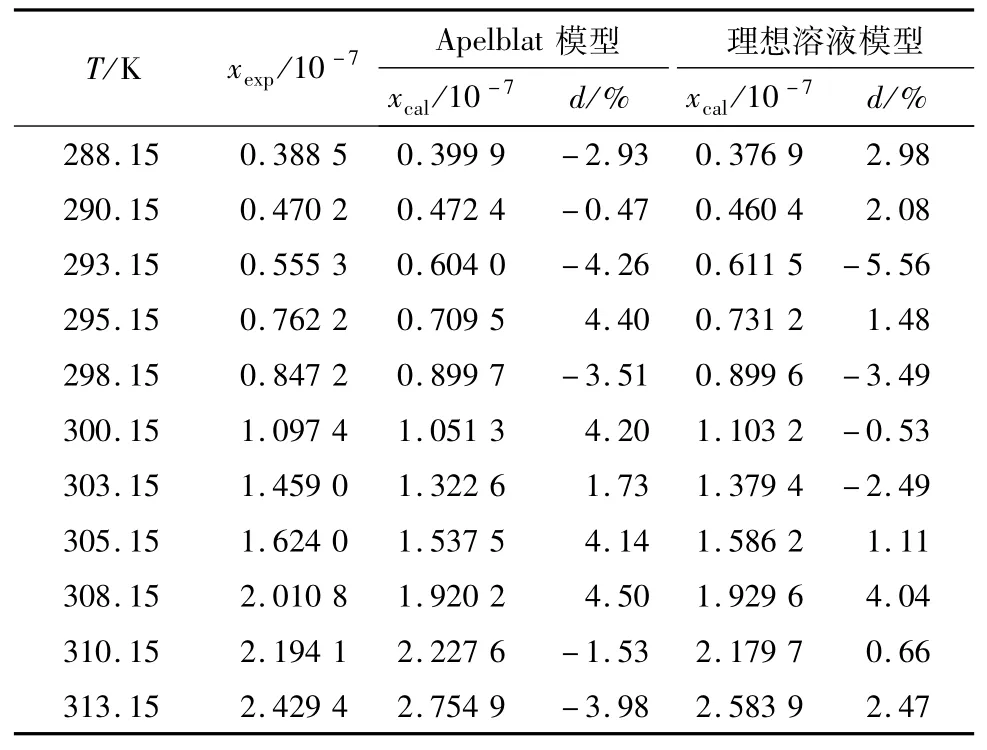
表2 银杏酸在水中的溶解度

表3 理想溶液模型和Apelblat模型拟合参数
由表3分析可知,试验数据按照公式(4)的理想溶液模型关联,相关系数r为0.993 4,溶解度计算值与试验值的平均相对误差为2.44%,其中最大的相对误差值为-5.56%;试验数据按照公式(5)的Apelblat模型进行关联,相关系数r为0.996 1,溶解度的计算值与试验值的相对误差均不超过4.50%,平均相对偏差为3.24%.说明溶解度的理想溶液模型和Apelblat模型在文中的研究温度和溶解度范围内是适用的,但Apelblat模型的模拟结果要优于理想溶液模型的模拟结果.可见在试验温度范围内,文中采用的Apelblat模型建立的银杏酸C15:1在纯水中的溶解度方程具有很好的内插性.Apelblat方程由相平衡的基本热力学原理推导简化而得出,方程具有普适性.
银杏酸C15:1在纯水中的溶解度曲线如图1所示,由图可以看出,银杏酸C15:1在纯水中的溶解度随温度上升而增大.

图1 银杏酸C15:1在水中的溶解度曲线
2.3 溶解热力学数据的计算
根据van′t Hoff方程[11]可知溶解度的对数值与温度成线性关系:

式中:x2为溶质的摩尔分数;ΔHm和ΔSm分别表示熔融焓和熔融熵;T为绝对温度;R为理想气体常数.
在实际应用中,溶解过程多为非理想过程,常常需要考虑溶剂的作用.因此,通常用混合热力学数据替代熔融热力学数据,用ΔHd代替ΔHm,ΔSd代替ΔSm,故方程可表示为

根据ln x2与T在试验温度范围内的回归数据计算可得,银杏酸C15:1在纯水中的ΔHd=57.91 kJ· mol-1,ΔSd=193.37 J·mol-1·K-1.ΔHd>0,说明银杏酸C15:1的溶解过程为吸热过程;ΔSd>0,说明该溶解过程为不可逆过程.
3 结 论
1)采用平衡法测定了288.15~313.15 K时,银杏酸C15:1在纯水中的溶解度,结果表明银杏酸C15:1在水中的溶解度随温度升高而增大.通过van't Hoff方程计算出银杏酸C15:1在水中的溶解焓和溶解熵均为正值,表明银杏酸C15:1在水中的溶解过程为不可逆吸热过程.
2)Apelblat模型对银杏酸C15:1在纯水中的溶解度数据的关联优于理想溶液模型,拟合值与计算值的相对误差均在4.50%之内,平均相对误差为3.24%,拟合数据与试验数据吻合良好.
(
)
[1]Yang Xiaoming,Zhang Xiuli,Chen Yongchang,et al. LCmethod for determination of ginkgolic acids in mice plasma and its application to a pharmacokinetic study[J].Chromatographia,2009,69(5/6):593-596.
[2]Yang Xiaoming,Wang Yunfei,Li Yueying,etal.Thermal stability of ginkgolic acids from Ginkgo biloba and the effects of ginkgol C17:1 on the apoptosis and migration of SMMC7721 cells[J].Fitoterapia,2014,98:66-76.
[3]Wang Gaoxue,Jiang Dongxin,Zhou Zhuang,et al.In vivo assessment of anthelmintic efficacy of ginkgolic acids(C13:0,C15:1)on removal of Pseudodactylogyrus in Europeaneel[J].Aquaculture,2009,297(1/2/3/ 4):38-43.
[4]Yang Xiaoming,Chen Shengxia,Xia Lei,etal.Molluscicidal activity against O.hupensis of Ginkgo biloba[J].Fitoterapia,2008,79(4):250-254.
[5]Hsieh CC,Hernández-Ledesma B,de Lumen BO.Cell proliferation inhibitory and apoptosis-inducing properties of anacardic acid and lunasin in human breast cancer MDA-MB-231 cells[J].Food Chemistry,2011,125(2):630-636.
[6]杨小明,梁 健,王驰芳,等.银杏酸平衡溶解度和表观油水分配系数的测定[J].时珍国医国药,2010,21(10):2586-2587. Yang Xiaoming,Liang Jian,Wang Chifang,et al.Determination of equilibrium solubility and apparentoil-water partition coefficient of ginkgolic acids[J].Lishizhen Medicine and Materia Medica Research,2010,21(10):2586-2587.(in Chinese)
[7]侯 宁,李大鹏,马 放,等.生物破乳剂产生菌XH-1的发酵动力学[J].江苏大学学报:自然科学版,2013,34(4):455-459. Hou Ning,Li Dapeng,Ma Fang,et al.Fermentation kinetics of bio-demulsifier producing bacteria XH-1[J]. Journal of Jiangsu University:Natural Science Edition,2013,34(4):455-459.(in Chinese)
[8]严国兵,白同春.水飞蓟素在水中溶解度的测定及关联[J].苏州大学学报:自然科学版,2004,20(2):79-83. Yan Guobing,Bai Tongchun.The measurement and correlation of solubilities of silymarin in water[J].Journal of Suzhou University:Natural Science Edition,2004,20(2):79-83.(in Chinese)
[9]Liu JQ,Chen SY,Ji B.Solubility and thermodynamic functions of isatin in pure solvents[J].Journal of Chemical&Engineering Data,2014,59:3407-3414.
[10]Zhang X,Gang Q,RuiW,et al.Correlation of solubility and calculation of thermodynamic properties of guanidine nitrate in different solvents[J].Fluid Phase Equilibria,2015,388:59-65.
[11]Tao M,Zhao W,Gong J,et al.Determination of the solubility,dissolution enthalpy,and entropy of pioglitazone hydrochloride(form ii)in different pure solvents[J].Industrial&Engineering Chemistry Research,2013,52(8):3036-3041.
(责任编辑 祝贞学)
M easurement and correlation of solubility for ginkgolic acid C15:1 in water
Yang Xiaoming1,Fang Yangyang1,2,Li Yueying3,Huang Bingzhong4
(1.School of Food and Biological Engineering,Jiangsu University,Zhenjiang,Jiangsu 212013,China;2.School of Chemistry and Chemical Engineering,Jiangsu University,Zhenjiang,Jiangsu 212013,China;3.School ofMedical Science and Laboratory Medicine,Jiangsu University,Zhenjiang,Jiangsu 212013,China;4.Dantu District Hospital,Zhenjiang,Jiangsu 212028,China)
The solubility of gingkgolic acid C15:1 in water wasmeasured with solid-liquid equilibrium apparatus by fluorometry at temperature range from 288.15 to 313.15 K.The experimental data were correlated with models based on the Apelblat equation and ideal solution equation.The total average relative errors are 4.50%and 2.44%,respectively.The results show that the solubility of ginkgolic acid C15:1 is increased with the increasing of temperature.Ideal solution equation and Apelblat equation of solubility are applicable for the specified temperature and solubility in the research.The simulated result of Apelblat equation is superior to that of ideal solution equation,and the predictive values are consistent with the experimental results.The values of entropy and enthalpy change of gingkgolic acid C15:1 in water are both positive according to van′t Hoff equtation,which indicates that the dissolve process of gingkgolic acid C15:1 in water is an endothermic process.
ginkgolic acid C15:1;fluorospectrophotometry;solid-liquid equilibrium;solubility;correlation model
O622.5
A
1671-7775(2015)05-0557-04
杨小明,方洋洋,李月英,等.银杏酸C15:1在水中溶解度的测定及关联[J].江苏大学学报:自然科学版,2015,36(5):557-560.
10.3969/j.issn.1671-7775.2015.05.011
2014-11-04
国家自然科学基金资助项目(81372404);中国博士后基金资助项目(2010M521018);江苏省博士后基金资助项目(1201025B);镇江市社会发展基金资助项目(SH2010004)
杨小明(1963—),女,江苏镇江人,教授(XM-Yang1963@126.com),主要从事天然产物分离与性质的研究.
方洋洋(1989—),女,江苏丹阳人,硕士研究生(18361811807@163.com),主要从事天然产物分离的研究.

