T2WI结合弥散加权成像对前列腺癌危险分级的应用
河北北方学院附属第一医院影像科(河北 张家口 075000)
王丽霞 高晋军 齐志民
刘 菲 史新乐 班旭霞
吴 朋 郎晓燕
T2WI结合弥散加权成像对前列腺癌危险分级的应用
河北北方学院附属第一医院影像科(河北 张家口 075000)
王丽霞 高晋军 齐志民
刘 菲 史新乐 班旭霞
吴 朋 郎晓燕
目的探讨T2WI结合DWI对低危(Gleason 评分<6)、中危或高危Gleason评分≥7前列腺癌诊断价值。方法51例前列腺癌患者在前列腺切除术前执行3.0T磁共振检查。由2名放射医师在T2WI和T2WI结合ADC图像分析8个区前列腺癌可能。结果分为低危、中危或高危前列腺癌两组,及与病理结果相关性。采用ROC进行T2WI和T2WI结合DWI诊断分析,结果在2名放射医师中,T2WI结合DWI对中危或高危前列腺癌诊断性曲线下面积大于T2WI曲线下面积(放射医师1:0.887、0.859;放射医师2:0.732、0.662),P<0.05,但T2WI结合DWI对低危前列腺癌诊断性曲线下面积(放射医师1:0.719、0.725;放射医师2:0.685、0.680)无统计学意义,P>0.05。2名医师为0.689。结论DWI结合T2WI能够增加中危或高危前列腺癌检出率,但对低危前列腺癌无诊断作用。
前列腺癌;弥散加权成像;磁共振成像
MRI是目前检查前列腺最好影像学检查方法,传统T2WI能够准确检出前列腺癌。目前研究结果显示弥散加权成像(diffusion-weighted imaging,DWI)有助于检查前列腺癌组织,因为癌组织表观弥散系数(apparent diffusion coefficient,ADC)值低于非癌组织。T2WI结合DWI有助于提高前列腺癌检出率,然而最近更多研究认为T2WI结合DWI和单独应用T2W检出相似结果[1]。
Gleason评分系统是国际公认前列腺癌参考评分系统[2]。对于侵袭性肿瘤,肿瘤危险级别类型如下:低危(Gleason评分≤6),中危(Gleason评分为7),高危(Gleason评分≥8)。最近研究前列腺癌ADC值与评分呈负相关性[3]。DWI检出前列腺癌敏感性和特异性分别为54-94%、61~100%[4]。对于相当大癌灶Gleason评分为6分在T2WI和ADC图难以发现。笔者认为T2WI和DWI诊断前列腺癌取决于Gleason评分。本研究目的是T2WI结合DWI对前列腺癌诊断能力,比较T2WI和T2WI结合DWI对不同危险级别前列腺癌检出效果。
1 材料与方法
1.1 临床资料本研究入选标准如下:(1)选取2007~2011年见河北北方学院进行3.0T MR(报进行DWI检查)前列腺癌患者;(2)MRI检查至少在前列腺活检后3周进行检查;(3)根治性前列腺切除术在前例腺MRI检查后6个月进行手术。根据原先选取58例患者,5例患者被排除研究范围,因在MRI检查前进行激素治疗,2例患者因组织病理学切片损坏,不能进行研究。结果51例患者符合入选标准。年龄50~72岁,平均,年龄63岁。术前平均血清PSA(prostate specific Antigen,PSA)为11.5ng/ml(范围为4.23~43.83 ng/ml)。术后,27例(53%)Gleason评分为6分,20例Gleason评分为7分(39%),4例(8%)Gleason评分为≥8分或以上。这次研究得到本单位和患者支持,病人同意并填写同意书。
1.2 方法
1.2.1 MRI扫描技术:采用3.0T MRI进行扫描(Magnetom Trio,Siemens Healthcare),应用盆腔相阵线圈。MR图像检查参数如下:自旋回波(turbo spin-echo sequence images)横断位T1WI(TR/TE,724/11;层厚,4mm;翻转角150°;有效视野,260mm;相阵,384×297),横断位、冠状位及失状位T2WI BLADETU图像(TR/TE,7、110-3、 200/113-106;层厚,3~4mm;翻转角,120~140°;有效视野,200-280mm;相阵,320-384×320-384);横断回波平面DWI序列(b值,0、1000s/mm2;TR/ TE,3、200/71;带宽,2604 Hz/像素;层厚,4mm;有效视野,280mm;相阵,128×80)。从2次b值为0、1000s/mm2,DWI序列自动获取ADC图。
1.2.2 MRI图像分析:有2名经验丰富放射医师在PACS(Piview,Infinitt)工作站独自分析每个病例2WI和ADC图。在分析前列腺MRI图像时,医师1有11年诊断经验,医师2有4年诊断经验。放射医师知道患者有前列腺癌病史,但未知其他临床病史和病理组织学结果,包括Gleason评分和肿瘤位置等。2名医师随机回顾分析单独T2WI和T2WI结合ADC图,两次分析间隔3周,避免分析偏倚。系统化评估前列腺MRI图像,在左右两叶前列腺分为8区:基底区、中间区、外周区和移行区医师根据标准规则,独立完成前列腺癌读片。接着分析前列腺癌MRI特点:T2WI显示在移行区结节性或肿瘤样均匀低信号,边界不清、包膜不完整,在ADC图表现为局限性弥散受限。根据上述标准,放射医师用如下0~4分评估每个区存在前列腺癌可能性:0为肯定无癌;1为很可能无癌;2为可能有癌;3为很可能有癌;4为肯定有癌。后评估MRI表现与组织病理学相关性,将感性兴趣区(regions of interest,ROI)放在2名医师评定结果均认为可能有癌区(≧2分)进行测量ADC值,与相应病理结果证实。手动在低信号肿瘤中心画出ROI区,ROI区范围为2.3~3.0mm2。当在ADC图选取ROI,放射医师应排除肿瘤边缘、前列腺包膜、神经血管束和尿道。由工作站(Leonardo,Siemens Medical Solutions)自动计算出平均ADC值。
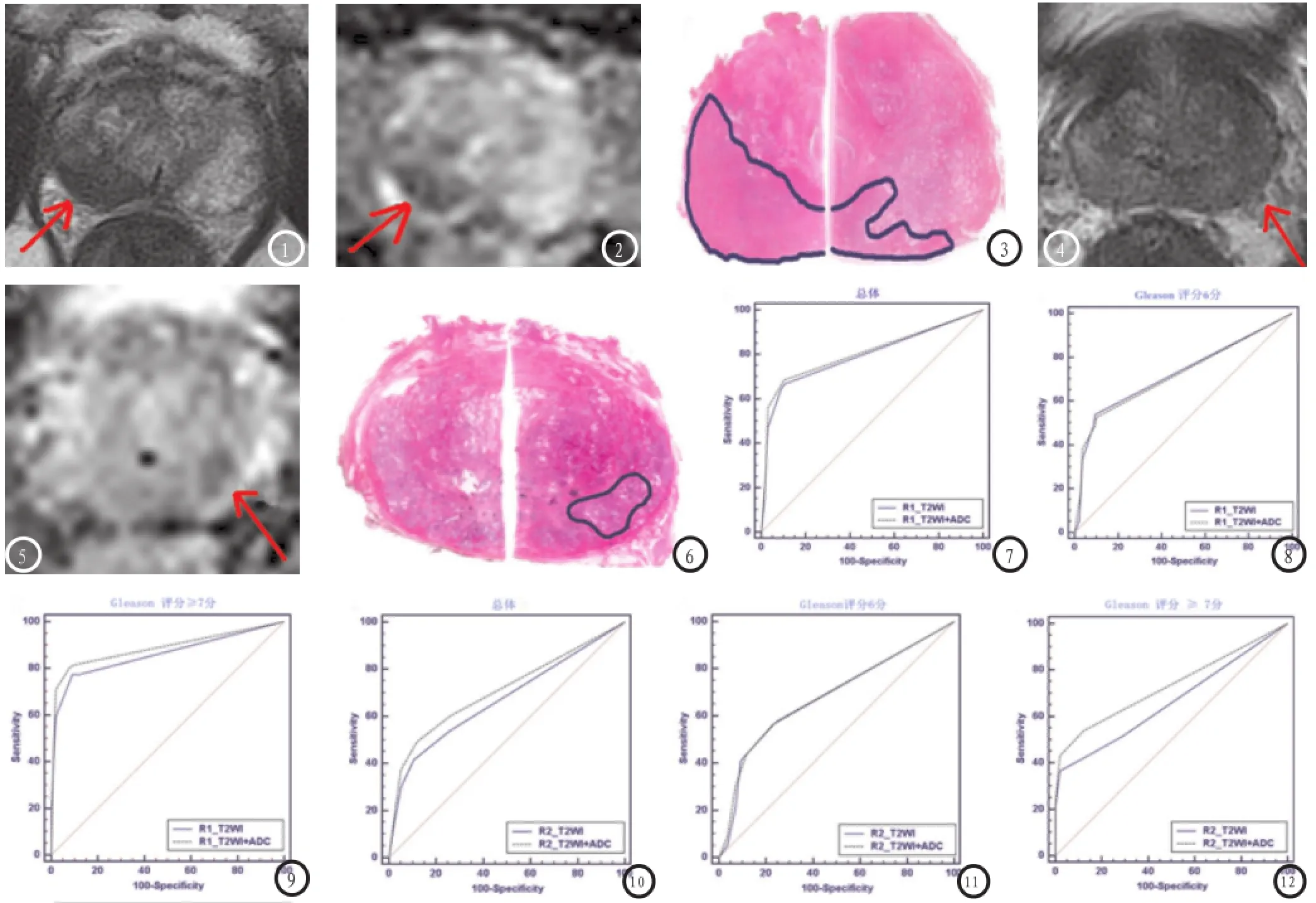
图1-3 前列腺患者,Gleason评分为6分。图1和2:T2WI结合ADC图在右外周区可见低信号影(箭头),ADC值为818.6×10-6mm2/s,2放射医师评分均为4分,图3 病理切片显示右外周区和中间区癌细胞。图4-6 前列腺患者,Gleason评分为7分。图4左外周区可以低信号影(箭头),放射医师1:可能无癌;放射医师2肯定无癌,图5 ADC图显示左外周叶低信号影(箭头),ADC值为785×10-6mm2/s,评分4分,两者均为肯定癌。图6显示左外周区癌细胞(划线轮廓)。图7-12为采用ROC曲线分析,T2WI和T2WI结合ADC图对总体、低危(Gleason评分6分)、中危或高危(Gleason评分≧7分)前列腺癌诊断性能。图7-9为放射医师1,在总体肿瘤评分中,T2WI结合ADC图(0.808)曲线下面面积与T2WI(0.795)无明显统计学差异;T2WI(0.725)和T2WI结合ADC图(0.719)在检查低危前列腺癌无统计学差异,T2WI(0.859)和T2WI结合ADC图(0.887)在检查中危或高危前列腺癌具有明显统计学差异。图10-12为放射医师2,在总体肿瘤评分中,T2WI(0.709)结合ADC图曲线下面积明显大于(0.671)T2WI;T2WI(0.680)和T2WI结合ADC图(0.685)在检查低危前列腺癌无统计学差异,T2WI(0.662)和T2WI结合ADC图(0.732)在检查中危或高危前列腺癌具有明显统计学差异。R1和R2分别为放射医师1,2。图13为低危和中危或高危前列腺癌的箱线图,中心线=平均值,箱顶=5%,箱底=25%,o=极端值,★=显著性差异(P<0.01)。Mean ADC values of tumours were as follows:Gleason评分6分=874.6±131.4×10-6mm2/s;Gleason评分≧7分=779.4±170.9×10-6mm2/s。

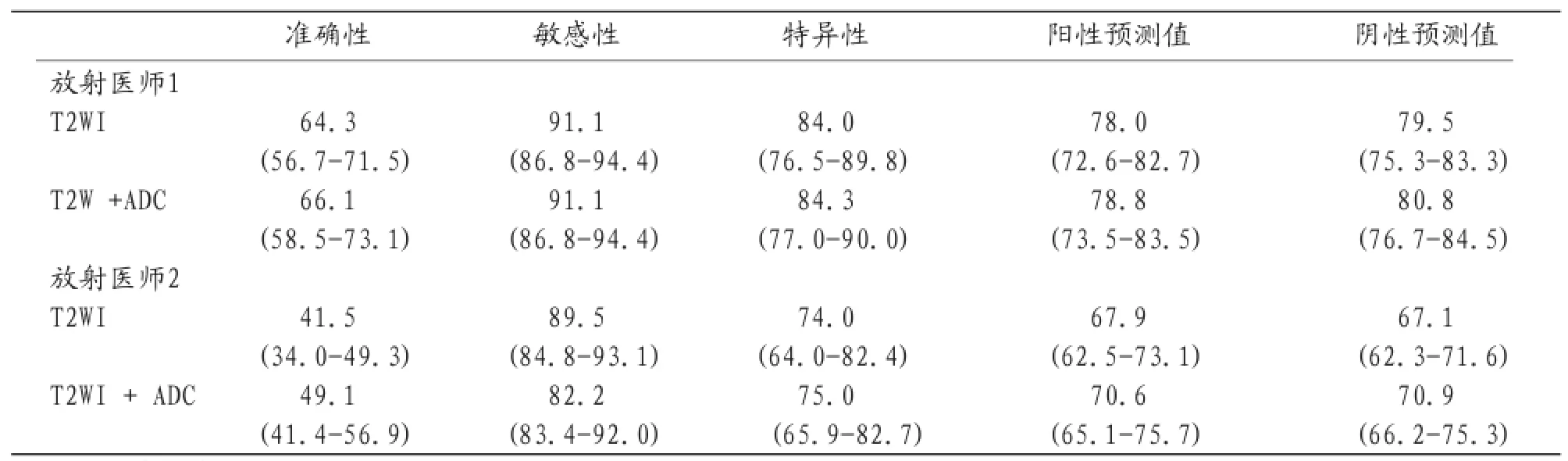
表1 2名医师用两种方法前列腺癌诊断准确率、敏感性、特异性、阳性预测值和阴性预测值
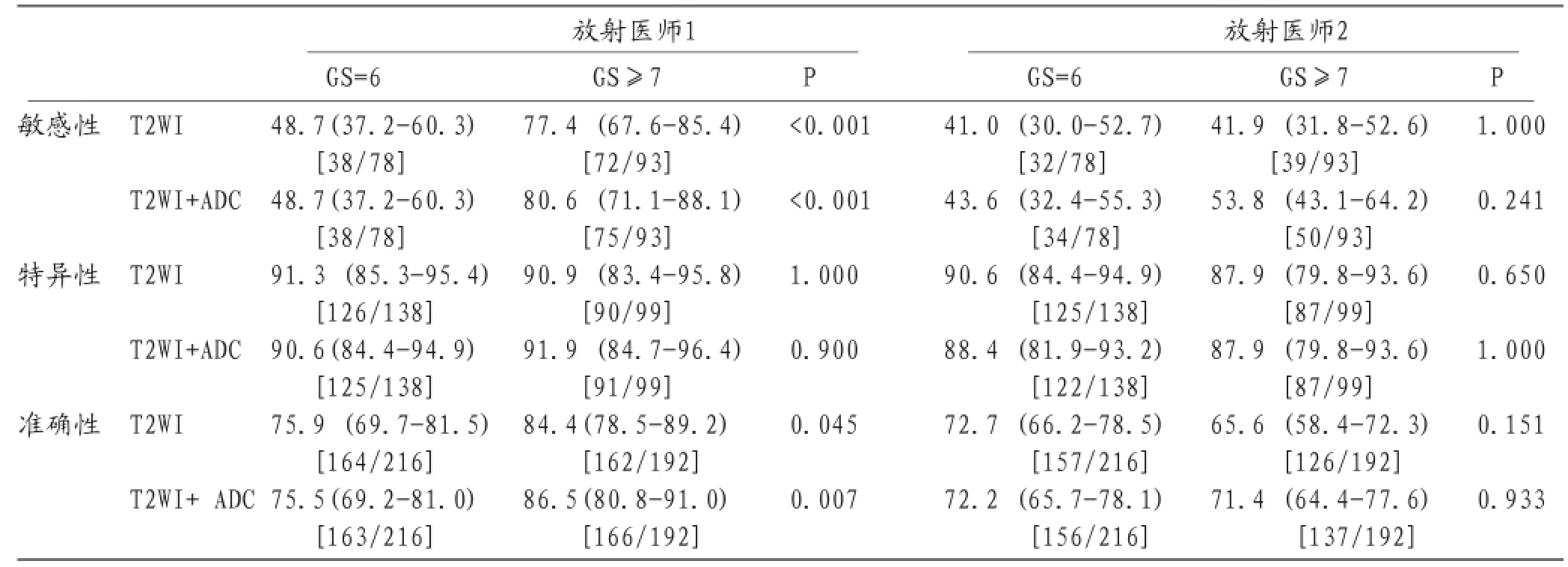
表2 2名医师用两种方法检出低危前列腺癌与中危或高危前列腺癌的准确率、敏感性、特异性比较

表3 2名医师用两种方法检出低危前列腺癌与中危或高危前列腺癌曲线下面积和95%置信区间
1.2.3 组织病理学分析和与MRI检查结果相关性分析:采用墨汁标记前列腺切除样本,在10%福尔马林固定至少24h。每个手术样本轴向逐层切片,厚4mm,然后将切片分为两部分(左右两部分)或四部分(左右前后四部分)取决于样本固定在载玻片大小。有1名从事病理20多年经验丰富病理医师在未知病理情况下,评估前列腺癌灶和评定每个载玻片的Gleason分数。在载玻片上绘画出在前列腺8区肿瘤病灶图,与MRI结果进行相关性分析,发现早期病灶。1名有有9年经验放射医师根据前列腺大小、形态特点、精囊腺位置、尿道和钙化及基地部和顶端最大距离,评估T2WI和相应ADC图。
1.3 统计学处理应用SPSS 19.0进行统计分析。根据每位患者Gleason评分、MRI图像和病理学相关性将其分为两组:低危前列腺癌组(Gleason评分为6),中危或高危前列腺癌组(Gleason≧7分)。计算2名医师应用两种方法的准确性、敏感性、特异性、阳性预测值和阴性预测值采用ROC分析每组两种方法对前列腺诊断性能,采用Z检验比较两种方法间准确性、敏感性和特异性。曲线下面积 比较两组两种方法。采用检验分析2名医师间一致性。低危、中威及高危前列腺癌的ADC值间差异采用t检验。P<0.05有统计学意义。
2 结 果
组织病理学显示在408区发现171(41.9%)个肿瘤灶,其中在27例患者中78个区癌瘤Gleason评分为6分,20例患者中79个区癌瘤Gleason评分为7分,4例患者中14个区癌瘤Gleason评分为≧8分。
50患者中,T2WI结合ADC图检出前列腺癌准确率、敏感性、特异性、阳性预测值和阴性预测值,见表1
医师1应用两种方法对中危或高危前列腺癌检出敏感性和准确性明显高于低危前列腺癌患者,见表2。
2名放射医师应用两种方法低危、中危或高危前列腺癌的ROC曲线和曲线下面积显示见图1-3和表3。在医师1中,T2WI结合ADC图曲线下面积大于T2WI,但无统计学意义。而医师2中,T2WI结合ADC图(0.709)曲线下面积明显大于T2WI(0.671)。对于2名医师在检查中危或高危前列腺患者中,T2WI结合ADC图曲线下面积明显大于T2WI,在检出低危前列腺癌患者中,T2WI结合ADC图与T2WI曲线下面积无统计差异。
中危和低危前列腺癌曲线下面积见图4-12。2名放射医师在T2WI检出结果一致性为κ=0.670(95%置信区间:0.607,0.733),在T2WI结合ADC图检出结果一致性为κ=0.689(95%置信区间:0.630,0.748)。
肿瘤ADC值values与评分等级相关性,见图13。前列腺癌Gleason评分为≧7分的平均ADC值(779.4×10-6mm2/s)明显低于前列腺癌Gleason评分为6分的平均ADC值(874.6×10-6mm2/s),P<0.01。
3 讨 论
数个研究报道DWI结合T2WI比单独应用T2WI更能够显著提高对前列腺癌检出(83~88%、69~77%)[5]。最近Portalez等研究表明T2WI和DWI使用分区进行前列腺检查,能够发现12倍病灶壁常规T2WI,然而在正常组织与癌组织有较大重叠,因此表明DWI检测前列腺癌具有一定局限性[6]。患者组织病理学取材比例多少直接显著影响MRI定性结果[7]。Woodfield等报道[3]Gleason评分为6分肿瘤较难在ADC图发现。国外研究报道[8]评估依据Gleason评分,DWI结合T2WI能够显著增加对前列腺癌诊断准确性。T2WI结合高B值(1000s/mm2)在检测Gleason评分>6癌肿敏感性明显高于单独序列检查。然而没有观察ADC图,仅比较T2WI结合高B值图像和单独单独序列检查敏感性,没有进行ROC曲线分析。
在报道MRI对检出前列腺准确性广泛不一致,可能由于检查方法不同:经直肠超声检查活组织检查、整个组织病理学作为参考标准、将前列腺叶分成不同区域;应用直肠内或盆腔相阵线圈[9]。到目前为止,少量研究集中在MRI对前列腺癌诊断能力及与Gleason评分相关性[10]。Zakian等[11]报道应用MRI波谱对Gleason评分为6和≥8前列腺癌敏感性分别为44.4%、89.5%,Vargas等[1]MR对Gleason评分为6分肿瘤敏感性为53%~63%,同时T2WI结合ADC图对Gleason评分≧8分敏感性为100%。在本研究结果显示T2WI结合DWI对低危前列腺癌敏感性为44%~49%,对中危或高危前列腺癌敏感性为54%~81%,与上述研究结果基本一致,表明MRI检查前列腺癌取决于Gleason评分。Gleason评分为6分的小体积肿瘤与正常前列腺组织ADC值有较高重叠性,可能影响MRI检出肿瘤的敏感性,本研究未进行评估。另外,由于医师间诊断水平不同,可能影响DWI检出肿瘤敏感性。在本研究,T2WI结合ADC图对于中危或高危前列腺癌检查明显优于T2WI检查。虽然,2名医师分析结果较为一致,但经验不足对检出中危或高危敏感性较低,因此表明MRI诊断前列腺癌需要更多的临床经验。
局限性前列腺癌不同于侵袭性前列腺癌治疗方法,同时保守治疗无痛恶性肿瘤同样有效[12]。虽然动态增强扫描MRI能够提高前列腺癌诊断,但在本研究没有进行,因扫面技术的局限性[13]。最近研究发现定量动态增强扫描MRI参数与Gleason评分无相关性[14]。多个研究报道ADC值能够预测侵袭性前列腺癌[15],ADC值对于检测中危或高危前列腺癌具有较高敏感性,同时ADC值与Gleason评分呈显著负相关性,T2WI结合DWI有助于中危或高危前列腺癌检出,更有助制定治疗方案,如手术治疗或放射性治疗。活检Gleason评分与术后Gleason评分是不一致的,经直肠内超声引导活检常低估了Gleason评分值[16]。Bittencourt等[17]研究显示,测量ADC值与术后Gleason评分相关性显著优于经直肠内超声引导活检评分与术后Gleason评分相关性。然而需要进一步区别低危与中危或高危前列腺癌ADC值。
研究局限性:①尽管精确匹配同一区域大小和内部结构,如射精管,图像与逐层切片组织病理学内部联系具有一定局限性,因前列腺固定式轴索变形。②由于高危前列腺癌病例较少,所以放在中危组进行评估。③本研究在选择样本和医师间评定结果可能存在偏倚。④因高信噪比直肠内线圈在本研究单位费用较高,故仅应用盆腔表面相阵线圈。
总之,Gleason评分影响ADC值,测量ADC值影响MRI对前列腺癌诊断性,与T2WI比较。DWI结合T2WI能够增加中危或高危前列腺癌检出,但对低危前列腺癌并无显著诊断作用。
1. Vargas HA, Akin O, Franiel T,et al. Diffusion-weighted endorectal MR Imaging at 3 T for prostate cancer: tumor detection and assessment of aggressiveness[J]. Radiology,2011,259:775-784.
2. Bostwick DG, Foster CS. Predictive factors in prostate cancer: current concepts from the 1999 college of American pathologists conference on solid tumor prognostic factors and the 1999 World Health Organization second international consultation on prostate cancer[J]. Semin Urol Oncol, 1999, 17:222-272.
3. Woodfield CA, Tung GA, Grand DJ,et al. Diffusion-weighted MRI of peripheral zone prostate cancer: comparison of tumor apparent diffusion coefficient with Gleason score and percentage of tumor on core biopsy[J]. AJR Am J Roentgenol, 2010, 194: W316-322.
4. Yoshimitsu K, Kiyoshima K, Irie H et al. Usefulness of apparent diffusion coefficient map in diagnosing prostate carcinoma:correlation with stepwise histopathology[J]. J Magn Reson Imaging, 2008, 27:132-139.
5. Katahira K, Takahara T, Kwee TC et al. Ultra-high-b-value diffusion-weighted MR imaging for the detection of prostate cancer:evaluation in 201 cases with histopathological correlation[J]. Eur Radiol, 2011, 21:188-196.
6. Kim CK, Park BK, Han JJ, Kang TW, et al.Diffusion weighted imaging of the prostate at 3 T for differentiation of malignant and benign tissue in transition and peripheral zones:preliminary results[J]. J Comput Assist Tomogr, 2007, 31: 449-454.
7. Langer DL, van der Kwast TH, Evans AJ et al. Prostate tissue composition and MR measurements: investigating the relationships between ADC, T2, K(trans), v(e), and corresponding histologic features[J]. Radiology, 2010, 255:485-494.
8. Rosenkrantz AB, Mannelli L, Kong X et al. Prostate cancer:utility of fusion of T2-weighted and high b-value diffusionweighted images for peripheral zone tumor detection and localization[J]. J Magn Reson Imaging, 2011, 34:95-100.
9. Hricak H.MR imaging and MR spectroscopic imaging in the pre-treatment evaluation of prostate cancer[J]. Br J Radiol,2005,78: S103-S111.
10.Girouin N, Mège-Lechevallier F, Tonina Senes A et al. Prostate dynamic contrast-enhanced MRI with simple visual diagnostic criteria: is it reasonable[J]? Eur Radiol , 2007,17:1498-1509.
11.Zakian KL, Sircar K, Hricak H et al.Correlation of proton MR spectroscopic imaging with Gleason score based on stepsection pathologic analysis after radical prostatectomy[J]. Radiology,.2005,.234:804-814.
12.Klotz L.Active surveillance for prostate cancer: for whom[J]?J Clin Oncol,.2005,.23.8165-8169.
13.Franiel T, Hamm B, Hricak H.Dynamic contrast-enhanced magnetic resonance imaging and pharmacokinetic models in prostate cancer[J]. Eur Radiol ,.2011,.21:616-626.
14.Oto A, Yang C, Kayhan A et al. Diffusion-weighted and dynamic contrast-enhanced MRI of prostate cancer: correlation of quantitative MR parameters with Gleason score and tumor angiogenesis[J]. AJR Am J Roentgenol, 2011, 197: 1382-1390.
15.van As NJ, de Souza NM, Riches SF et al. A study of diffusionweighted magnetic resonance imaging in men with untreated localized prostate cancer on active surveillance[J]. Eur Urol, 2009, 56:981-987.
16.Corcoran NM, Hong MK, Casey RG et al. Upgrade in Gleason score between prostate biopsies and pathology following radical prostatectomy significantly impacts upon the risk of biochemical recurrence[J].BJU Int, 2011, 108: E202-210.
17.Bittencourt LK, Barentsz JO, de Miranda LC,et al. Prostate MRI: diffusion-weighted imaging at 1.5 T correlates better with prostatectomy Gleason grades than TRUS-guided biopsies in peripheral zone tumours[J]. Eur Radiol, 2012, 22: 468-475.
18.陈敏,王文超,杨正汉,等.前列腺癌的MRI分期与病理对照[J].中国CT和MRI杂志, 2004, 2(2): 32-35.
19.赵新湘,袁曙光,张琳琳,等.MRI联合3DMRSI在前列腺癌的应用研究[J].中国CT和MRI杂志,2007,5(4):39-41.
20.叶炯贤,陈泽波,吴雄辉,等.经直肠超声引导5区13针前列腺穿刺活检在前列腺癌筛查中的应用[J].罕少疾病杂志,2007,14(6): 1-4.
21.朱丹,彭涛,肖建明.MRI动态增强扫描对前列腺癌的诊断价值[J].中国中西医结合影像学杂志,2013, 11(6): 611-613.
(本文编辑: 黎永滨)
Application Value of Classification of Risks Prostate Cancer with Combined T2-weighted and Diffusion-weighted Imaging
Objectives To evaluate the value of diffusion weighted imaging (DWI) in combination with T2-weighted imaging to detect low (Gleason score≤6) and intermediate or high risk (Gleason score≥7) prostate cancer.MethodsFifty-one patients who underwent MRI examinations before prostatectomy were evaluated. Two radiologist independently scored the probability of tumour in eight regions of prostate on T2-weighted images (T2WI) and T2WI combined with apparent diffusion coefficient (ADC) maps. Data were divided into low risk and intermediate or high risk prostate cancer two groups and correlated with histopathological results.Receiver-operating characteristic curve (ROC) was used to diagnose.ResultsFor both readers, ROC of combined T2WI and ADC maps were greater than those of T2WI in intermediate or high risk (radiologist 1: 0.887, 0.859; radiologist 2:0.732 , 0.662,) prostate cancers, P<0.05, but not in low risk (radiologist 1:0.719, 0.725; radiologist 2: 0.685,0.680)prostate cancers, P>0.05. κ value of combined T2WI and ADC maps was 0.689.ConclusionsThe addition of DWI combined with T2-weighted imaging can improves the accuracy of detecting intermediate or high risk prostate cancers, but not for low risk prostate cancer detection.
Prostate Cancer; Diffusion-weighted Imaging; Magnatic Resonance Imaging
R445.2;R737.25
A
10.3969/j.issn.1672-5131.2015.03.24
王丽霞
2015-02-09

