无机化学中的脱水缩合反应
陈亚光
(东北师范大学化学学院 吉林长春130024)
两个或多个分子通过官能团的变化结合成一个新的分子并释放出小分子(水,氯化氢、甲醇或乙酸等)的反应称为缩合反应(condensation reaction)。当释放出的小分子是水分子时,称为脱水缩合反应。由缩合反应得到的新分子中反应物分子的单元数称为缩合度(condensation degree)。在有机化学反应中的缩合反应多达十余种,然而在无机化学领域中,脱水缩合反应很少被系统讨论。
1 缩合反应的分类
在周期表中,一些非金属元素和过渡金属元素的最高氧化数含氧酸可以发生分子间的脱水缩合反应。

根据缩合反应产物的缩合度和产物的状态可以将无机化学中的脱水缩合反应分为3类:低缩反应,簇缩反应和高缩反应。低缩反应是指缩合度较小的缩合反应,如焦磷酸、二硅酸、重铬酸等的生成反应;高缩反应是指缩合度很大甚至达到无限的缩合反应,如一维的聚硅酸阴离子链、二维的聚硅酸阴离子以及聚磷酸阴离子链的生成反应。硅酸和磷酸的聚合度都可以达到无限大。簇缩反应则顾名思义,生成的缩合产物是由有限个原子构成的簇状阴离子,如硼砂的阴离子、十钒酸阴离子、十铌酸阴离子、八钼酸阴离子。表1汇总了能发生脱水缩合反应的无机含氧酸的最高缩合度和缩合产物。
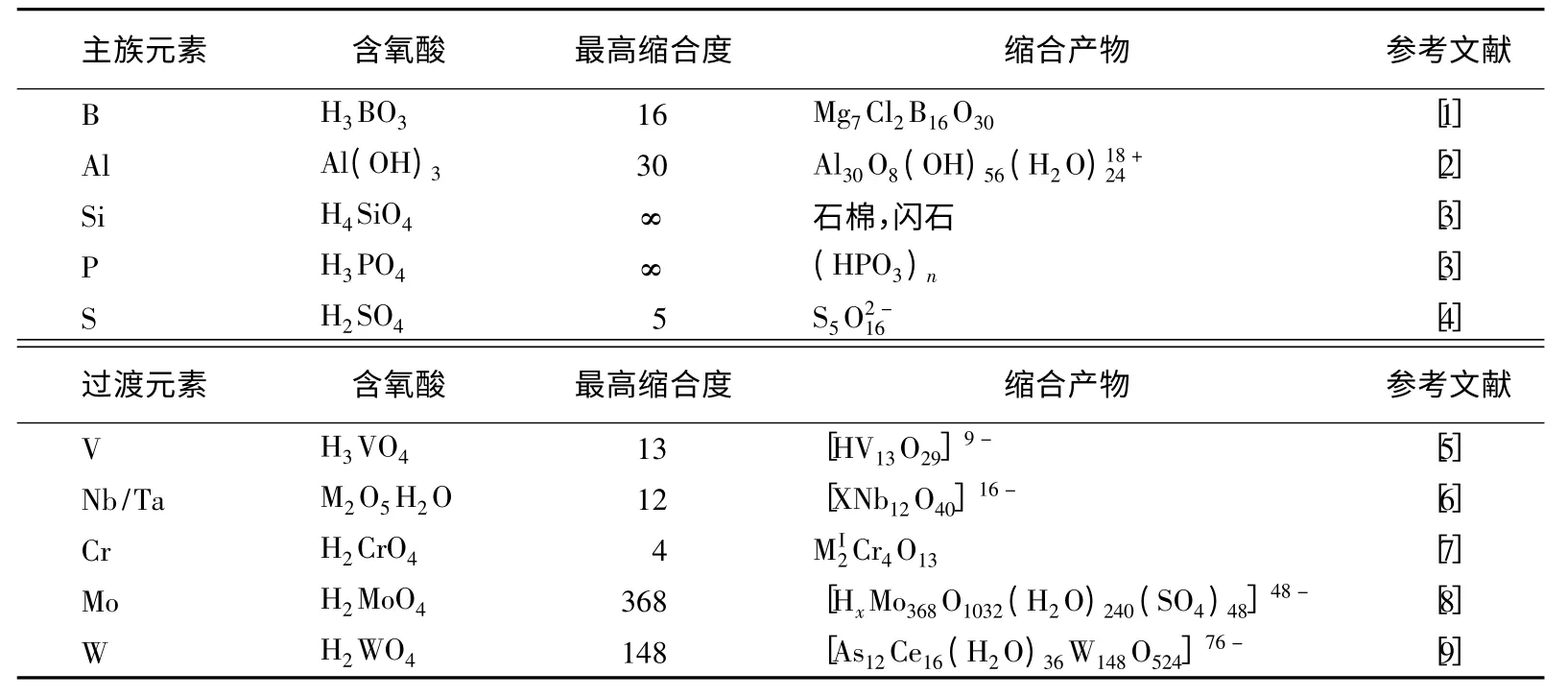
表1 无机含氧酸的缩合度和缩合产物
无机含氧酸能否发生缩合反应与以下一些因素有关:
(1)含氧酸分解产物的挥发性:例如H2CO3分解为CO2,H4SiO4的最终分解产物为SiO2,HNO3分解为NO、NO2,H3PO4分解为玻璃态的P2O5等。分解产物为易挥发氧化物的H2CO3和HNO3不能发生脱水缩合反应,而分解产物为难挥发氧化物则容易聚合成多酸。
(2)A—O键的强度:A—O键强度越大、稳定性越高,则形成的A—O—A键越稳定,即容易形成聚合多酸(盐)。B、Si元素是亲氧元素,有较强的X—O键,因此它们容易发生缩合反应,生成多聚酸。对于卤素含氧酸来说,在HClO4之间缩合去掉一个水分子后,相当于在缩合产物中一个取代了另一个HClO4分子的一个H+,高电负性的基团对另一个HClO4分子中去掉氢的氧原子产生较强的作用,使得O3ClⅦ—O—ClⅦO3中Cl—O拉长,键能降低,即缩合产物的能量高于单体的能量。在H4SiO4缩合产物中基团的电负性远低于基团的电负性,因此对去掉氢的氧原子的影响不大,Si—O键的强度变化不大,SiⅣ—O—SiⅣ中Si—O键长比H4SiO4中的Si—O键长仅长8pm,因此H4SiO4易聚合成多酸,而HClO4就不能形成多酸。因此对第三周期非金属元素最高氧化数的含氧酸来说,按硅酸>磷酸>硫酸>高氯酸的顺序,形成多酸的趋势降低。
2 缩合反应类型
2.1 含氧酸和酸式盐的缩聚反应
在周期表中,只有少数元素的含氧酸能发生脱水缩合反应:B,Si,P,S,ⅤB元素和ⅥB元素。而其中只有含氧酸和酸式盐的缩合反应是严格意义上的脱水缩合反应。例如硼酸的脱水缩合反应:

缩合产物是环状偏硼酸,进一步加热,可以得到无限长的链状偏硼酸。在自然界中,存在多种链状偏硼酸盐(如CaB2O4和Mg7Cl2B16O30(方硼石或纤维硼石))和网状偏硼酸盐(如KB5O8·4H2O等)。
磷酸经脱水缩合可以生成焦磷酸(H4P2O7)、三磷酸(H5P3O10)、环三磷酸(HPO3)3、环四磷酸(HPO3)4等。环多聚磷酸的通式可以写为(HPO3)n(n=3~7)。

含氧酸的酸式盐受热脱水生成含有缩合阴离子的盐,如:


俗称为格式盐的直链偏磷酸盐的通式为Mn+2PnO3n,当缩合度n很大(n=20~100)时,通式写为MnPnO3n。
焦硫酸盐可以通过硫酸氢盐脱水而得:

其他的多硫酸盐还有三硫酸盐S3和五硫酸盐。因为浓硫酸本身具有很强的吸水性和使其他物质脱水的能力,在硫酸分子之间进行脱水缩合反应是很困难的。

所以,一般认为焦硫酸是将SO3溶解在浓硫酸中,冷却析出的固体物质。当SO3的浓度较高时,发烟硫酸中还含有H2S3O10和H2S4O13两种缩合酸[1]。
2.2 酸化含氧酸盐溶液的缩合反应
当单核含氧酸溶解度较小或为难溶物质时,脱水缩合反应不是发生在单核酸分子之间,而是在用其他的强酸来酸化这些含氧酸盐的水溶液时发生。酸化时首先发生含氧酸根离子的质子化反应,然后,在质子化的含氧酸根离子之间发生脱水缩合反应。在无机化学教材中常以钒酸的缩合反应为例进行说明[7]:

按上面的过程进行缩合反应的含氧酸还有铬酸、钼酸和钨酸[3]:

钼酸和钨酸的缩合度可以达到很高。已见报道的高缩合度的簇状多钼酸阴离子有
实际上,硅酸的脱水缩合反应(硅溶胶的生成)也是按此过程进行的。在硅酸盐溶液中,存在着质子化的SiO2(O。当溶液被酸化时,这些离子之间发生复杂的缩合反应,生成多种多硅酸,多硅酸的状态从可溶(溶胶)到难溶(凝胶)。最简单的多硅酸是焦硅酸H6Si2O7和三硅酸H4Si3O8。硅酸的脱水缩合反应的最终产物是硅凝胶。各种多硅酸盐广泛存在于自然界中,如链状多硅酸盐石棉、片状多硅酸盐云母等[3]。
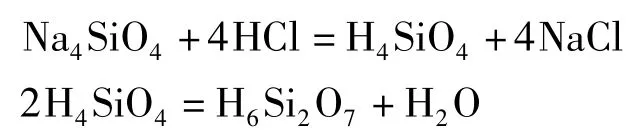
当溶液中存在两种含氧酸根离子时,酸化该溶液会得到含两种元素的缩合产物,通常称这些产物为杂多酸(盐)[11]。例如:
钒元素也能生成杂多酸(盐),但其数量远少于钼和钨的杂多酸(盐)。例如[MnⅣV13O39]9-[12]和[HxPV14O42](9-x)-[13]。
钒、钼和钨的含氧酸(盐)的缩合反应和缩合产物构成了无机化学的一个分支——多酸化学。
2.3 碱性条件下的簇状化合物的生成
与钒元素同族的铌和钽元素的最高氧化数的含氧酸非常不稳定,在水溶液中,它们以难溶的氧化物的水合物形式存在。这些氧化物的水合物与强碱在熔融的条件下,可以转化为缩合度为6的簇状多酸阴离子[7]:

Nb6存在于pH>7的水溶液中,而Ta6只能存在于pH>10的水溶液中。在水热条件下处理铌氧化物的水合物,得到更高缩合度的同多酸和杂多酸(盐)[6,14]:

铝的水合离子可以看作是质子酸。它在碱性条件下也能进行缩合反应,生成簇状阳离子[15]:
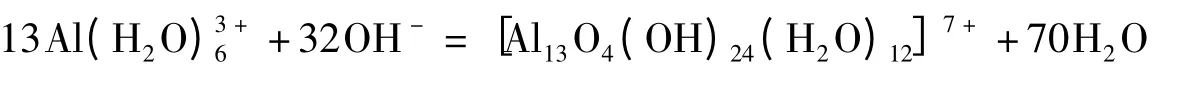
3 缩合反应及缩合产物的应用
含氧酸的缩合产物呈现不同的形态和性质,这使得它们可以广泛地应用在生产生活中。
3.1 硼砂珠实验[3]
硼砂受热脱水的产物具有路易斯酸性,因此它能与碱性金属氧化物作用,生成复合偏硼酸盐NaBO2·MⅡ(BO2)2。过渡金属离子的颜色不同,硼砂珠也呈现不同的颜色,例如铁在氧化焰灼烧后硼砂珠呈黄色,在还原焰灼烧呈绿色。借此建立起一种定性分析方法,用来鉴别过渡金属离子。
3.2 硅胶
硅胶是硅酸的缩合产物凝胶干燥后的产物。硅胶具有很大的比表面积,对水有很强的吸附能力。因此硅胶是药品、机械、光学电子、精密仪器、仪表、种子、加工食品、茶叶、各种化纤纺织、皮鞋、皮革、运动鞋以及文物档案、照相机、工艺美术品等需要防潮防霉的物品存放过程中所用的干燥剂。硅胶分为无色和显色两种形式。显色硅胶是借助一种与不同量水结合而呈现不同颜色的化学物质实现指示环境湿度的目的。常用的变色剂是蓝色的CoCl2。近年开发一种无钴变色硅胶,变色剂是混合有机物,当未受潮时呈橘黄色。吸潮后逐渐变成浅绿色,继续吸潮变成墨绿色。
3.3 聚磷酸盐[16-17]
聚磷酸盐的种类较多。Na2H2P2O7大量用于食品加工中,用作调节发酵酸和制作罐头防腐剂。Na4P2O7用于工业电镀液的配料,羊毛脱脂剂,工业洗涤剂,H2O2的稳定剂,印染精漂助剂和食品添加剂。K4P2O7由于具有很高的水溶性,用作液体洗涤剂的有效成分。CaH2P2O7用作食品添加剂和膨胀剂。Ca2P2O7在含氟牙膏中作为磨擦剂,在金属抛光时作为软质研磨剂。
三聚磷酸钠除用作合成洗涤剂的助剂和软水剂外,因对油脂、泥土有悬浮、分散、胶溶和乳化作用,亦广泛用于火腿、熏肉的加工保藏,用作钻井泥浆和矿石浮选液的分散剂,陶土分散剂,及用于橡胶和油漆的制造等。K5P3O10用作多价螯合剂和液体洗涤剂的组分。
格氏盐是一种水溶性的聚磷酸盐玻璃体,具有近似于(NaPO3)50的组成。它是一种具有高相对分子质量的聚磷酸盐玻璃体(90%)和各种环状偏磷酸盐(10%)的混合物。格氏盐主要用于软化剂、缓蚀剂、浮选剂、分散剂、高温黏接剂以及食品品质改良剂。
马氏盐(NaPO3)n是一种长链结晶状的水不溶性聚偏磷酸盐。马氏盐可用作含氟牙膏中的磨擦剂,耐磨无机润滑剂等。
库氏盐是一种高相对分子质量(2.5×105~106)的纤维状晶体聚磷酸盐。聚合度与温度及加热时间的长短有关。库氏钠盐和钾盐都是水不溶性的,但在其他碱金属阳离子存在时形成黏滞性溶液;钾盐还可用于红肠加工中。
长链聚磷酸铵是一种结晶状物质。约在350℃时分解,放出氨后留下一层交联的超磷酸盐的韧性物质薄膜,使膜下物质与空气中氧隔绝,因而长链聚磷酸铵可作为灭火粉、耐火涂料的阻燃剂及供泡沫塑料的耐火处理用。
聚磷酸钙纤维是很细的纤维状晶体,可在许多应用中代替石棉,尤其适用于使用石棉会对人体健康造成危害的场合。
聚磷酸也是人体的非常重要的组成物质。聚磷酸在人脑、肝、外周血单核细胞、红细胞、成骨细胞、成纤维细胞中具有较高的水平。在哺乳动物中,聚磷酸的作用有:调节瞬时电位melastatin 8(transient receptor potentialme lastatin 8,TRPM8);调节哺乳动物雷帕霉素靶蛋白;调节线粒体代谢和Ca2+相关性细胞死亡;调节细胞的钙化;调节血液凝固。
三磷酸腺苷是体内广泛存在的辅酶,是体内组织细胞一切生命活动所需能量的直接来源,参与蛋白质、脂肪、糖和核苷酸的合成。
3.4 钼和钨的同多酸和杂多酸盐[18-19]
钼和钨的同多酸和杂多酸盐最早用在分析化学中,利用有色杂多酸阴离子的生成来定量测定样品中的铵、硅和磷的含量。例如,下面反应生成的黄色晶体说明或的存在:

或者利用还原的杂多酸(盐)对Si、P、As进行分光光度法的定量分析。据报道有26个元素可以利用杂多酸的生成进行定量检测。在生物化学中,还原型的杂多酸(盐)被用来进行生物标本的染色。
钼和钨的同多酸和杂多酸盐的更多的应用是基于它们的氧化还原性和杂多酸的强酸性。在20世纪80年代已有杂多酸作为酸催化剂催化烯烃水合制异丙醇、异丁醇的生产工艺、作为氧化催化剂催化2-甲基丙烯醛氧化生成2-甲基丙烯酸的生产工艺实现了工业化。
[1]科顿F A,威尔金森G.高等无机化学(上册).北京大学等译.北京:人民教育出版社,1980
[2]Allouche L,Taulelle F.Ⅰnorg Chem Commun,2003,6:1167
[3]刘新锦,朱先亚,高飞.元素无机化学.北京:科学出版社,2005
[4]格林伍德N N,厄恩肖A.元素化学(中).李学同译.北京:高等教育出版社,1996
[5]Pettersson L,Andersson I,Howarth O W.Ⅰnorg Chem,1992,31:4032
[6]Bonhomme F,Larentzos J P,Alam T M,et al.Ⅰnorg Chem,2005,44:1774
[7]科顿F A,威尔金森G.高等无机化学(下册).北京大学等译.北京:人民教育出版社,1980
[8]Müller A,Beckmann E,Bögge H,et al.Angew ChemⅠnt Ed,2002,41:1162
[9]Wassermann K,Dickman M H,Pope M T.Angew ChemⅠnt Ed Eng,1997,36:1445
[10]Müller A,Krickemeyer E,Meyer J,et al.Angew ChemⅠnt Ed,1995,34:2122
[11]Pope M T.杂多和同多多金属氧酸盐.王恩波译.长春:吉林大学出版社,1991
[12]Flynn C M,Pope M Y.J Am Chem Soc,1970,92:85
[13]Selling A,Andenson I,Pettersson L,et al.Ⅰnorg Chem,1994,33:3141
[14]Ohlin C A,Villa E M,Casey W H.Ⅰnorg Chim Acta,2009,362:1391
[15]Billika P,Horvath B.Ⅰnorg Chem Commun,2008,11:1125
[16]贡长生.自然杂志,1987,10:578
[17]石廷玉,王怀林,谢建平.生理科学进展,2011,42:181
[18]Jeannin Y,HervéG,Proust A.Ⅰnorg Chim Acta,1992,198-200:319
[19]Pope M T,Müller A.Angew ChemⅠnt Ed Engl,1991,30:34

