弓形虫入侵的宿主细胞骨架重塑触发线粒体重新分布
吴 亮,王 晓,苏丹华,刘 原,付 涛,姜旭淦,陈盛霞,曹建平
弓形虫入侵的宿主细胞骨架重塑触发线粒体重新分布
吴 亮1,2,王 晓2,苏丹华2,刘 原2,付 涛2,姜旭淦2,陈盛霞2,曹建平1
目的 探讨宿主细胞骨架重塑在弓形虫侵入HFF细胞以及触发细胞线粒体重新分布中的作用。方法 体外培养HFF细胞,预先用1 μg/mL细胞松驰素D(CD)处理30 min,接种弓形虫速殖子分别培养1 h和20 h,Western blotting检测弓形虫表面抗原(surface antigen,SAG)1蛋白表达。同时用MitoTracker®Red CMXRos荧光探针标记细胞线粒体,激光共聚焦显微镜下观察HFF细胞线粒体在弓形虫侵入前后和CD处理前后聚集和分布情况。结果 感染后1 h,CD处理组HFF细胞内虫体量与CD未处理组差异不大,20 h时CD未处理组细胞内虫体量显著多于CD处理组。此时可见HFF细胞线粒体明显聚集成明亮点状且分布于纳虫泡周围,而未感染组细胞线粒体未见明显聚集分布。CD可以显著抑制弓形虫侵入HFF细胞后引起的线粒体聚集。结论 触发宿主细胞骨架重塑是弓形虫侵入宿主细胞并引起细胞线粒体向纳虫泡聚集所必须的。
弓形虫;细胞骨架重塑;侵入;线粒体重新分布
Supported by the National Natural Science Foundation of China (No. 81301453), the Laboratory of Parasite and Vector Biology of China, MOPH (No. WSBKTKT201302), the Special Foundation of China Postdoctoral Science (No.2015T80518), the
China Postdoctoral Science Foundation (No.2014M561598), the Jiangsu Postdoctoral Science Foundation (No.1402171C), and the Senior Talent Studying Initial Funding of Jiangsu University (Nos.13JDG023 & 13JDG127) Corresponding authors: Chen Sheng-xia, Email: chensxia@163.com; Cao Jian-ping, Email: caojp@yahoo.com
弓形虫是一种广泛流行的专性细胞内寄生虫,可以侵入人体所有的有核细胞(包括吞噬细胞和非吞噬细胞),并在细胞内长期存活。大量研究证实弓形虫突破非吞噬细胞的细胞膜屏障,侵入细胞过程中伴随着触发宿主细胞骨架重塑(cytoskeleton rearrangement)[1]。细胞骨架是真核细胞中由蛋白纤维构成的复杂网络状结构,包括微丝(microfilament)、微管(microtubule)和中间纤维(intemediate filament),是构成细胞膜以及维持细胞形态的结构基础[2]。弓形虫侵入细胞面临的第一个障碍就是细胞膜屏障,但目前对于虫体触发宿主骨架重塑与突破细胞膜屏障之间的联系并不明晰。
弓形虫侵入宿主细胞后可以诱导被感染细胞线粒体向虫体周围特异性聚集[3]。线粒体是合成能量和脂质的重要场所,哺乳动物细胞内通常都含有大量线粒体,而弓形虫速殖子仅有一个线粒体[4]。推测仅有一个线粒体似乎无法满足虫体在细胞内快速增殖的能量和物质需求,诱导宿主线粒体向虫体周围靠近,利用宿主细胞线粒体中物质与能量就成为弓形虫的一个必然选择[3]。虽然现已证实弓形虫的侵入伴随着宿主细胞线粒体向虫体周围聚集,但对于弓形虫触发宿主细胞线粒体重新分布的机制目前尚不清楚。哺乳动物细胞的细胞骨架相互交错构成骨架网络结构,不仅是细胞器移动的交通导轨,细胞骨架发生重塑时的收缩或舒张也起到牵引细胞器,帮助其移动的作用,因此线粒体等细胞器重新分布的本质是细胞骨架重塑进而牵拉所造成[5]。本研究拟用细胞骨架重塑特异性抑制剂—细胞松弛素D(cytochalasin D, CD)抑制细胞骨架重塑,探讨细胞骨架重塑在弓形虫侵入、增殖和触发细胞线粒体重新分布中的作用。
1 材料与方法
1.1 材料
1.1.1 虫体和细胞 弓形虫RH株速殖子由本课题组长期传代保种。人包皮成纤维(human foreskin fibroblast, HFF)细胞由本课题组自行原代培养[6],选取6~20代HFF细胞用于弓形虫速殖子体外培养及本实验研究。
1.1.2 主要试剂和仪器 DMEM细胞培养液购自赛默飞世尔科技(中国)有限公司,胎牛血清购自杭州四季青生物工程材料有限公司。线粒体红色探针MitoTracker®Red CMXRos购自美国invitrogen公司,兔抗弓形虫SAG1多克隆抗体由本课题组制备,细胞松弛素D(CD)购自美国Sigma公司,辣根过氧化物酶标记的羊抗兔抗体(HRP-IgG)和ECL发光显色试剂盒购自武汉博士德生物有限公司,DAPI染液和抗荧光淬灭封片剂购自南通碧云天生物有限公司,激光共聚焦显微镜为德国Leica公司,其他试剂均为国产分析纯。
1.2 方法
1.2.1 弓形虫速殖子体外培养 按本课题组报道方法[7],在T25细胞培养瓶中培养HFF细胞,待细胞生长至单层细胞后接种弓形虫速殖子1×106个,置于37 ℃、5% CO2条件下培养1 h,吸弃旧培养液,以无菌磷酸盐(PBS)缓冲液充分洗涤细胞,除去未进入细胞的虫体,添加新培养液,继续置于37 ℃、5% CO2条件下培养至虫体涨破HFF细胞后,以长颈滴管反复吹打瓶壁收集虫体。虫体经适当稀释后继续接种新HFF细胞或用于后续研究。
1.2.2 Western blotting检测SAG1蛋白表达 6孔细胞培养板中培养HFF细胞,待其生长至单层细胞后预先以1 μg/mL CD处理30 min,接种弓形虫RH株速殖子,每孔5×105个,置于37 ℃、5% CO2条件下培养1 h后吸弃培养液,以PBS轻柔洗涤细胞2次,除去未粘附或侵入细胞的虫体。用细胞刮刀刮取生长于细胞培养板内细胞,连同虫体一并以12 000×g离心收集保存于1.5 mL离心管中。另于感染20 h时以同样方法收集细胞和虫体。同时设未加CD对照组,每组3个复孔。
于收集的虫体中加入2×SDS-PAGE上样缓冲液,煮沸5 min,离心取上清进行SDS-PAGE电泳。分离胶浓度为15%,120 V电泳120 min,直至溴酚蓝指示剂达到凝胶底部。恒流150 mA转印50 min将蛋白转移至NC膜。5%脱脂奶粉室温下封闭1 h,加抗SAG1多克隆抗体(1∶2 000)室温孵育1 h,TBST缓冲液洗涤3次,每次10 min。加HRP-羊抗兔IgG(1∶5 000)室温孵育1 h,TBST缓冲液洗涤3次,每次10 min。吸尽膜上残留水滴,滴加ECL液显色并照相记录。
1.2.3 细胞线粒体分布检测 预先在6孔细胞培养板各孔中放置1块18 mm×18 mm载玻片后培养HFF细胞,待细胞生长至单层细胞后预先以1 μg/mL CD处理30 min,接种弓形虫RH株速殖子,每孔5×105个,同时设未接种虫体对照组和未加CD对照组。置于37 ℃、5% CO2条件下培养1 h后吸弃培养液,以PBS轻柔洗涤细胞2次,除去未粘附或侵入细胞的虫体。各孔中重新添加培养液,并加入终浓度为200 nmol/L线粒体荧光探针,置于37 ℃染色20 min后吸弃染液,以PBS洗涤2次后加入DAPI染液,室温下避光染色10 min,PBS洗涤2次后滴加抗荧光淬灭封片剂保存于-20 ℃。细胞和虫体继续培养至20 h时,重复上述操作。染色后标本于激光共聚焦显微镜下观察线粒体分布。
2 结 果
2.1 CD对弓形虫增殖的影响 接种弓形虫1 h,CD处理组虫体数量与未处理组差异无统计学意义(P>0.05)。继续培养至20 h时,未处理组虫体数量显著增多(P<0.05)(图1)。
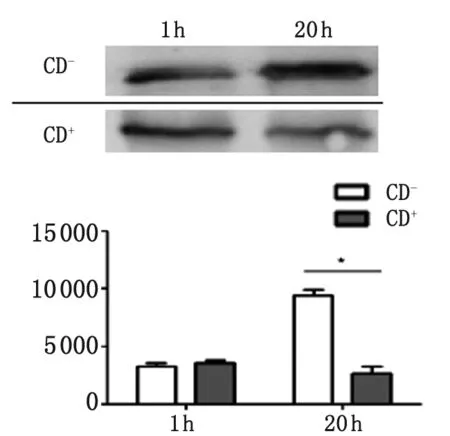
CD-: un-treaed group; CD+: treated group; *: P<0.05.图1 弓形虫在CD处理HFF细胞中增殖能力
Fig.1T.gondiiproliferation in HFF cell treated with cytochalasin D
2.2 弓形虫侵入触发HFF细胞线粒体聚集 在激光共聚焦显微镜下可见细胞核与虫体细胞核呈蓝色荧光,HFF细胞线粒体呈红色荧光。速殖子和HFF细胞的核均不被MitoTracker®Red CMXRos着色。感染组HFF细胞内见大量明亮红色荧光聚集成点状并围绕于纳虫泡(parasitophorous vacuole,PV)周围;而未感染组HFF细胞内红色荧光均匀地分布细胞胞浆中,且少见红色荧光聚集成点状(图 2)。
2.3 CD对弓形虫触发HFF细胞线粒体聚集的影响 HFF细胞预先以1 μg/mL CD处理30 min后再接种弓形虫共孵育20 h,在激光共聚焦显微镜下未见明显的细胞内红色荧光聚集成点状。PV周围红色荧光分布均匀,未聚集成点状。CD未处理组HHF细胞被弓形虫侵入后,在激光共聚焦显微镜下可见细胞内大量红色荧光聚集成点状,细胞内PV周围可见大量红色点状荧光(图3)。
3 讨 论
弓形虫能够侵入哺乳动物非吞噬细胞和吞噬细胞[1]。非吞噬细胞不具备主动摄取或吞噬能力,弓形虫必须具备一套主动侵入机制才能成功进入非吞噬细胞。研究发现多种细菌都可以通过触发宿主细胞骨架重塑,引起细胞膜结构疏松,为细菌侵入细胞创造有利条件[8]。弓形虫侵入过程中也伴随一系列与细胞骨架重塑相关的现象,如线粒体等细胞器重新分布等。但目前尚无研究证实弓形虫侵入和触发细胞线粒体重新分布与宿主细胞骨架重塑有关。
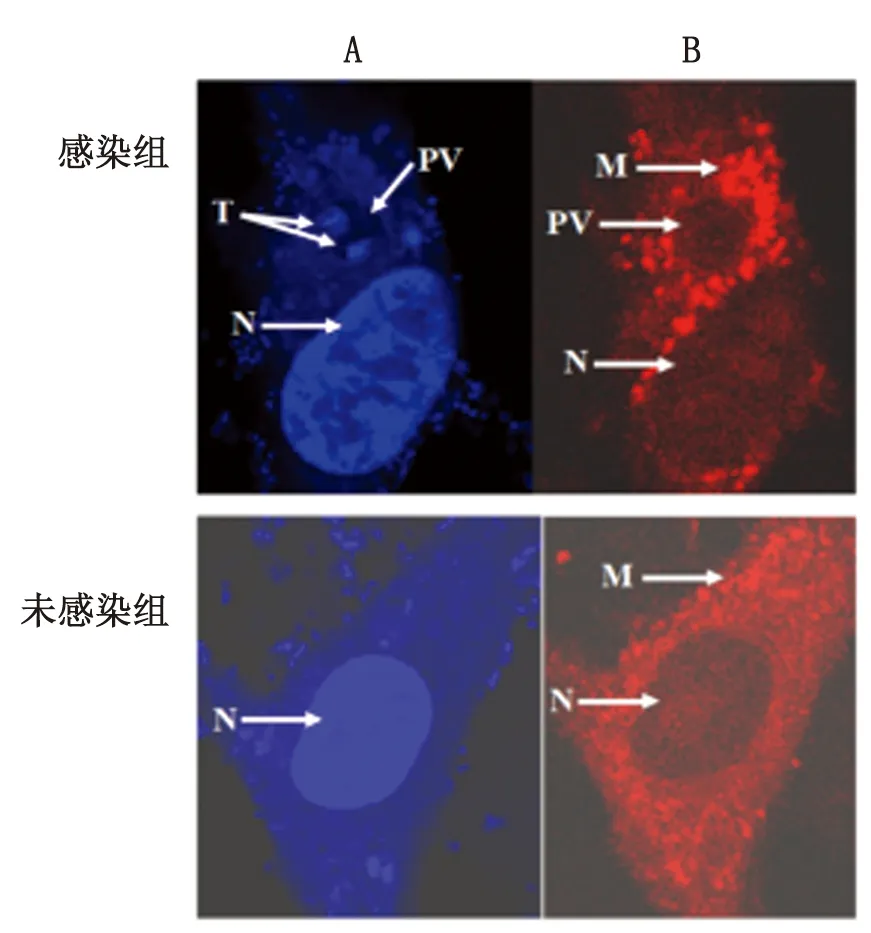
N: HFF cell nucleus; T:T.gondiinucleus; PV: parasitophorous vacuoles; M: mitochondria
A: DAPI; B: MitoTracker®Red CMXRos
图2 弓形虫侵入触发HFF细胞线粒体聚集
Fig.2 HFF mitochondria rearrangement triggering byT.gondiiinvasion

N: HFF cell nucleus; T:T.gondiinucleus; PV: parasitophorous vacuoles; M: mitochondria.
A: DAPI; B: MitoTracker®Red CMXRos
图3 CD抑制弓形虫触发HFF细胞线粒体聚集
Fig.3 HFF mitochondria rearrangement suppressed by CD
细胞松驰素D(CD)常用于病原体侵入与细胞骨架重塑的研究[9]。CD通过特异性破坏细胞骨架重要成份—肌动蛋白,从而抑制细胞骨架重塑,但对细胞内其他成份无影响,不会抑制细胞生长,是一种理想的细胞骨架重塑抑制剂。
弓形虫侵入非吞噬细胞的过程复杂,可大致分为3个步骤。首先,虫体主动靠近并紧密地粘附于宿主细胞;其次,调控宿主细胞膜向内凹陷,虫体通过类锥体端进入细胞;最后,侵入处细胞膜重新封闭形成PV[10]。在PV形成的同时,宿主细胞线粒体和内质网会特异性向PV靠近[3],而细胞吞噬体则远离PV[11]。目前认为,哺乳动物细胞膜形态结构的改变以及细胞器分布位置变化,都是由细胞骨架重塑所引起。
本研究发现,感染1 h时阻断细胞骨架重塑并未显著的减少细胞内虫体数量,原因是,CD并不影响虫体粘附于HFF细胞表面,因此通过Western blotting检测CD处理组与未处理组细胞内虫体数量差异不明显。但20 h时,阻断细胞骨架重塑可以显著地减少细胞内虫体数量,其原因在于,CD阻断宿主细胞骨架重塑虽然不能阻止虫体粘附于宿主细胞,但可以阻止虫体侵入细胞,从而影响虫体在细胞内增殖。弓形虫侵入宿主细胞后触发宿主线粒体重新分布并向PV聚集,但线粒体重新分布效应被细胞骨架重塑抑制剂CD阻断。该结果表明,弓形虫通过触发宿主细胞骨架重塑引起细胞线粒体重新分布,细胞骨架对虫体侵入和宿主线粒体重新分布具有重要意义。在下一阶段研究中,拟寻找弓形虫触发细胞骨架重塑的关键因子,完善弓形虫侵入机制,为弓形虫病的治疗提供新思路。
[1]Morisaki JH, Heuser JE, Sibley LD. Invasion ofToxoplasmagondiioccurs by active penetration of the host cell[J]. J Cell Sci, 1995, 108 ( Pt 6): 2457-2464.
[2]Jamora C, Fuchs E. Intercellular adhesion, signalling and the cytoskeleton[J]. Nat Cell Biol, 2002, 4(4): E101-E108.
[3]de Melo EJ, de Carvalho TU, de Souza W. Penetration ofToxoplasmagondiiinto host cells induces changes in the distribution of the mitochondria and the endoplasmic reticulum[J]. Cell Struct Funct, 1992, 17(5): 311-317.
[4]Melo EJ, Attias M, de Souza W. The single mitochondrion of tachyzoites ofToxoplasmagondii[J]. J Struct Biol, 2000, 130(1): 27-33.
[5]Frederick RL, Shaw JM. Moving mitochondria: establishing distribution of an essential organelle[J]. Traffic, 2007, 8(12): 1668-1675.
[6]Wu L, Zhang QX, Li TT, et al.Invitroculture ofToxoplasmagondiitachyzoites in HFF and Hela cells[J]. Chin J Parasitol Parasit Dis, 2009, 27(3): 229-231. (in Chinese) 吴亮, 章秋霞, 李婷婷, 等. 人包皮成纤维细胞和人子宫颈癌细胞体外培养弓形虫速殖子[J]. 中国寄生虫学与寄生虫病杂志, 2009, 27(3): 229-231.
[7]Wu L, Chen SX, Li LJ, et al.Invitroculture of tachyzoites ofToxoplasmagondiiRH strain in HeLa cells[J]. Chin J Parasitol Parasit Dis, 2008, 26(6): 452-456. (in Chinese) 吴亮, 陈盛霞, 李琳婕, 等. 刚地弓形虫RH株速殖子在HeLa细胞系体外培养的实验观察[J]. 中国寄生虫学与寄生虫病杂志, 2008, 26(6): 452-456.
[8]de Souza SM, Orth K. Subversion of the cytoskeleton by intracellular bacteria: lessons fromListeria,SalmonellaandVibrio[J]. Cell Microbiol, 2015, 17(2): 164-173.
[9]Cai Y, Postnikova EN, Bernbaum JG, et al. Simian hemorrhagic fever virus cell entry is dependent on CD163 and uses a clathrin-mediated endocytosis-like pathway[J]. J Virol, 2015, 89(1): 844-856.
[10]Salamun J, Kallio JP, Daher W, et al. Structure ofToxoplasmagondiicoronin, an actin-binding protein that relocalizes to the posterior pole of invasive parasites and contributes to invasion and egress[J]. FASEB J, 2014, 28(11): 4729-4747.
[11]Zhao Y, Marple AH, Ferguson DJ, et al. Avirulent strains ofToxoplasmagondiiinfect macrophages by active invasion from the phagosome[J]. Proc Natl Acad Sci USA, 2014, 111(17): 6437-6442.
Cytoskeleton rearrangement and mitochondria re-distribution of host cells inToxoplasmagondiiinvasion
WU Liang1,2,WANG Xiao2,SU Dan-hua2,LIU Yuan2,FU Tao2,JIANG Xu-gan2,CHEN Sheng-xia2,CAO Jian-ping1
(1.NationalInstituteofParasiticDiseases,ChineseCenterforDiseaseControlandPrevention,Shanghai200025,China;2.SchoolofMedicine,JiangsuUniversity,Zhenjiang212013,China)
We explored the role of host cell cytoskeleton rearrangement in mitochondria re-distribution duringToxoplasmagondiiinvasion. HFF cells were treated with cytochalasin D (CD) for 30 min, andT,gondiitachzyoites were co-cultured with HFF cells for 1 h and 20 h, respectively. After co-culture, the tachyzoite SAG1 protein was determined by Western blotting. The HFF cell mitochondria were labeled by MitoTracker Red CMXRos fluorescence probe. The HFF cell mitochondria distribution was observed by Confocal microscope inT.gondiiinfected group and CD treated group. After infection for 1 h, the number ofT.gondiitachyzoites had no significant difference between CD treated group and normal group. After infected for 20 h, the number ofT.gondiitachyzoites in normal group was much more than that in CD treated group. After 20 h’s infection, the bright point type of mitochondria gathered beside parasitophorous vacuoles (PVs) in infected group. In normal group, we did not observe the mitochondria aggregation. However, HFF cell mitochondria rearrangement triggered byT.gondiicould be suppressed by cytochalasin D. Triggering of host cell cytoskeleton rearrangement is necessary forT.gondiiproliferation and host cell mitochondria rearrangement to PVs.
Toxoplasmagondii; cytoskeleton rearrangement; invasion; mitochondria rearrangement
国家自然科学基金(No.81301453),卫生部寄生虫病原与媒介生物学重点实验室开放课题(No.WSBKTKT201302), 中国博士后科学基金特别资助(No.2015T80518),中国博士后科学基金(No.2014M561598),江苏省博士后科研计划(No.1402171C),江苏大学高级人才启动基金(No.13JDG024,No.13 JDG127)联合资助
1.陈盛霞,Email:chensxia@163.com 2.曹建平,Email:caojp@yahoo.com
1.中国疾病预防控制中心寄生虫病预防控制所,上海 200025; 2.江苏大学医学院,镇江 212013
10.3969/j.issn.1002-2694.2015.11.003
R382
A
1002-2694(2015)11-1001-04
2015-05-20;
2015-08-23

