人转铁蛋白含量同位素稀释质谱测定方法研究
李佳乐,武利庆,刘文丽,金有训,陈鸿飞,杨 彬,杨 屹
(1.北京化工大学,北京 100029;2.中国计量科学研究院,北京 100013;3.南京市计量监督检测院,江苏 南京 210037)
人转铁蛋白含量同位素稀释质谱测定方法研究
李佳乐1,武利庆2,刘文丽2,金有训2,陈鸿飞3,杨 彬2,杨 屹1
(1.北京化工大学,北京 100029;2.中国计量科学研究院,北京 100013;3.南京市计量监督检测院,江苏 南京 210037)
建立一种人转铁蛋白(hTRF)纯品含量同位素稀释质谱测定方法。人转铁蛋白经酸水解后,以水(含0.8mmol/L全氟庚酸和0.1%三氟乙酸)和乙腈为流动相,以氨基酸国家标准物质为标准,同位素标记氨基酸为内标,采用高效液相色谱-同位素稀释联用法对水解液中的脯氨酸、缬氨酸和苯丙氨酸进行测定,并进一步计算得出蛋白纯品的含量。同时采用质量平衡法测定人转铁蛋白的含量,验证所建方法的可行性。在优化的条件下,人转铁蛋白含量测定结果为0.830 g/g,相对标准偏差为0.6%,扩展不确定度为0.014 g/g(k=2),检出限和定量限分别为3.78×10-5g/g和1.26×10-4g/g。所建方法准确度高、溯源清晰,可作为人转铁蛋白纯品标准物质的定值方法,对于建立我国人转铁蛋白测定结果的量值溯源传递体系具有积极的意义。
人转铁蛋白;定量;同位素稀释质谱法;质量平衡法
0 引 言
人转铁蛋白(human transferrin,hTRF)是由肝脏合成的一种与三价铁结合的糖蛋白,不仅在人体中输运铁,还是一种重要的疾病诊断标志物。
血清中hTRF的检测通常采用免疫法、液相色谱法、液相色谱-质谱联用(LC-MS)法。Johnson和赵光斌等[1-2]均采用放射免疫法检测并定量了hTRF。Srikrishnan等[3]将亲硫相互作用色谱法运用于血清中hTRF的测定。Wang等[4]采用18O标记和液质联用技术定量了人血清中的hTRF。根据ISO 17511——2003《体外诊断医疗器械-生物样品中量的测量-校准品和控制物质赋值的计算学溯源性》[5],需要研制可溯源到SI单位、含量准确的高纯蛋白作为标准,以保证不同时间、不同地域实验室检测结果的准确可比;因此,必须建立高准确度的hTRF纯品含量测定方法。
对于蛋白纯品的定量,目前主要有氨基酸分析、质量平衡、定量核磁和同位素稀释质谱(IDMS)技术。氨基酸分析是将蛋白质水解成氨基酸后,在氨基酸分析仪上通过紫外或荧光检测分析蛋白质含量[6]。戴新华等[7]采用质量平衡法测定了L-缬氨酸的纯度,证实该方法是一种准确度较高的方法。黄挺等[8]对定量核磁共振法做了深入研究,证实该方法可用于化合物的纯度定值和含量测定,具有较好的精密度和重复性。Muñoz等[9]采用基于4种氨基酸的IDMS技术准确测定了多种蛋白和多肽,并对比定量结果与氨基酸分析结果,表明该方法操作简单,准确度和精密度较高。因此,本文主要建立了hTRF的同位素稀释质谱方法,并用纯度扣除法进行验证。
1 仪器及试剂
三重四极杆液质联用(TSQ Vantage LC-MS MS):美国Thermo公司;高效液相色谱仪:Agilent 1200型,美国安捷伦公司;垂直电泳槽:美国伯乐公司;MALDI-TOF-MS:美国Bruker公司;天平:ME235S型,感量0.01 mg,德国Satorius公司;离心干燥机:RC10-22T型,美国Thermo公司;烘箱:UFE500,德国Memmert公司;移液器(10,20,100,200,1000μL):法国Gilson公司;超纯水系统:Milli-Q型,美国MILLIPORE公司;卡尔费休水分测定仪:DL39型,德国Mettler Toledo公司;马弗炉:FP31型,日本Yamato公司。
标记氨基酸(13C5-脯氨酸,13C9-苯丙氨酸,13C5-缬氨酸):美国剑桥同位素实验室;脯氨酸(GBW(E)100084,Pro)、苯丙氨酸(GBW(E)100061,Phe)、缬氨酸(GBW(E)100055,Val)国家标准物质:中国计量科学研究院;芥子酸(SA):美国Bruker公司;α-氰基-4-羟基苯丙烯酸(HCCA):美国Bruker公司;hTRF:北京安必奇生物科技有限公司:全氟庚酸(PHFA):美国Sigma-Aldirich公司;三氟乙酸(TFA):中国DikmaPure公司;乙腈(MeCN):美国J.T Baker公司;蛋白质预制胶:7 cm×8 cm,胶厚1.0 mm,美国伯乐公司;10×SDS缓冲溶液:北京鼎国昌盛生物技术有限责任公司;彩虹预染宽分子量蛋白Marker(10~260kD),中国中科瑞泰公司;乙二胺四乙酸二钠(EDTA-2Na):北京国药集团化学试剂有限公司;胰蛋白酶:美国Promega公司;二硫苏糖醇(DTT):美国Sigma-Aldirich公司;碘乙酰胺(IAA):美国Sigma-Aldirich公司;Rapigest变性剂:美国Waters公司;胰蛋白酶(Trypsin):美国Promega公司;碳酸氢铵:广东西陇化工股份有限公司;Milli-Q超纯水;其余试剂均为分析纯。
2 hTRF基本性质表征
2.1 SDS-PAGE纯度测定
将蛋白质预制胶放入垂直电泳槽内,倒入电泳缓冲液(1×),充分浸泡预制胶。将1 mg/mL的hTRF水溶液和上样缓冲液以50:20(ν:ν)的比例加入1.5mL离心管中,在100℃水浴锅中煮沸10min,取出静置。将彩虹预染宽分子量蛋白Marker从-20℃取出,放至室温,离心待用。在蛋白预制胶的每个孔中上样10μL后开始电泳分析。结束后用考马斯亮蓝染色1h,加脱色液(水、甲醇和冰醋酸以5:4:1(ν:ν:ν)的比例配制)过夜脱色。电泳条件:电压100V,电泳时间90min。
2.2 MALDI-TOF分子量测定
将1mg/mL的hTRF水溶液用0.1%甲酸水稀释10倍后,取5μL与SA基质1:1混匀,然后再取1μL点板,干燥后推入质谱中进行分子量和蛋白质鉴定,平行测定6次。
2.3 蛋白质鉴定
称取hTRF 0.4mg,加入100μL含0.1%Rapigest的50mmol/L的碳酸氢铵溶液,涡旋混匀,然后加入35μL 0.1mol/L的DTT,涡旋混匀,60℃水浴15min;冷却到室温后,加入35 μL IAA,暗反应40 min,然后再加入105 μL 0.1 mol/L的DTT以除去过剩的IAA,最后加入5μL胰蛋白酶,37℃孵育过夜,反应结束后,加200μL 0.1mol/L HCl终止反应,用0.22μm的滤膜过滤后取2μL与基质HCCA同比例混匀点靶板,用MALDI-TOF测定后搜索Swissprot数据库进行蛋白质鉴定。参数设置如表1所示。

表1 蛋白质鉴定参数设置
3 质量平衡法测定hTRF蛋白质含量
3.1 水分测定
每次准确称量大约5 mg hTRF样品用卡尔费休水分测定仪进行测定,平行测定3次。
3.2 灰分测定
采用灼烧残渣法测定hTRF灰分。先将洁净的坩埚在马弗炉里灼烧至恒重,加入准确称量的约20 mg hTRF样品,再次灼烧至恒重,根据灼烧后残留质量计算灰分含量。
3.3 反相高效液相色谱测定hTRF纯度
将hTRF用纯水配成1mg/mL的溶液,同比例加入已配好的1.5mg/mL的EDTA二钠盐溶液,进行高效液相色谱分析。色谱柱为Agilent 300SB-C18(2.1mm×75mm×5μm,USA);柱温40℃;流量1mL/min;UV检测波长215nm;进样量20μL。流动相及梯度如表2所示。

表2 hTRF反相高效液相色谱纯度测定流动相及梯度 %
4 HPLC-IDMS法测定hTRF蛋白质含量
4.1 hTRF样品的水解
采用最小分度为0.01 mg的天平称取约10 mg hTRF样品,溶于10 mL纯水中,配成1 mg/mL的蛋白溶液。取100μL母液,加到2mL安瓿瓶中,再加入100μL标记氨基酸混标溶液。置于真空离心干燥仪中离心干燥70min,待样品中水分全部除去后取出,加入500μL 6 mol/L盐酸,通氮2min除氧后密封,在(110.0±0.5)°C的烘箱中进行水解。水解后氮气吹干,用500μL水(含0.1%甲酸)复溶,经0.22 μm滤膜过滤后上机测定。
4.2 HPLC-IDMS分析
色谱条件:色谱柱为Agilent SB-Aq(2.1mm×150mm);流量为0.2mL/min。流动相及梯度如表3所示。

表3 hTRF HPLC-IDMS纯度测定流动相及梯度 %
质谱条件:离子对质荷比:脯氨酸:116->70(Pro)和121->74(标记Pro);缬氨酸:118->72(Val)和123->76(标记Val);苯丙氨酸:166->120(Phe)和174->128(标记Phe)。
5 结果与讨论
5.1 hTRF基本性质的表征
5.1.1 SDS-PAGE纯度测定结果
hTRF SDS-PAGE电泳纯度测定结果如图1所示,hTRF条带位于66.2~94.0kDa之间,与文献报道一致。hTRF浓度较高时,在45.0~66.2 kDa之间可见一条杂蛋白的条带。

图1 hTRF SDS-PAGE电泳纯度测定结果(单位:kDa)
5.1.2 MALDI-TOF分子量测定结果
进行6次重复测定hTRF MALDI-TOF,其平均值为78.17 kDa,RSD为0.02%,分子量测定结果与SDS-PAGE测定结果和文献报道均一致。在52.25kDa分子量处可见一杂蛋白的峰,与SDS-PAGE测定结果一致。
5.1.3 蛋白质鉴定结果
hTRF酶切后的质谱图如图2所示,从图中可见酶切出的肽段,使用肽质量指纹谱(PMF)数据经Mascot软件在Swissprot数据库中进行蛋白质鉴定,结果显示,所鉴定肽段来自于TRFE_HUMAN,Score为80。
5.2 质量平衡法测定hTRF含量

图2 hTRF酶切后的质谱图
采用卡尔费休水分测定仪对hTRF样品进行3次重复测定,结果平均值为11.24%,RSD为1.0%。经灼烧残渣法测定的hTRF灰分含量为3.08%。反相高效液相色谱纯度测定结果如图3所示,当直接采用HPLC对hTRF纯度进行测定时,在主峰的位置上存在一个肩峰(如图3(a)中A线所示),该峰是由于hTRF处于铁螯合状态和非螯合状态导致的。为消除螯合状态对蛋白质纯度测定的影响,采用EDTA螯合除去铁后再进行分析,可得到光滑的色谱峰(如图3(a)中B线所示)。先后优化了EDTA与蛋白的比例对纯度测定的影响,固定hTRF质量浓度为1mg/mL,考察了EDTA质量浓度分别为0.5~10 mg/mL时的测定结果,当EDTA质量浓度为1.5mg/mL时,可得到理想的分离分析结果。重复分析5次,纯度测定结果为96.28%,相对标准偏差为0.3%。根据式(1)采用质量平衡法计算hTRF的含量。

式中:w——蛋白纯度;
P——反相HPLC法测定的蛋白纯度;A——水分含量;B——灰分含量。
经计算,质量平衡法测定的hTRF质量分数为82.49%。
5.3 HPLC-IDMS测定hTRF含量
5.3.1 水解时间的优化
为了确保蛋白质能够定量水解成氨基酸,需要对水解时间进行优化,选取水解时间曲线的最高点或平台期作为最佳的水解时间。分别考察了水解时间为16~96 h时水解液中Pro、Val和Phe的相对比例,结果如图4所示。从图中可以看出,当水解时间达到40h时,3种氨基酸的相对比例都达到了峰值,因此选定40h为hTRF的最佳水解时间。
5.3.2 方法准确性、重复性和再现性评价

图3 反相高效液相色谱纯度测试结果

图4 hTRF水解时间优化结果
首先,对HPLC-IDMS法测定hTRF样品结果的不确定度进行评定。实验时,采用了Pro、Val和Phe分别对蛋白质含量进行测定,并取其平均值。分别计算各个氨基酸对蛋白质定量结果的不确定度,以Phe为例,测量不确定度主要来源于称量、水解效率、方法重复性和氨基酸标准物质。称量的不确定度依据JJG 1036——2008《电子天平》[10]确定称量Phe及溶液时的最大允许误差分别为0.015 mg和按照均匀分布,计算由称量引入的不确定度分量分别为

方法重复性引入的不确定度分量按照不确定度的A类评定方法评价,一共对样品进行了5次重复测定,结果的相对标准偏差为0.77%,因此,测定结果平均值的重复性相对不确定度为

根据Phe国家标准物质证书,Phe的定值结果为(99.9±1.5)%,其包含因子k=2,所以由Phe标准物质引入的不确定度分量为

相对不确定度为


类似的,经计算采用Pro和Val测定蛋白质含量结果的合成不确定度分别为
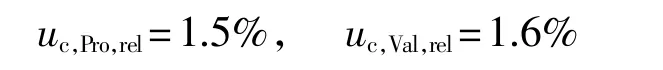
最后结果的不确定度为

方法的扩展不确定度为

比较了hTRF样品的HPLC-IDMS测定结果与质量平衡法测定结果,两者的相对偏差仅为0.6%,并且质量平衡法的测定结果在HPLC-IDMS法测定结果的不确定度范围内,说明HPLC-IDMS法对hTRF样品的测定结果准确可靠。
采用优化建立的HPLC-IDMS方法对同一hTRF样品进行5次重复测定,所得结果平均值为0.834g/g,RSD为0.3%,可见所建方法重复性良好。
采用优化建立的HPLC-IDMS方法对11个hTRF样品、每个样品重复测定3次,所得结果平均值为0.830g/g,RSD为0.6%,可见所建方法再现性良好。
5.3.3 检出限与定量限评价
根据下式计算HPLC-IDMS方法的检出限和定量限:

式中:Rm-STD——标准溶液中氨基酸与同位素标记氨基酸的质量比;
Rh-STD——标准溶液中氨基酸与同位素标记氨基酸的峰高比;
Msample——样品溶液中同位素标记氨基酸的质量,g;
msample——样品溶液中氨基酸的质量,g;
Rh-sample——非标记氨基酸通道中3倍或10倍噪音信号强度与相应的标记氨基酸信号强度之比。
经计算,hTRF的检出限与定量限分别为3.78×10-5g/g和1.26×10-4g/g。
6 结束语
本文建立了人转铁蛋白纯品含量HPLC-IDMS测定方法,经方法学参数考察和与质量平衡法测定结果的比较,所建方法具有溯源清晰、准确度高的特点,可作为人转铁蛋白纯品标准物质的定值方法,对于建立我国人转铁蛋白测定结果的量值溯源传递体系、保证临床检验中人转铁蛋白测定结果的准确、可比具有积极的意义。
[1]Johnson G,Jacobs P,Purves L R.Iron binding proteins of iron-absorbing rat intestinal mucosa[J].J Clin Invest,1983,71(5):1467-1476.
[2]赵光斌,符本琪,白萍.高原人血清铁蛋白、转铁蛋白测定及临床意义[J].四川医学,2003(12):1292-1293.
[3]Srikrishnan T,MacKenzie J T,Sulkowski E.Thiophilic interaction chromatography of human transferrins[J].Journal of Chromatographic Science,2006,44(10):634-638.
[4]Wang S,Kaltashov I A.A new strategy of using O-18-labeled iodoacetic acid formassspectrometry-based protein quantitation[J].Journal of American Society for Mass Spectrometry,2012,23(7):1293-1297.
[5]ISO 17511—2003体外诊断医疗器械-生物样品中量的测量-校准品和控制物质赋值的计量学溯源性[S].北京:中国标准出版社,2003.
[6]常碧影,梁冬生,阎惠文.氨基酸分析技术研究的进展[J].分析化学,1993(10):1220-1227.
[7]戴新华,暴海霞,苏福海.国际关键比对CCQM-K55C:L-缬氨酸纯度的测量[J].计量技术,2013(10):15-19.
[8]黄挺,张伟,全灿.定量核磁共振法研究进展[J].化学试剂,2012,34(4):327-332.
[9]Muñoz A,Kral R,Schimmel H.Quantification of protein calibrants by amino acid analysis using isotope dilution mass spectrometry[J].Analytical Biochemistry,2011,408(1):124-131.
[10]JJG 1036—2008电子天平[S].北京:中国计量出版社,2008.
Determination on mass fraction of pure human transferrin through high performance liquid chromatography-isotope dilution mass spectrometry
LI Jiale1,WU Liqing2,LIU Wenli2,JIN Youxun2,CHEN Hongfei3,YANG Bin2,YANG Yi1
(1.Beijing University of Chemical Technology,Beijing 100029,China;2.National Institute of Metrology,Beijing 100013,China;3.Nanjing Institute of Measurement and Testing Technology,Nanjing 210037,China)
This paper discusses a high performance liquid chromatography-isotope dilution mass spectrometry(HPLC-IDMS)method established to determine the mass fraction of pure human transferrin(hTRF).It comprises the following steps:first,hydrolyze the pure hTRF with acid and use water(containing 0.8mmol/L of perfluoroheptanoic acid and 0.1%of trifluoroacetic acid)and acetonitrile as mobile phases;second,quantify the proline,valine and phenylalanine in the hydrolysate with the HPLC-IDMS method based on amino acids-national reference materials and isotope-labeled amino acids-internal standards;and third,calculate the mass fraction of pure hTRF according to the results of the above steps.In addition,the hTRF was also quantified by the mass balance method to verify the feasibility of the established method.Under optimized conditions,the hTRF had a mass fraction of 0.830g/g,with a relative standard deviation(RSD)of 0.6%and an expanded uncertainty of 0.014g/g(k=2).The detection and quantitation limits were 3.78×10-5g/g and 1.26×10-4g/g,respectively.Characterized by high accuracy and clear traceability,this method can be applied to determine the reference material amounts in pure hTRFs,playing a significant role in the establishment of valuation transfer and traceability systems for hTRF detection in China.
human transferrin;mass fraction;isotope dilution mass spectrometry;mass balance method
A
:1674-5124(2015)05-0058-05
10.11857/j.issn.1674-5124.2015.05.015
2014-10-17;
:2014-12-05
质检总局公益行业专项项目(201310008)
李佳乐(1990-),女,内蒙古呼和浩特市人,硕士研究生,专业方向为分析化学。

