孕晚期吗啡暴露子代鼠NR2B亚基与吗啡条件位置偏爱易感性的关系
杨 柳,姚卫东,钱 敏,金孝岠
(皖南医学院第一附属医院 弋矶山医院 麻醉科,安徽 芜湖 241001)
·基础医学·
孕晚期吗啡暴露子代鼠NR2B亚基与吗啡条件位置偏爱易感性的关系
杨 柳,姚卫东,钱 敏,金孝岠
(皖南医学院第一附属医院 弋矶山医院 麻醉科,安徽 芜湖 241001)
目的: 探讨吗啡条件性位置偏爱(CPP)不同易感性的孕晚期吗啡暴露的子代鼠脑伏隔核(NAc)中N-甲基-D-天冬氨酸(NMDA)受体NR2B亚基水平。方法: 孕晚期SD大鼠48只随机分为吗啡组(M组)和生理盐水组(N组)。首剂量为2 mg/kg,逐日递增1 mg/kg,至6 mg/kg维持,头颈部皮下注射。N组孕鼠以同样的方式注射等体积的生理盐水。取上述2组体质量接近的子代鼠各70只,正常喂养至8周龄。每组子代鼠采用恒量法 (3 mg/kg) 连续颈背部皮下注射吗啡7 d 进行条件位置偏爱(CPP)训练,训练结束24 h 后对CPP效应进行检测。根据吗啡条件化训练后CPP分值(CPP测试值-CPP基数值)的大小将M组子代鼠分为高偏爱组(n=10)、中偏爱组(n=30)、低偏爱组(n=10)。采用Western blotting方法检测高,低偏爱组和N组子代鼠伏隔核区NR2B亚基的表达。结果:①预测试时,各组的CPP基数值的差异无统计学意义(P>0.05);吗啡高偏爱组CPP分值(552.6±132.6)s明显高于低偏爱组(223.4±55.14)s和N组子代鼠(42.93±31.78)s(P<0.01),差异有统计学意义。②Western blotting结果示高偏爱组子代鼠的NR2B亚基表达量(0.81±0.01)均明显高于低偏爱组(0.64±0.01)和N组子代鼠(0.55±0.01,P<0.01)。结论:产前吗啡暴露的子代鼠吗啡CPP易感性高可能与伏隔核的NR2B亚基水平上调有关。
孕晚期;吗啡暴露;子代鼠;条件位置偏爱;NR2B亚基;Western blotting;成瘾易感性
【DOI】10.3969/j.issn.1002-0217.2015.05.004
怀孕妇女滥用阿片药物将会对胎儿产生严重影响,95%新生儿可因滥用阿片类药物发生戒断反应综合征[1]。然而目前关于孕期使用阿片类药物对患儿长期影响的研究尚少,故对子代成瘾易感性及其机制的研究就显得尤为重要。我们前期研究表明孕晚期吗啡暴露可增加子代鼠吗啡条件位置偏爱的易感性。有研究报道,新生大鼠在胚胎期被动暴露于吗啡的可导致行为和神经化学的改变,包括心理依赖吗啡[2]。我们知道,成瘾药物精神依赖的易感性存在个体差异[3],故通过研究子代成瘾易感性的差异进而深入探讨其神经生物学的机制具有重要的理论和现实价值。伏隔核是参与药物精神依赖形成的重要脑区。N-甲基-D-天冬氨酸(NMDA)受体是一类中枢神经系统兴奋性谷氨酸受体,NR2是调节亚单位,它有四种亚型(NR2A,NR2B,NR2C,NR2D)。Albensi等研究发现NMDA受体与阿片药物的依赖密切相关[4]。NR2B亚基在药物精神依赖的形成、发展和维持中发挥关键作用,成为阿片受体系统外最重要的调节系统之一。基因研究和行为学结果证明,同吗啡精神依赖形成密切相关的谷氨酸结合位点均定位于NR2B亚基,它是一个重要的调节位点[5]。CPP在研究药物的精神依赖方面有突出优势[6]。中脑边缘多巴胺系统(MLDS)与吗啡的成瘾性密切相关,它的生长发育始于孕12 d,至孕18 d结束[7]。故我们选取孕晚期即妊娠12~18 d为吗啡暴露期从而建立孕鼠的吗啡暴露模型,选择与精神依赖密切相关的NMDA受体NR2B作为主要的研究指标,建立吗啡CPP模型比较CPP易感性不同的子代鼠伏隔核区NR2B亚基的表达,从而进一步研究吗啡精神依赖的神经生物学的部分机制。
1 材料与方法
1.1 材料
1.1.1 实验材料 健康雌性SD大鼠62只,雄性31 只作为亲代大鼠,14~18周龄,体质量250~350 g,雌雄分开单笼饲养l周后开始实验。
1.1.2 实验药品 盐酸吗啡注射液购于沈阳第一制药有限公司。
1.1.3 实验装置 CPP视频分析软件由上海吉量软件科技有限公司提供,CPP实验箱为玻璃箱,实验箱由中间一块可移动隔板分割成两部分,一侧底面光滑,内面为黑色;另一侧地面粗糙,内面为白色。实验箱顶部有摄像头进行记录并置于隔音室中。
1.2 方法
1.2.1 孕鼠吗啡暴露模型制备及子代鼠的分组 在动物室进行1周的单笼适应饲养后,我们将体质量接近的雌鼠62只和雄鼠31只按2∶1进行雌雄配对,每天20:00进行合笼,次日8:00观察雌鼠,若观察到阴道有阴栓则视为其怀孕第1天[8]。最终观察到48只雌鼠有阴栓,则将此48只孕鼠随机分为吗啡组(M组)28只和生理盐水组(N组)20只,从观察到阴栓的第14天开始分别给予吗啡和生理盐水头颈部皮下注射。M组每天2次注射吗啡,起始剂量为2 mg/kg,逐日递增1 mg/kg直至6 mg/kg,剂量不再增加直至分娩。N组以同样的方式皮下注射同体积的生理盐水。孕鼠分娩后,母乳喂养3周,子代鼠和母鼠分开饲养。出生时每组各有子代鼠150只,分为M组子代鼠和N组子代鼠,选取上述2组中体质量接近的子代鼠,每组70只,正常喂养到8周后进行以下实验步骤。
1.2.2 子代鼠吗啡CPP模型的建立及CPP测试 CPP测试分为以下3个阶段[9]:①预测试阶段(第1~3天):每组子代鼠在打开实验箱中间隔板后,每天进行一次两侧的自由活动15 min,持续3 d,使其适应箱内环境。在第2、3天每天各测1次大鼠在箱两侧的停留时间,CPP基线值(单位为秒)即这2次的平均值。自然偏爱箱则是停留时间长的那一侧,伴药侧(即大鼠注射吗啡后放入该侧)则是时间停留短的。②训练阶段(第4~10天):将实验箱中间的隔板关闭,每组子代鼠皮下注射吗啡后放入伴药箱45 min,在间隔8 h给予同体积的生理盐水后放入自然偏爱侧45 min。吗啡的注射剂量恒为3 mg/kg,持续训练一周。条件化训练后,若子代鼠在伴药侧停留时间比预测试时在该侧停留的时间显著延长,表明吗啡CPP模型建立成功。③测试阶段(第11天):在末次吗啡训练24 h后,每组子代鼠在打开实验箱中间的隔板后同预测试阶段一样,在箱两侧自由活动15 min后记录伴药侧的停留时间,此时定义为CPP测试值(单位为秒)。子代鼠的成瘾易感性可用CPP分值(CPP测试值-CPP基线值)来进行评价。即其分值越大,吗啡CPP易感性就越高。我们在吗啡条件化训练期间观察到M组子代鼠共有8只死亡(其中2只被同笼子代鼠咬死,另6只死因不明), 11只淘汰(根据CPP基线值我们去除停留时间>630 s的子代鼠[10]);N组子代鼠全部存活,有6只淘汰,最后两组各留取50只子代鼠进行分析。根据CPP分值的大小,我们将M组子代鼠按 20%、60%、20%的比例,将其分为高偏爱组 、中偏爱组、低偏爱组。旨在研究不同的吗啡成瘾易感性子代鼠是否存在神经生物学差异,故仅对高偏爱组(10只)和低偏爱组(10只)子代鼠进行研究。
1.2.3 Western blotting方法测定子代鼠伏隔核NR2B亚基的表达将高、低偏爱组和N组子代鼠断头处死,分离出伏隔核,将组织置于细胞裂解液中匀浆,分离提取总蛋白溶液。初步测定总蛋白浓度后,以等量蛋白样品在8%的SDS-PAGE胶上电泳2 h,之后转印至NC膜上,用5%脱脂奶粉封闭3 h,用兔抗NR2B或鼠抗β-actin一抗(兔抗NR2B稀释浓度为1∶1000,购于Abcam公司;鼠抗β-actin稀释浓度为1∶1000,购于Sigma公司)4℃孵育过夜,TBST缓冲液洗膜3次,每次15 min后室温下置于辣根过氧化酶标记的二抗溶液(稀释浓度为1∶5000,购于北京中杉金桥有限公司)中孵育1.5 h,最后用ECL发光试剂盒(购于Thermo公司)显像。用ImageJ软件对蛋白条带进行分析,计算NR2B和β-actin条带灰度的比值,表示NR2B的蛋白表达量。
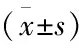
2 结果
2.1 检测子代鼠CPP模型 预测试时,各组的CPP基线值无明显差异(P>0.05);经过1周的吗啡训练后,高偏爱和低偏爱组CPP测试值相对于基线值存在明显的统计学差异(P<0.01,P<0.01),而N组子代鼠CPP测试值相比于基线值无明显差异(P>0.05);高偏爱组CPP分值明显高于低偏爱组和N组子代鼠(P<0.01,P<0.01),差异有统计学意义(见表1)。
2.2 Western blotting方法检测子代鼠NR2B亚基蛋白表达变化 每组子代鼠伏隔核蛋白质经过蛋白印迹显影后,可有166 ku的NR2B和42 ku的β-actin 内参照蛋白条带,高偏爱组NR2B亚基表达量均明显高于低偏爱组和N组子代鼠(P<0.01),见表2和图1。


组别CPP基线值CPP测试值CPP分值高偏爱组(H)149.00±97.50702.2±78.46abc552.60±132.6bc低偏爱组(L)81.40±33.84304.9±28.59ac223.40±55.14cN组子代鼠(C)73.64±20.27116.6±36.9542.93±31.78F值0.821134.2817.41P值0.46520.0000.000
注:与CPP基线值比较,aP<0.01 ; 与低偏爱组比较,bP<0.01;
与N组子代鼠比较,cP<0.01

A:显示三组大鼠NAc区NR2B亚基的蛋白印迹图像
B:显示三组大鼠NAc区NR2B亚基的蛋白印迹图像灰度比较,Y轴为各组NR2B条带与β-actin条带的灰度比值



组别NR2B表达量高偏爱组(H)0.81±0.01ab低偏爱组(L)0.64±0.01bN组子代鼠(C)0.55±0.01F值88.08P值0.000
注:与吗啡低偏爱组比较,aP<0.01;与对照组比较,bP<0.01
3 讨论
有实验表明,子代鼠脑结构和功能在孕期被动暴露于阿片类药物后可产生持久的负性效应[11];增加其对毒品的成瘾性[12]。本实验中,经过1周的吗啡条件化训练后,高偏爱组和低偏爱组的子代鼠对白箱产生稳定的CPP效应,而对照组子代鼠却并未表现出吗啡CPP效应;这表明孕晚期吗啡暴露可明显增加子代鼠的吗啡成瘾易感性。这与相关研究报道一致。但值得注意的是,排除环境因素对成瘾的影响存在难度,且不同品系大鼠对药物反应的差异与一些基因表达水平有关[13-14]。为此,在本实验中,同品系子代鼠为保证其遗传背景、后天环境及干预因素的一致,我们是在相同的饲养条件下,给予相同的吗啡剂量和处理。在经过条件化训练后,部分吗啡组的子代鼠在伴药侧的停留时间明显增加,则表现为高吗啡CPP;部分在伴药侧的停留时间增加的不明显,表现为低吗啡CPP。上述结果表明同品系子代鼠的不同个体,确实存在吗啡CPP易感性的差异。本研究在进行CPP训练时选择的吗啡剂量是参考了前人研究的数据[3,15]。然而需要考虑的是,如果我们选取的吗啡剂量过大则可能会因为药物的巨大奖赏效应而掩盖CPP的形成及表达,当然剂量过小也会影响实验动物CPP的形成。
本实验研究发现,高偏爱组子代鼠伏隔核区NR2B表达相对于低偏爱组和对照组明显增加。且高偏爱组相对于低偏爱组子代鼠表现出更强的吗啡CPP效应,这表明两组子代鼠伏隔核NR2B亚基表达的差异,主要与子代鼠的吗啡成瘾易感性的程度有关。NMDA受体通过调节突触的可塑性改变,从而介导其的发生和维持,而这些都伴随着精神依赖的发生和维持。研究报道,在吗啡成瘾的大鼠伏隔核中NMDA受体亚基的表达和功能增强[16-17]。NR2B主要存在于包括伏隔核、海马、纹状体等前脑中;而参与药物依赖的脑区主要有腹侧被盖区、伏隔核、杏仁体等,这表明药物成瘾的分布与NR2B存在重叠分布,成为NR2B参与药物依赖的结构基础。研究报道,阿片类作用于中脑腹侧被盖区-伏隔核-前额叶皮质(VTA-NAc-PFC)奖赏环路而引起的奖赏效应是精神依赖形成和维持的重要条件[18],伏隔核区谷氨酸递质及其受体NR2B亚基的上调与吗啡精神依赖密切相关[19]。宋月晗等发现在吗啡精神依赖大鼠伏隔核中显示NR2B表达增加[20];Narita等指出吗啡依赖小鼠边缘系统的NR2B表达上调,脑室注射NR2B拮抗剂能显著抑制吗啡诱导的CPP效应[21]。这些都从分子水平揭示了长期激活阿片受体对NMDA受体表达的影响,并提供了NR2B参与吗啡精神依赖的直接证据。本实验结果支持上述研究结论。然而,吗啡成瘾的形成是一个复杂的综合的神经生物学改变,本实验只是从一个侧面研究了药物成瘾的相关机制。同时,NMDA受体及其介导的突触可塑性本身也是复杂的,因此我们应进一步研究吗啡成瘾的神经生物学机制,为精神依赖提供可靠的理论基础。
综上所述,伏隔核区NR2B亚基蛋白的表达上调确实与孕晚期吗啡暴露的子代鼠CPP易感性差异密切相关,子代鼠吗啡成瘾易感性差异的因素之一可能是NR2B亚基表达的差异。但其上游及下游机制仍有待进一步探究。
[1] Chiang YC,Hung TW,Lee CW,etal.Enhancement of tolerance development to morphine in rats prenatally exposed to morphine,methadone,and buprenorphine[J].J Biomed Sci,2010,17:46.
[3] Flagel SB,Watson SJ,Akil H,etal.Individual differences in the attribution of incentive salience to a reward-related cue:influence on cocaine sensitization[J].Behav Brain Res,2008,186:48-56.
[4] Albensi BC.The NMDA receptor/ion channel complex:a drug target for modulating synaptic plasticity and excitotoxicity[J].Curr Pharm Des,2007,13(31):3185-3194.
[5] Wang CC,Held RG,Chang SC,etal.A critical role for GluN2B-containing NMDA recetors in cortical development and function[J].J Neuron,2011,72(5):789-805.
[6] Bardo MT,Bevins RA.Conditioned place preference:what does it add to our preclinical understanding of drug reward[J]?Psychopharmacology (Berl),2000,153(1):31-43.
[7] Everitt BJ,Wolf ME.Psychomotor stimulant addiction:a neural systems perspective[J].J Neurosci,2002,22(9):3312-3320.
[8] Chen Zhenyan,Li Jing,Huang Guangying.Effect of Bushen Yiqi Huoxue recipe on placental vasculature in pregnant rats with fetal growth restriction induced by passive smoking[J].J Huazhong Univ Sci Technolog Med Sci,2013,33(2):293-302.
[9] 杨柳,姚卫东,钱敏,等.孕晚期吗啡暴露对子代鼠吗啡成瘾易感性的影响[J].皖南医学院学报,2015,34(4):310-313.
[10] Watanabe T,Nakagawa T,Yamamoto R,etal.Involvement of noradrenergic system within the central nucleus of the amygdala in naloxone-precipitated morphine withdrawa1 induced conditioned place aversion in rats[J].Psyehopharmacology (Berl),2003,170:80-88.
[11] Derauf C,Kekatpure M,Neyzi N,etal.Neuroimaging of children following prenatal drug exposure[J].Semin Cell Dev Biol,2009,20(4):441-454.
[12] 黄晓科,银晓勇,黄艳秋,等.大鼠海马毁损与学习记忆研究进展[J].中国老年学杂志,2012,32(10):2199-2201.
[13] Riley MA,Vathy I.Mid- to late gestational morphine exposure does not alter the rewarding properties of morphine in adult male rats[J].Neuropharmacology,2006,51(2):295-304.
[14] Nikoshkov A,Drakenberg K,Wang X,etal.Opioid neuropeptide genotypes in relation to heroin abuse:dopamine tone contributes to reversed mesolimbic proenkephalin expression[J].Proc Natl Acad Sci USA,2008,105:786-791.
[15] Dalley JW,Fryer TD,Brichard L,etal.Nucleus accumbens D2/3 receptors predict trait impulsivity and cocaine reinforcement[J].Science,2007,315:1267-1270.
[16] Murray F,Harrison NJ,Grimwood S,etal.Nucleus accumbens NMDA receptor subunit expression and function is enhanced in morphine-dependent rats[J].Eur J Pharmacol,2007,562:191-197.
[17] Ma Yaoying,Chu Ningning,Guo Changyong,etal.NR2B-containing NMDA receptor is required for morphine but not stress-induced reinstatement[J].Exp Neurol,2007,203:309-319.
[18] Russo SJ,Dietz DM,Dumitriu D,etal.The addicted synapse:mechanisms of synaptic and structural plasticity in nucleus accumbens[J].J Trends Neurosci,2010,33(6):267.
[19] 郭萍,钱刚,凌锌,等.吗啡精神依赖大鼠VTA-NAc-PFC神经环路谷氨酸递质和NR2B表达的变化[J].中华神经医学杂志,2011,10(5):471.
[20] 宋月晗,李锋,刘晓兰,等.大鼠吗啡精神依赖时伏核和前额叶皮质中NR2A和NR2B表达的变化[J].中国药物依赖性杂志,2008,17(6):419-423.
[21] Narita M,Aoki T & Suzuki T.Molecular evidence for the invovlvement of NR2B subunit containing N-methyl-D-aspartate receptors in the development of morphine-induced place preference[J].J Neuroscience,2000,101:601-606.
Morphine-induced conditioned place preference and alteration of NR2B subunit level in offspring rats undergone late gestational morphine exposure
YANG Liu,YAO Weidong,QIAN Min,JIN Xiaoju
Department of Anesthesiology,The first Affiliated Hospital of Wannan Medical College,Wuhu 241001,China
Objective:To examine the relationship of NR2B subunit expression and susceptibility of morphine-induced conditioned place preference(CPP) in offspring rats undergone late gestational morphine exposure.Methods:Forty-eight late pregnant SD rats were randomized into morphine group (group M) and saline group (group N).Pregnant rats in group M were subcutaneously administered with morphine by initial dose in 2 mg/kg,with daily increment at 1 mg/kg till final 6 mg/kg.Pregnant rats in group N were administered with the same volume of saline as the same protocol.Seventy offspring rats with similar body weight were selected from the two groups,and conventionally fed for 8 weeks.Constant dose of morphine(3 mg/kg) was subcutaneously administered at the back of neck for 7 days to start conditioned place preference(CPP) paradigm,and the CPP effects were examined after 24 h of condition.Then the rats were divided into high CPP(n=10),moderate CPP(n=30) and low CPP group(n=10) on the CPP scores measured.Western blot was performed to determined the NR2B expression in offspring rats with high CPP and low CPP.Results:CPP cardinality value at pre-test had no statistical difference for the two groups(P>0.05),yet the scoring was significantly higher in high CPP(552.6±132.6)s group than that of low CPP(223.4±55.14)s and group N(42.93±31.78)s.The difference was significant(P< 0.01).Western blotting revealed that high CPP group had higher NR2B expression(0.81±0.01) over the low CPP(0.64±0.01) and group N(0.55±0.01,P<0.01).Conclusion:Higher susceptibility of morphine-induced CPP was found in offspring rats undergone late gestational morphine exposure,suggesting that this vulnerability may be associated with up-regulated NR2B level.
late pregnancy;morphine exposure; offspring rats; conditioned place preference;NR2B;Western blotting;vulnerability to addiction
1002-0217(2015)05-0419-04
安徽省高校省级自然科学研究项目(JK2013Z337);皖南医学院重点科研项目培育基金项目(WK2012ZF05);皖南医学院中青年科研基金项目(WK200922F)
2015-03-14
杨 柳(1991-),女,2013级硕士研究生,(电话)15855535448,(电子信箱)yang_liu0119@163.com; 金孝岠,男,主任医师,教授,硕士生导师,(电子信箱)jinxj@163.com,通讯作者.
R 749.61
A

