盐酸丁卡因脂质体凝胶皮肤刺激性实验及药效
基础医学研究
盐酸丁卡因脂质体凝胶皮肤刺激性实验及药效
王敏1,2,林茂1,邓英杰2,王春梅1
(1.遵义医学院珠海校区,广东 珠海519041;2.沈阳药科大学 药学院,辽宁 沈阳110016)
[摘要]目的 考察盐酸丁卡因脂质体凝胶剂的皮肤刺激性及药效。方法 通过皮肤刺激性试验考察了盐酸丁卡因脂质体凝胶剂对家兔完整或破损皮肤的刺激性。通过小鼠热板试验、小鼠甩尾试验和豚鼠背部皮肤擦伤试验考察了盐酸丁卡因脂质体凝胶剂的药效。结果 盐酸丁卡因脂质体凝胶剂对完整或破损皮肤均无刺激性。与盐酸丁卡因凝胶剂相比,盐酸丁卡因脂质体凝胶剂使热板试验中小鼠的镇痛时间明显延长(P<0.05),小鼠甩尾试验中小鼠的痛阈提高率明显提高(P<0.05),以及提高豚鼠擦伤试验的最大效能。结论 盐酸丁卡因脂质体凝胶剂无皮肤刺激性,与盐酸丁卡因凝胶剂相比,盐酸丁卡因脂质体凝胶剂延长了局麻时间。
[关键词]脂质体凝胶;盐酸丁卡因;药效学;刺激性;局麻药
盐酸丁卡因是一种常用于粘膜表面较理想的局部麻醉药,由于盐酸丁卡因可以解离出阳离子,容易进入脂质膜中,通过在脂质膜上波动的孔隙来发挥局麻作用[1],现已广泛应用于临床,但是其局部药效维持时间并不长久,还具有一定的毒副作用。因此,为了延长盐酸丁卡因在用药局部的作用时间,降低其毒副作用,本实验研究制备了盐酸丁卡因脂质体凝胶剂,并与自制盐酸丁卡因凝胶剂比较,通过小鼠热板试验、小鼠甩尾试验、豚鼠背部皮肤擦伤试验初步考察了盐酸丁卡因脂质体凝胶剂的药效。由于盐酸丁卡因脂质体凝胶剂属于非口服的经皮给药及可能接触皮肤的制剂,还应进行皮肤刺激性试验[2]。因此,本文通过皮肤刺激性试验评价了自制盐酸丁卡因脂质体凝胶剂对家兔皮肤的刺激性作用。
1材料与方法
1.1试药盐酸丁卡因(广东逸舒制药有限公司,产品批号20090101);盐酸丁卡因脂质体凝胶剂(自制,含量2 mg/g);盐酸丁卡因凝胶剂(自制,含量2 mg/g)。
1.2实验动物新西兰种家兔(♂♀,2.0~2.5 kg),昆明种小鼠(♀,18~22 g),豚鼠(♂♀,350~400 g),均由沈阳药科大学动物实验中心提供。
1.3仪器AR1140 电子天平(美国Ohaus corp公司);HSS-1B数字超级恒温浴槽(成都仪器厂);恒温水浴锅(巩义市予华仪器有限责任公司);电动剃毛刀(美国Oster公司)。
1.4盐酸丁卡因脂质体凝胶的制备
1.4.1盐酸丁卡因脂质体的制备采用硫酸铵梯度载药法制备盐酸丁卡因脂质体,处方组成中磷脂与胆固醇质量比4∶1,药物与磷脂质量比1∶14.4,磷脂浓度(W/W)为4%,硫酸铵浓度300 mmol/L。将制备得到的空白脂质体装于透析袋中,置于装有500 mL 生理盐水的溶出杯中,100 rpm,37 ℃透析,每隔6 h更换外部介质,透析24 h。在透析后的空白脂质体中加入1 mL处方量的盐酸丁卡因水溶液,于50 ℃恒温水浴中孵化5 min,冷却后即得盐酸丁卡因脂质体混悬液。
1.4.2盐酸丁卡因脂质体凝胶剂的制备取10.8 mL盐酸丁卡因脂质体混悬液(含药物30 mg),先用一部分脂质体混悬液溶胀凝胶基质,12 h后,加入另一部分脂质体混悬液,充分搅拌,加入处方量的甘油,用三乙醇胺调节脂质体凝胶的pH为6~8,最后蒸馏水补充总质量至15 g(药物含量约为2 mg/g)。
1.4.3盐酸丁卡因凝胶剂的制备制备与盐酸丁卡因脂质体凝胶剂药物浓度相同的盐酸丁卡因凝胶剂,制备过程的不同仅在于加入药物水溶液而不是脂质体混悬液。
1.5皮肤刺激性试验
1.5.1实验动物分组与给药健康家兔12只按体重分层后随机平均分为2组:完整皮肤组和破损皮肤组。每组再次按照受试物不同随机分为2组:基质组和药物组,进行皮肤刺激性试验。其中基质组和药物组均以左侧去毛区皮肤作为模型组,采用同体自身对照。
在受试前去除家兔背部脊柱两侧兔毛,每侧的面积约为9 cm2。破损皮肤组除毛后需用砂纸磨擦,去毛部位以渗血为度。左侧去毛区完整皮肤或破损皮肤均作为自身对照,不给予干预,而右侧去毛区完整皮肤或破损皮肤均涂抹1.0 g基质或药物。
涂抹受试物4 h后用温水洗去残留受试物,并在去除受试物后的1、24和48 h时观察涂抹部位有无红斑、水肿等情况,观察结果均与动物左侧去毛区皮肤作为自身对 照以判断是否存在皮肤刺激性[2]。
1.5.2评价方法按表1中的评价方法进行刺激性评分,计算出平均值后根据以下评价标准进行评价。无刺激性:0~0.49;轻度刺激性:0.50~2.99;中度刺激性:3.00~5.99;强刺激性:6.00~8.00。
表1皮肤刺激性反应评分标准
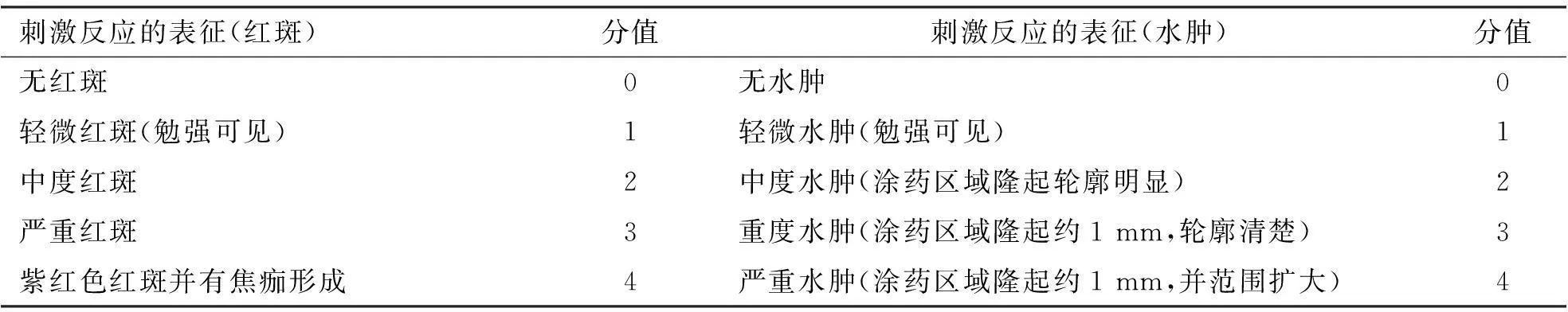
刺激反应的表征(红斑)分值刺激反应的表征(水肿)分值无红斑0无水肿0轻微红斑(勉强可见)1轻微水肿(勉强可见)1中度红斑2中度水肿(涂药区域隆起轮廓明显)2严重红斑3重度水肿(涂药区域隆起约1mm,轮廓清楚)3紫红色红斑并有焦痂形成4严重水肿(涂药区域隆起约1mm,并范围扩大)4
1.6药效实验
1.6.1小鼠热板试验在(55±0.5) ℃恒温水浴中放入1 000 mL烧杯进行预热,烧杯达到(55±0.5) ℃后,放入小鼠,并记录小鼠舔后足或跳出烧杯的时间,即为热板试验的潜伏期。挑选5~30 s反应灵敏且稳定的小鼠40只,按此法测定2次潜伏期,每次间隔30 min,计算平均值,记为基础潜伏期。将小鼠按照基础潜伏期分层后随机分成空白对照组(A组)、空白凝胶基质组(B组)、盐酸丁卡因脂质体凝胶组(C组)和盐酸丁卡因凝胶组(D组),每组10只。分别于每只小鼠4个足跖涂抹相应受试物,0.5 g/只。分别于0.5、1、1.5、2、2.5、3、6和8 h时测定小鼠给药后的潜伏期[3-4]。测定时间上限为60 s。根据公式:最大可能效应=(给药后潜伏期-基础潜伏期)×100%/(40-基础潜伏期)[5](式中40表示致痛时烧杯加热的时间为40 s,该值可以直观的反应药物的镇痛效果)计算最大可能效应的值。
1.6.2小鼠甩尾试验取小鼠在试验前于距离尾尖5 cm 处用酒精擦干净,酒精挥发后,使小鼠尾部下垂浸入(55±0.5) ℃的恒温水浴中,浸入长度为距离尾尖3 cm处。以鼠尾回缩出水面的时间为潜伏期,间隔5 min测定2次潜伏期,取其均值作为基础潜伏期,将基础潜伏期大于13 s的小鼠弃去。筛选出40只小鼠按基础潜伏期分层后随机分成4组:空白对照组(A组)、空白凝胶基质组(B组)、盐酸丁卡因脂质体凝胶组(C组)和盐酸丁卡因凝胶组(D组),每组10只。给予相应受试物涂抹,给药剂量0.5 g/只。清除鼠尾多余受试物后,分别于0.5、1、1.5、2、2.5、3、6和8 h时测定小鼠给药后的潜伏期。按公式计算脂质体凝胶组与凝胶组的痛阈提高率:痛阈提高率(%)=(给药后潜伏期-基础潜伏期)/基础潜伏期×100%,该值可直观反应药物的镇痛效果[5]。
1.6.3豚鼠背部皮肤擦伤法试验取豚鼠按体重分层后随机分为3组,即模型对照组,盐酸丁卡因脂质体凝胶组和盐酸丁卡因凝胶组,每组6只,在其背上正中前部皮肤剃毛,大小约为3 cm2。将豚鼠麻醉,腹卧位固定,按擦伤法(选粗金刚砂石,在裸露皮肤上,向同一方向,加压重擦5次,随即换成垂直方向,再擦5次,使该处皮肤受损)来处理皮肤。待豚鼠清醒后,将受试物涂布于擦伤处。用针刺法测定用药部位皮肤的痛觉反应。针刺皮肤有收缩现象为阳性,无收缩为阴性反应。针刺部位应在损伤区周边宽约6 mm的带状区内,因该处最敏感,受损皮肤的中心部位不敏感。涂抹受试物后10 min内,每1分钟测定1次,10 min后每5分钟测定一次[6-7]。每只豚鼠测定12次,记录其阴、阳性反应数,计算最大效能=(阴性反应数/测试次数)×100%,最大效能≤1。
2结果
2.1盐酸丁卡因脂质体的外观、粒径和包封率盐酸丁卡因脂质体的外观(见图1 A),为球形或类球形。激光粒度仪测定其平均粒径为(168±22) nm且粒度分布范围窄(见图1 B)。微柱离心法[8]测定其包封率为82.40%。
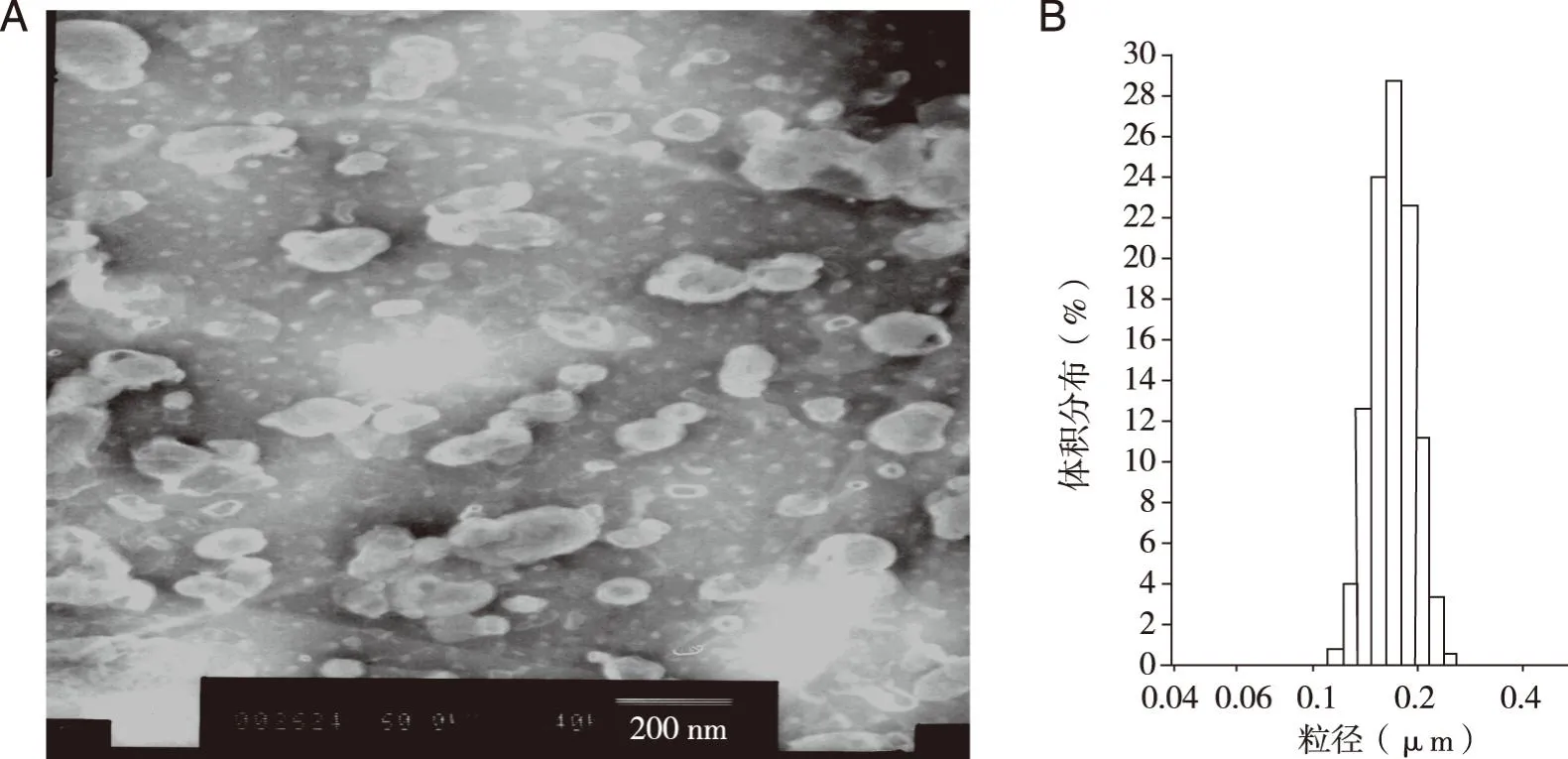
图1 盐酸丁卡因脂质体透射电镜图片(×40k,A)和粒度分布范围(B)
2.2皮肤刺激性试验结果根据“1.5.2”中的评价方法考察家兔涂抹部位的红斑和水肿情况,结果显示给予受试物后,无论是完整皮肤还是破损皮肤的模型组、脂质体凝胶组和空白凝胶基质组均未见皮肤刺激性表征。
2.3小鼠热板试验结果由表2可知,盐酸丁卡因脂质体凝胶组(C)在测试的8 h内各时间点的痛阈潜伏期均显著大于空白对照组(A)和空白基质组(B)(P<0.05)。盐酸丁卡因凝胶组(D)仅在给药后2.5 h内的潜伏期大于A和B组。盐酸丁卡因脂质体凝胶组(C)于给药后3~8 h的潜伏期显著大于盐酸丁卡因凝胶组(D)(P<0.01)。
由表3可知,盐酸丁卡因脂质体凝胶组的最大可能效应值显著高于盐酸丁卡因凝胶组(P<0.05)。表明,盐酸丁卡因脂质体凝胶组的镇痛效果强于盐酸丁卡因凝胶组。
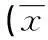
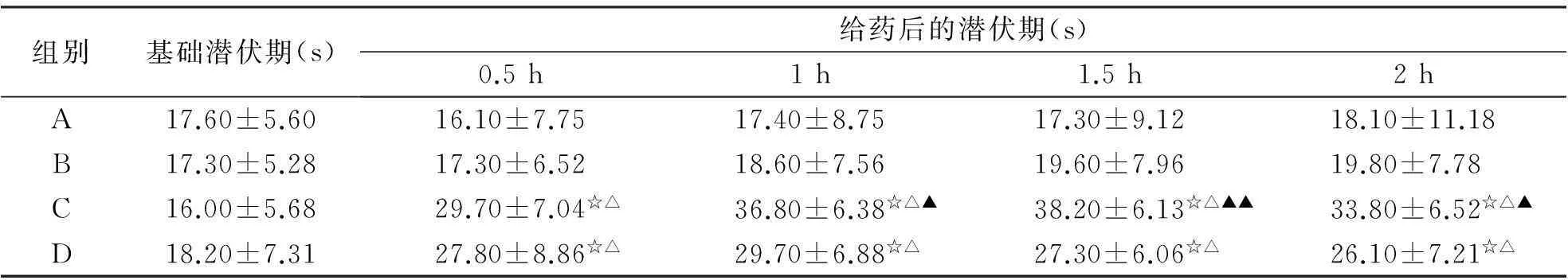
组别基础潜伏期(s)给药后的潜伏期(s)0.5h1h1.5h2hA17.60±5.6016.10±7.7517.40±8.7517.30±9.1218.10±11.18B17.30±5.2817.30±6.5218.60±7.5619.60±7.9619.80±7.78C16.00±5.6829.70±7.04☆△36.80±6.38☆△▲38.20±6.13☆△▲▲33.80±6.52☆△▲D18.20±7.3127.80±8.86☆△29.70±6.88☆△27.30±6.06☆△26.10±7.21☆△
(续表)
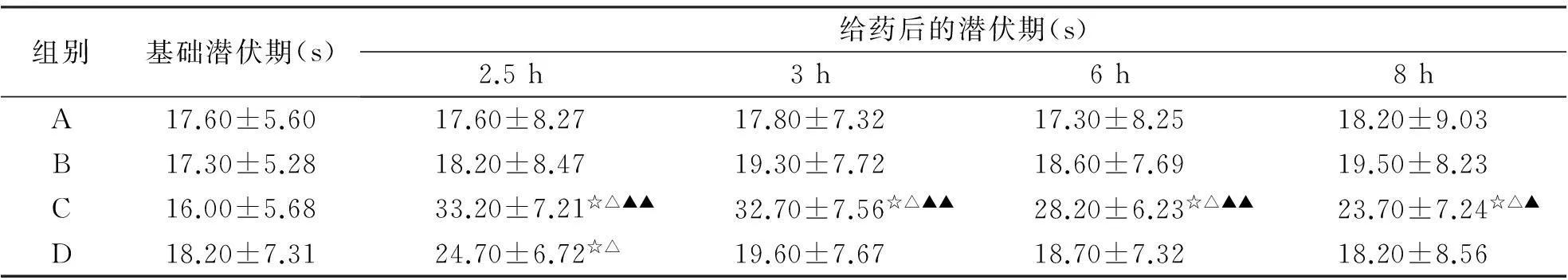
组别基础潜伏期(s)给药后的潜伏期(s)2.5h3h6h8hA17.60±5.6017.60±8.2717.80±7.3217.30±8.2518.20±9.03B17.30±5.2818.20±8.4719.30±7.7218.60±7.6919.50±8.23C16.00±5.6833.20±7.21☆△▲▲32.70±7.56☆△▲▲28.20±6.23☆△▲▲23.70±7.24☆△▲D18.20±7.3124.70±6.72☆△19.60±7.6718.70±7.3218.20±8.56
与A组比较,☆P<0.05;与B组比较,△P<0.05;与D组比较,▲P<0.05;与D组比较,▲▲P<0.01。
表3小鼠热板试验的最大可能效应结果(%)
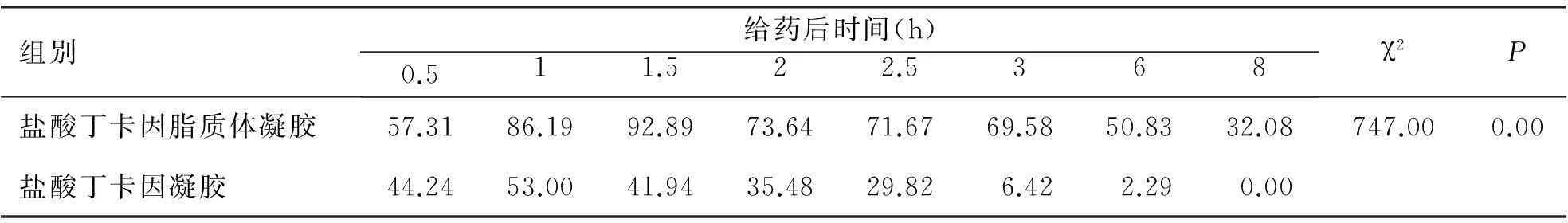
组别给药后时间(h)0.511.522.5368χ2P盐酸丁卡因脂质体凝胶57.3186.1992.8973.6471.6769.5850.8332.08747.000.00盐酸丁卡因凝胶 44.2453.0041.9435.4829.826.422.290.00
2.4小鼠甩尾试验结果由表4可知,盐酸丁卡因脂质体凝胶(A)组在给药后各时间点的潜伏期均显著高于空白对照组和空白基质组(P<0.05);在给药后1~8 h显著高于盐酸丁卡因凝胶(D)组(P<0.05或P<0.01)。
由表5可知,盐酸丁卡因脂质体凝胶组在给药后的测定时间范围内,对小鼠的痛阈提高率均>0。而盐酸丁卡因凝胶组在给药6 h后几乎降为0。盐酸丁卡因脂质体凝胶组提高小鼠痛阈率显著大于盐酸丁卡因凝胶组(P<0.05),其镇痛效果较强。
表4小鼠甩尾试验给药前的基础潜伏期和给药后的潜伏期
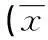
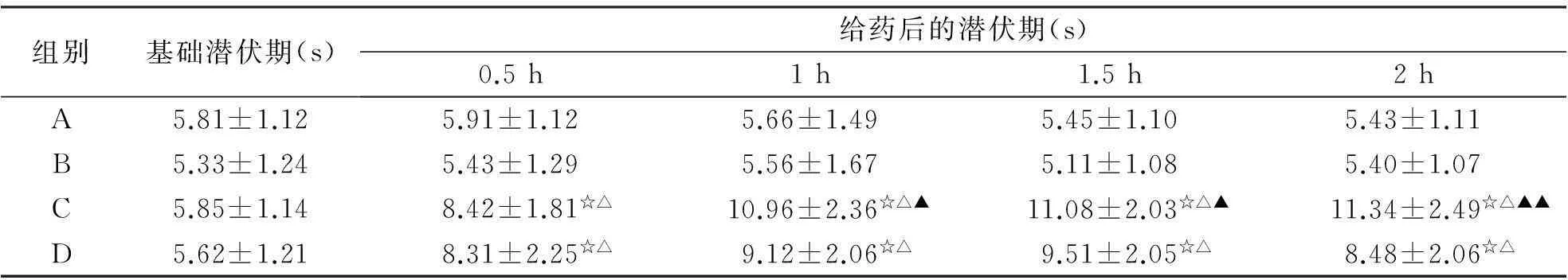
组别基础潜伏期(s)给药后的潜伏期(s)0.5h1h1.5h2hA5.81±1.125.91±1.125.66±1.495.45±1.105.43±1.11B5.33±1.245.43±1.295.56±1.675.11±1.085.40±1.07C5.85±1.148.42±1.81☆△10.96±2.36☆△▲11.08±2.03☆△▲11.34±2.49☆△▲▲D5.62±1.218.31±2.25☆△9.12±2.06☆△9.51±2.05☆△8.48±2.06☆△
(续表)
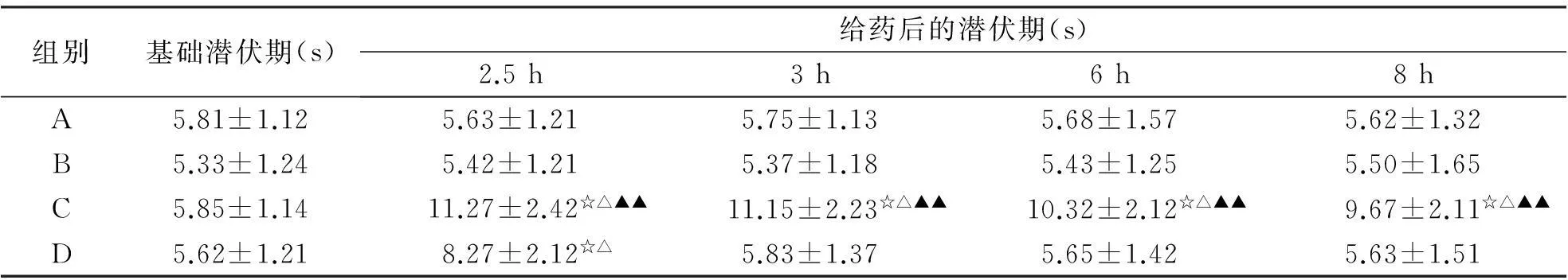
组别基础潜伏期(s)给药后的潜伏期(s)2.5h3h6h8hA5.81±1.125.63±1.215.75±1.135.68±1.575.62±1.32B5.33±1.245.42±1.215.37±1.185.43±1.255.50±1.65C5.85±1.1411.27±2.42☆△▲▲11.15±2.23☆△▲▲10.32±2.12☆△▲▲9.67±2.11☆△▲▲D5.62±1.218.27±2.12☆△5.83±1.375.65±1.425.63±1.51
与A组比较,☆P<0.05;与B组比较,△P<0.05;与D组比较,▲P<0.05;与D组比较,▲▲P<0.01。
表5小鼠甩尾试验的痛阈提高率(%)
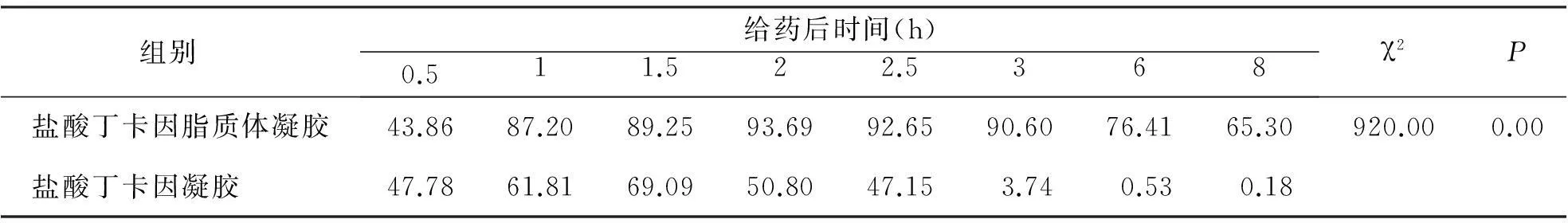
组别给药后时间(h)0.511.522.5368χ2P盐酸丁卡因脂质体凝胶43.8687.2089.2593.6992.6590.6076.4165.30920.000.00盐酸丁卡因凝胶 47.7861.8169.0950.8047.153.740.530.18
2.5豚鼠背部皮肤擦伤法试验结果最大效能的试验结果分别为模型对照组0%,盐酸丁卡因脂质体凝胶组0.57%,盐酸丁卡因凝胶组0.43%。可见,盐酸丁卡因脂质体凝胶组的最大效能高于盐酸丁卡因凝胶组。说明脂质体凝胶作为盐酸丁卡因的载体可以更好地发挥其局部麻醉效果。
3讨论
脂质体类似于细胞结构,它本身可生物降解,无毒性,不产生皮肤刺激性,其水化磷脂还能够促进干燥皮肤的水化,使药物更容易透过皮肤角质层,还能使皮肤细腻光泽[9],因此是皮肤局部给药的理想载体[10]。本实验中皮肤刺激性观察结果也表明,盐酸丁卡因脂质体凝胶剂对家兔皮肤无刺激性。但脂质体物理稳定性较差,所以不宜以脂质体混悬液直接作为剂型应用。因此,本文选择将脂质体与凝胶基质相结合,制备成为稳定性好,应用方便的脂质体凝胶剂。
在药效学实验中,选用小鼠热板法、小鼠甩尾法和豚鼠皮肤擦伤法为疼痛模型,分别考察自制盐酸丁卡因脂质体凝胶剂与模型组、空白基质组以及盐酸丁卡因凝胶剂组的最大效应,即镇痛效果,以及给药后潜伏期,即镇痛时间的比较。结果显示,盐酸丁卡因脂质体凝胶剂组的镇痛效果,镇痛作用时间均强于盐酸丁卡因凝胶组,显示了其缓释性的特点,这可能是由于脂质体作为经皮给药途径的载体可以滞留于皮肤内,起到缓释作用。盐酸丁卡因脂质体凝胶剂的镇痛效果强,还提示可适当降低其给药剂量,在保证其镇痛效果的前提下,降低其毒副作用。
在实际应用中,盐酸丁卡因溶液剂中常加入一定量的肾上腺素,后者收缩血管而起到延缓盐酸丁卡因的吸收作用,但肾上腺素强烈缩血管的作用会对局部皮肤组织产生刺激作用,使其应用具有一定的局限性。因此,期望本实验研究会对盐酸丁卡因新剂型的开发提供理论依据。
[参考文献]
[1] Shibata A, Maeda K, Ikema H, et al. Local anesthetics facilitate ion transport across lipid planar bilayer membranes under an electric field: Dependence on type of lipid bilayer[J]. Colloids and Surfaces B: Biointerfaces, 2005, 42(3): 197-203.
[2] 关玉晶. 自乳化基质乙氧苯柳胺乳膏的研究[D]. 沈阳: 沈阳药科大学, 2006.
[3] 冉启军, 赵建峰. 贵州苗药黑骨藤总黄酮的抗炎镇痛作用[J]. 遵义医学院学报, 2012, 35(4): 283-286.
[4] 谢明华, 蔡鑫君, 封玲, 等. 利多卡因微乳凝胶剂的制备及初步药效学考察[J]. 中国现代应用药学, 2015, 32(4): 442-446.
[5] 魏伟, 吴希美, 李元建. 药理实验方法学[M].第4版. 北京: 人民卫生出版社, 2010: 770-774.
[6] 徐叔云, 卞如濂, 陈修. 药理实验方法学[M]. 北京: 人民卫生出版社, 1991: 100.
[7] 王桂芝, 高尔, 陈维宁, 等. 小鼠和豚鼠利多卡因脂质体局部麻醉的药效学[J]. 中华麻醉学杂志, 2006, 26(5): 465-466.
[8] 王敏, 邓英杰, 王娜. 微柱离心-HPLC法测定盐酸丁卡因脂质体包封率[J]. 中国药房, 2009, 20(28): 2226-2228.
[9] 于黎鹏, 杨君, 杨跃辉. 脂质体经皮给药系统的研究进展[J]. 实用药物与临床, 2014, 17(2): 217-221.
[10] 袁雍, 黄萍, 杨秀丽. 脂质体经皮局部给药研究进展[J]. 中国药师, 2014, 17(7): 1227-1231.
[收稿2015-10-12;修回2015-11-10]
(编辑:王静)
Study of hydrochloride tetracaine liposome gel for skin irritation and analgesic effects
WangMin1,2,LinMao1,DengYingjie2,WangChunmei1
(1.Zhuhai Campus of Zunyi Medical University, Zhuhai Guangdong 519041, China; 2.School of Pharmacy, Shenyang Pharmaceutical University, Shenyang Liaoning 110016, China)
[Abstract]Objective To investigate the hydrochloride tetracaine liposome gel for skin irritation and pharmacodynamics.Methods Irritation effects of hydrochloride tetracaine liposome gel on rabbit intact or damaged skin were studied by the skin irritation test. The analgesic effect of hydrochloride tetracaine liposome gel was investigated by the mouse hot plate test, the mouse tail flick test, and the guinea pig dorsal skin abrasion test, respectively.Results The hydrochloride tetracaine liposome gel did not cause irritation on the intact skin and the damaged skin. Compared with tetracaine hydrochloride gel, the hydrochloride tetracaine liposome gel could prolong the analgesic time of the mouse hot plate test (P<0.05), increase the pain threshold rate of the mouse tail flick test (P<0.05) and improve the maximum effect of the guinea pig dorsal skin abrasion test.Conclusion The hydrochloride tetracaine liposome gel is not a skin irritant. Compared with the tetracaine hydrochloride gel, the hydrochloride tetracaine liposome gel can prolong the local anesthesia effect.
[Key words]liposome gel; hydrochloride tetracaine; pharmacodynamics; irritation; local anesthetics
[中图法分类号]R943
[文献标志码]A
[文章编号]1000-2715(2015)06-0599-05
[通信作者]王春梅,女,教授,硕士生导师,研究方向:神经内分泌疾病发病机制及治疗,E-mail:295446806@qq.com。
[基金项目]广东省卫生厅基金资助项目(NO: A2013651)。

