小鼠骨髓间充质干细胞牵引力在诱导分化过程中的变化
李延菁, 赵毅蒙, 李昊洋, 马德顺
(沈阳大学 生命科学与工程学院, 辽宁 沈阳 110044)
小鼠骨髓间充质干细胞牵引力在诱导分化过程中的变化
李延菁, 赵毅蒙, 李昊洋, 马德顺
(沈阳大学 生命科学与工程学院, 辽宁 沈阳110044)
摘要:对小鼠骨髓间充质干细胞(BMSCs)进行成脂诱导分化,然后使用显微镜追踪法比较了小鼠BMSCs成脂诱导分化前后细胞牵引力(CTF)的变化,用荧光抗体染色技术观察了单个细胞平滑肌肌动蛋白(α-SMA)的变化,用Western Blot技术观察了分化前后α-SMA总量的变化.结果显示:小鼠BMSCs成脂分化后CTF均方根值平均增高66%,单个细胞α-SMA的质量分数及总体质量分数均显著上升.这表明小鼠BMSCs成脂分化后α-SMA的表达显著上升并导致了CTF的增强,这与其在分化过程中分子组成和内部结构的变化有关.
关键词:小鼠骨髓间充质干细胞; 诱导分化; 细胞牵引力
贴壁细胞在培养过程中,肌动球蛋白和肌动蛋白共同作用使细胞产生内部张力,并对细胞外的基质施加牵引力,这个力叫做细胞牵引力[1](Cell Traction Force,CTF).CTF的大小和变化对细胞的形态保持、生长、繁殖、分化、贴壁、拖曳及信号传导等生物过程具有极其重要的影响[2].20世纪初Kawai-Kowase K等发现平滑肌肌动蛋白(α-SMA)是影响CTF的关键性蛋白[3].随后Kong H J等研究发现α-SMA与CTF呈正相关性[4].CTF与干细胞分化有着密切的相关性.2010年马德顺等发现人前交叉韧带干细胞分化后CTF减小30%,且α-SMA表达量明显降低[5].CTF与肿瘤形成也有着密切的相关性,且人肿瘤细胞的CTF变化趋势与小鼠肿瘤细胞相反.2012年Kraning-Rush Casey M等对转移和非转移的乳腺癌、前列腺癌和肺癌细胞进行研究发现转移性细胞CTF明显高于非转移性细胞[6].2014年张晶晶等发现小鼠肝肿瘤细胞与正常肝细胞相比,α-SMA下降47. 9%,CTF减小53.4%[7].2014年牛庆元等发现小鼠肺癌细胞与正常肺细胞相比,α-SMA蛋白含量明显下降,CTF减少49%[8].细胞基因的改变同样会影响细胞形态,进而影响CTF水平.2012年周历等经研究发现人肾小球足细胞敲除Pinch-3基因后与正常细胞相比细胞投影面积增加近40%,CTF也减小近40%[9].骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)具有很强的自我复制和多向分化潜能,具有非常重要的研究价值.但关于其在分化过程中的力学特性还未见报道.我们采用定向诱导分化的方法,使BMSCs向成脂细胞分化,并比较细胞牵引力及α-SMA在此过程中的变化,旨在探讨定向诱导分化对小鼠BMSCs的力学特性及α-SMA的影响.
1材料与方法
1.1实验动物及试剂
C57BL/6j小鼠(4周龄),体重(20±2)g,购于沈阳医学院动物实验中心;H-DMEM培养基购自Invitrogen公司,优级犊牛血清购于德国Biochrom公司;双抗(含青霉素、链霉素)、胰蛋白酶及鬼笔环肽购自Sigma公司;胰岛素购自Solarbio公司;吲哚美辛及IBMX购自Aladdin公司;地塞米松及油素红O购自北京鼎国生物技术有限责任公司.
1.2细胞的采集与培养
颈椎脱臼法处死C57BL/6j小鼠,在体积分数为75%的酒精内杀菌5 min.无菌操作台中解剖小鼠取其双侧胫骨及股骨,去除肌肉及结缔组织,骨两侧剪断暴露骨髓腔[10].用1 mL注射器吸取H-DMEM培养液反复冲洗骨髓腔,肉眼见红色骨髓流出,骨头由粉红色变为白色即冲洗干净,用200目滤网过滤骨髓细胞悬液,制备成单细胞悬液.
小鼠BMSCs的筛选使用差速贴壁法联合24 h首次换液法.对BMSCs细胞计数,以1.0×104个细胞/mL的密度接种到含体积分数为20%优级犊牛血清的H-DMEM的细胞培养瓶内.CO2培养箱恒温培养,温度设置为37 ℃,CO2体积分数设置为5%.1.5 h后弃贴壁细胞,收集上层细胞悬液,置于新培养瓶中培养.24 h后首次全量换液,之后每两天半量换液.待细胞长至80%铺满瓶底时传代培养.
1.3BMSCs的成脂诱导分化
取第三代BMSCs进行成脂诱导分化,将其分为诱导组和对照组.将诱导组BMSCs接种于6孔板,细胞培养24 h后换为成脂诱导液A液(含胎牛血清200 mg/L、青霉素100 U/mL和链霉素100 U/mL的H-DMEM、地塞米松1 μmol/L、胰岛素10 mg/L、吲哚美辛200 μmol/L、IBMX 0.5 μmol/L)[11],3天后换成成脂诱导B液(含胎牛血清200 mg/L、青霉素100 U/mL和链霉素100 U/mL的H-DMEM、胰岛素10 mg/L),重复以上步骤3次[12].每天在倒置显微镜下观察细胞,待胞浆内出现圆形空泡后,用PBS洗涤,体积分数为4%多聚甲醛固定30 min,PBS洗去固定液后油红O浸染15 min,蒸馏水漂洗,镜下观察,若观察到橘红色脂肪滴证明成脂分化成功.对照组正常培养(含胎牛血清200 mg/L、100 U/mL青霉素和100 U/mL链霉素的H-DMEM).
1.4细胞牵引力的测算
1.4.1CTFM 技术的基本原理
CTFM技术是将细胞培养在刚性适中的含有荧光微珠的凝胶弹性基底表面,利用荧光倒置显微镜来追踪观察细胞存在和不存在情况下基质的变化,并以此推算细胞牵引力的方法.
1.4.2操作步骤
将丙烯酰胺和甲叉双丙烯酰胺按照设定的比例混合制备成硬度为3 000 Pa的底层凝胶,表层用同样硬度的凝胶混合体积分数为2%的荧光微珠.凝胶盘在接种细胞之前用I型胶原蛋白液进行预处理后,滴入一滴Sulfo-SANPAH,并使用紫外光(UV)处理.将含有约1 500个细胞的细胞悬液转移到凝胶盘上,培养1 h观察其贴壁良好后加入培养液再培养5 h.在每个凝胶盘中选择一个状态良好的细胞进行实验,记录由于细胞迁移导致的基底变形,利用荧光显微镜成像,将所得图像资料上机分析.
1.4.3图像数据的分析与处理
利用MATLAB7.0软件运行专用分析程序,计算BMSCs成脂分化前后的荧光微珠图片,得出各样本细胞牵引力的均方根,位移,牵引力最大值等各项数据,将所得数据汇总录入SPSS19.0进行分析.
1.5荧光抗体染色技术
将小鼠BMSCs种在盖玻片上,密度长至70%~80%后用PBS清洗掉盖玻片上的细胞培养液,体积分数为3.7%的甲醛-PEMD固定10 min,PBS洗去固定液,体积分数为0.1%TritonX-100对细胞进行通透10 min,PBS洗涤.山羊血清封闭30 min.一抗选用鼠抗α-SMA特异蛋白,冰箱中培养过夜,PBS洗净未结合的一抗,二抗选用FITC标记兔抗小鼠IgG.室温下避光培养2 h.用PBS清洗三次和蒸馏水清洗一次.缓冲甘油封片,显微镜下观察并拍照.
1.6Western Blot技术
分别取2 mL小鼠BMSCs成脂分化前后细胞培养液,1.5%质量分数的蛋白酶抑制剂的细胞裂解液处理细胞,制备电泳样本,BCA(蛋白定量分析)试剂盒检测其浓度,取等量蛋白样本注入10%质量分数的聚丙烯酰胺凝胶,90 V恒定电压电泳,用电转膜仪以70 V电压转膜,时间为90 min.用5%质量分数的PBS-Tween20缓冲液处理1 h,一抗选用抗鼠α-SMA特异蛋白,二抗选用过氧化酶标记的羊抗鼠免疫球蛋白,用ECL蛋白检测试剂盒对α-SMA进行检测[13].
2结果
2.1细胞牵引力的变化
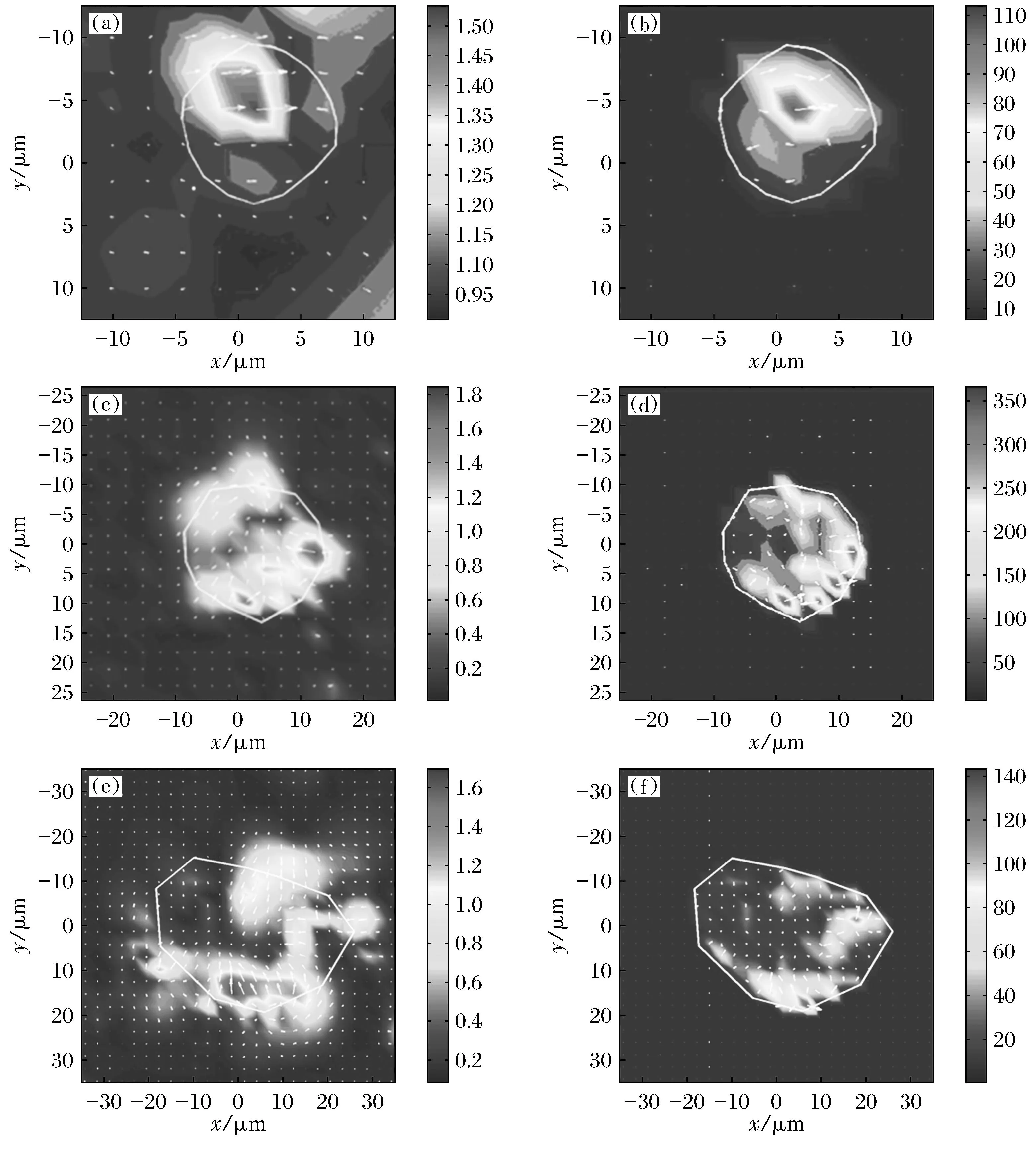
图1小鼠BMSCs分化前后细胞牵引力的变化
Fig.1The changes of cell traction force in mice BMSCs before and after adipogenic differentiation
(a)—小鼠BMSCs分化前的位移; (b)—小鼠BMSCs分化前牵引力的测算结果;
(c)—小鼠BMSCs分化后的位移; (d)—小鼠BMSCs分化后牵引力的测算结果;
(e) —小鼠BMSCs对照组的位移; (f)—小鼠BMSCs对照组牵引力的测算结果.
应用CTFM方法对小鼠BMSCs诱导成脂分化前后牵引力进行测量.图1分别为小鼠BMSCs诱导成脂分化前后的位移及CTF.结果显示小鼠BMSCs在分化前后对比基质上产生的最大位移由1.5 μm增长为1.8 μm.小鼠BMSCs诱导成脂分化前后的均方根牵引力平均值由134 Pa增高到223 Pa,大约增长了66%,较分化前升高,但对照组与分化前细胞牵引力及位移变化微小 (图1).用SPSS19.0对分化前后数据进行成对样品t检验,结果显示分化前与分化后数据差异显著,分化前与对照组差异不显著,分化后与对照组差异显著(图2).
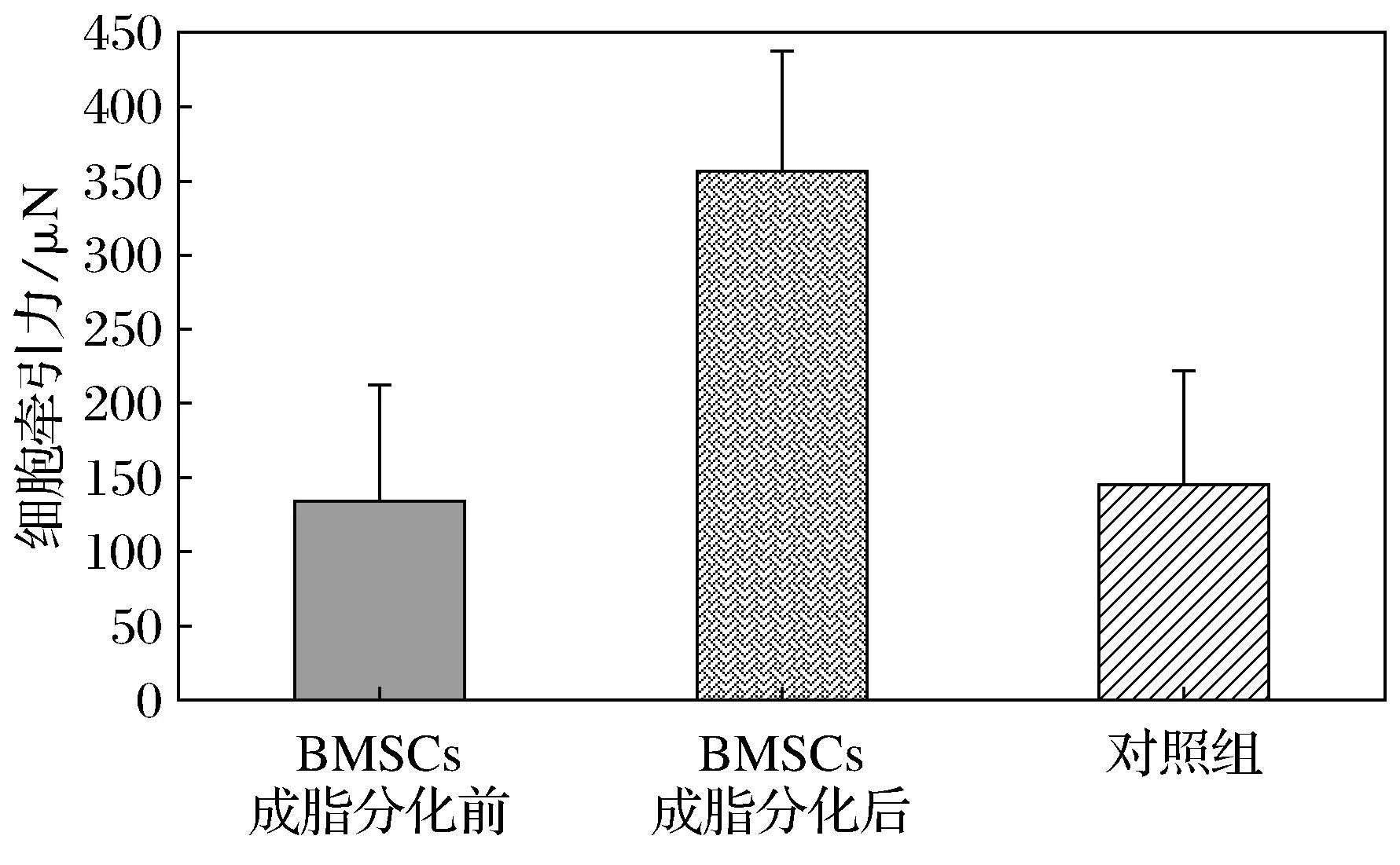
图2 小鼠BMSCs成脂分化前后及对照组的
2.2单细胞α-SMA蛋白的变化
A小鼠BMSCs分化前α-SMA蛋白比较疏松且含量低;小鼠BMSCs分化后α-SMA蛋白比较密集且含量高.对比分化前、分化后及对照组α-SMA情况,说明小鼠BMSCs在成脂分化后其α-SMA蛋白含量明显高于分化前及对照组的α-SMA蛋白含量,且分化前与对照组α-SMA水平相近,见图3.
2.3α-SMA蛋白总量的变化

图3小鼠BMSCs成脂分化前后α-SMA 分布的变化
Fig.3The changes of theα-SMA expression level in mice BMSCs before and after adipogenic differentiation
(a)—小鼠BMSCs成脂分化前α-SMA的分布;(b)—小鼠BMSCs成脂分化后α-SMA的分布;
(c)—对照组小鼠BMSCsα-SMA的分布.
利用Western Blot的方法测定小鼠BMSCs分化前后2mL细胞所含α-SMA蛋白总量的差异.所得条带越宽说明α-SMA总量越高.结果显示分化后α-SMA蛋白浓度明显高于分化前及对照组的浓度,分化前α-SMA蛋白总含量与对照组相近,说明小鼠BMSCs成脂分化后α-SMA蛋白总含量显著提高,见图4.

图4 小鼠BMSCs成脂分化前后α-SMA蛋白的变化
3讨论
小鼠BMSCs经成脂诱导分化后CTF及α-SMA含量均显著升高了,这一结果与我们之前研究的小鼠肿瘤细胞的力学特性相似,因为肿瘤细胞是干细胞分化停止或正常细胞去分化的结果,所以,它们之间具有相似性是有科学道理的.小鼠BMSCs经成脂诱导分化后CTF及α-SMA的变化趋势与人细胞的变化趋势相反,这一点也与之前的研究成果吻合,说明不同物种间α-SMA的调控机制有差异,具体机制尚有待于进一步研究,但是,α-SMA与CTF的相关性是完全一致的,不论人类细胞还是小鼠细胞α-SMA与CTF两者之间均存在正相关性,因为CTF的产生源于α-SMA的表达,这一点与Chen J X等学者的研究成果相一致[14].小鼠BMSCs经成脂诱导分化后,CTF及α-SMA含量均明显上升,这可能是由于成脂细胞的组成和结构促进了α-SMA的表达造成的,从而导致CTF的相应变化,其详细的变化机制和过程还有待于进一步深入研究.
参考文献:
[1]WANG J H C, LIN J S. Cell traction force and measurement methods[J]. Biomechanics and Modeling in Mechanobiology, 2007,6(6):361-371.
[2]JANMEY P A, WEITZ D A. Dealing with mechanics: mechanisms of force transduction in cells[J]. Trends in Biochemical Sciences, 2004,29(7):364-370.
[3]KAWAI-KOWASE K, SATO H, OYAMA Y, et al. Basic fibroblast growth factor antagonizes transforming growth factor-β1-induced smooth muscle gene expression through extracellular signal-regulated kinase 1/2 signaling pathway activation[J]. Arteriosclerosis Thrombosis and Vascular Biology, 2004,24(8):1384-1390.
[4]KONG H J, POLTE T R, ALSBERG E, et al. FRET measurements of cell-traction forces and nano-scale clustering of adhesion ligands varied by substrate stiffness[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005,102(12):4300-4305.
[5]马德顺,高淑云,路春霞,等. 前交叉韧带干细胞分化后其牵引力的变化[J]. 中国细胞生物学学报, 2010(1):141-144.
(MA D S,GAO S Y, LU C X, et al. Variation in cell traction force of anterior cruciate ligament stem cells before and after differentiation[J]. Chinese Journal of Cell Biology, 2010(1):141-144).
[6]KRANING-RUSH C M, CALIFANO J P, REINHART-KING C A. Cellular traction stresses increase with increasing metastatic potential[J]. PLoS one, 2012,7(2):e32572.
[7]张晶晶,艾红佳,牛庆元,等.α-SMA与肿瘤发展相关性的研究[J]. 生物学杂志, 2014,31(4):46-49.
(ZHANG J J, AI H J, NIU Q Y, et al. Correlation betweenα-SMA and tumor progression[J]. Journal of Biology, 2014,31(4):46-49).
[8]牛庆元,张晶晶,纪珍玲,等. 小鼠正常肺细胞和肺癌细胞之间的力学特性比较研究[J]. 中国细胞生物学学报, 2014,36(3):308-312.
(NIU Q Y, ZHANG J J, JI Z L, et al. Comparative study on the mechanical characteristics of the mice lung cells and Lewis lung carcinoma[J]. Chinese Journal of Cell Biology, 2014,36(3):308-312.)
[9]周历,马德顺,杨毓,等. Pinch-3蛋白对细胞形态及牵引力的影响[J]. 沈阳大学学报(自然科学版), 2012,24(1):45-47.
(ZHOU L, MA D S, YANG Y, et al. Effect of pinch-3 protein in podocytes on cell morphology and cell traction force[J]. Journal of Shenyang University (Natural Science), 2012,24(1):45-47).
[10] 杨光,范东艳,陈强,等. 贴壁法培养不同龄小鼠骨髓间充质干细胞的生物学特点[J]. 中国实验诊断学, 2007,11(1):13-15.
(YANG G, FAN D Y, CHEN Q, et al. Biological characteristics of marrow mesenchymal stem cells of mice of different ages cultured in vitro with adherent method[J]. Chinese Journal of Laboratory Diagnosis, 2007,11(1):13-15.)
[11] 时炳正,徐志媛,杜晓岩,等. 4 ℃条件下保存不同时间点小鼠骨髓间充质干细胞的细胞活性和生物学特性研究[J]. 口腔医学研究, 2013,3:205-209.
(SHI B Z, XU Z Y, DU X Y, et al. Cellular activity and biological characteristics of mouse bone marrow mesenchymal stem cells during different preservation times at 4 ℃[J]. Journal of Oral Science Research, 2013,3:205-209.)
[12] 徐道华,周晨慧,刘钰瑜,等. 大鼠骨髓间充质干细胞分化成脂肪细胞的定向诱导[J]. 中国组织工程研究与临床康复, 2009,13(1):125-128.
(XU D H, ZHOU C H, LIU Y Y, et al. Differentiation of rat bone marrow mesenchymal stem cells into adipocytes by directional induction[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2009,13(1):125-128.)
[13] 李建停,马德顺,牛庆元,等. 小鼠肺癌细胞诱导分化后的力学特性比较[J]. 沈阳大学学报(自然科学版), 2014,26(2):94-98.
(LI J T, MA D S, NIU Q Y, et al. Comparative study on mechanical characteristics of mice’s lung carcinoma cells after induced differentiation[J]. Journal of Shenyang University (Natural Science), 2014,26(2):94-98.)
[14] CHEN J X, LI H X, RAJ N S, et al. Alpha-smooth muscle actin expression enhances cell traction force[J]. Cell Motility and the Cytoskeleton, 2007,64(4):248-257.
【责任编辑: 李艳】
Changes of Cell Traction Force of Mice Bone Marrow Mesenchymal Stem Cells during Induced Differentiation
LiYanjing,ZhaoYimeng,LiHaoyang,MaDeshun
(College of Life Science and Bioengineering, Shenyang University, Shenyang 110044, China)
Abstract:Mice bone marrow mesenchymal stem cells(BMSCs) are induced to adipogenic differentiation, and then the changes of the cell traction force are observed and compared with cell traction force microscopy (CTFM), and theα-SMA protein changes of single cell are determined with fluorescent antibody staining technology, and the changes of totalα-SMA are observed using Western Blot technology before and after the induced to adipogenic differentiation in BMSCs. The results show that the root mean square of cell traction force (CTF) in mice BMSCs increases by 66% after induced to adipogenic differentiation, the level of both single cellα-SMA and totalα-SMA increases significantly. It shows that the increase of expression ofα-SMA causes a CTF to rise. It is related to changes in the process of differentiation of the molecular composition and internal structure.
Key words:BMSCs; induced differentiation; CTF
中图分类号:R 734
文献标志码:A
文章编号:2095-5456(2015)06-0446-05
作者简介:李延菁(1990-),女,辽宁朝阳人,沈阳大学硕士研究生; 马德顺(1962-),男(回族),辽宁沈阳人,沈阳大学教授,硕士研究生导师.
收稿日期:2015-04-14

