不同浓缩方法对青蒿-陈艾挥发性成分的影响
李春燕, 陈远谷, 曾 婷, 王若焱, 杨 娟*
(1.贵州大学 药学院, 贵州 贵阳 550025; 2.贵州省中国科学院天然产物化学重点实验室, 贵州 贵阳 550002; 3.遵义市烟草公司技术中心, 贵州 遵义 563000 )
不同浓缩方法对青蒿-陈艾挥发性成分的影响
李春燕1,2, 陈远谷1,2, 曾 婷2, 王若焱3, 杨 娟2*
(1.贵州大学 药学院, 贵州 贵阳 550025; 2.贵州省中国科学院天然产物化学重点实验室, 贵州 贵阳 550002; 3.遵义市烟草公司技术中心, 贵州 遵义 563000 )
为筛选青篙-陈艾的最佳浓缩方法,采用文火对青蒿-陈艾进行煎煮,分别用50℃减压旋转浓缩、50℃减压旋转浓缩+65℃水浴和文火煎煮+65℃水浴浓缩,并采用顶空固相微萃取-气相色谱/质谱(HS-SPME-GC/MS)法分析各浓缩方法所得浸膏与水煎液的挥发性成分,用面积归一化法测定其相对百分含量。结果表明:水煎液共鉴定出挥发性成分54种,含量较高的为醇类和酮类;50℃减压浓缩液共鉴定出35种,含量较高的为醛类、烃类和醇类;50℃减压+65℃水浴干燥浸膏共鉴定出39种,含量较高的为酸类、醇类和醛类;文火煎煮+65℃水浴干燥浸膏共鉴定出58种,含量较高的为酸类、醇类。4个样品含共有挥发性成分14种,其中水煎液与文火煎煮+65℃水浴干燥浸膏共有挥发性成分的种类最多,达26种。不同浓缩方法对青蒿-陈艾中的挥发性成分种类和含量影响较大,文火煎煮+65℃水浴干燥法可作为最佳浓缩方法。
青蒿-陈艾; 挥发性成分; 浓缩; 顶空固相微萃取; 气质联用
青蒿-陈艾是常用的药对,最早源自清代,民间常将青蒿-陈艾鲜草煎水洗澡,认为百草沐浴可以防百病;也有将青蒿-陈艾燃烧用于熏烟杀菌、驱蚊[1-2]。现在一些制剂如治疗仔猪白痢的药物组合物中也使用了该药对[3]。青蒿为菊科植物黄花蒿(ArtemisiaannuaL.)的干燥地上部分[4],主要化学成分为萜类、黄酮类、挥发油、苯丙酸、香豆素[5],其水煎剂中的挥发性成分具有抗菌、杀虫作用[6],其水提取物、内生菌具有抑菌作用[7]。陈艾为菊科植物艾(ArtemisiaargyiLevl.etVant.)的干燥叶[4],主要化学成分为挥发油、黄酮、桉叶烷和三萜[8],其挥发油具有广谱杀菌作用[9-10],其水煎液中的挥发性成分具有较好的抑菌作用[11]。顶空固相微萃取-气相色谱/质谱是常用的检测挥发性成分的方法,该法无需有机溶剂,简单方便,测试快,集采样、萃取、浓缩、进样、检索和鉴定挥发性成分于一体,已成为分析检测挥发性成分最常用的方法[12]。目前,关于青蒿-陈艾浓缩方法对其挥发性成分的影响未见报道,而水煎液中的挥发性成分在浓缩的过程中易被水蒸气带走。为更好地保证药用质量,试验在文火煎煮浓缩法,减压旋转浓缩法和水浴浓缩法的基础上,将3种浓缩方法相互结合,并采用顶空固相微萃取-气相色谱/质谱[13-14]法分析青蒿-陈艾水煎液和各种浓缩方法得到的浸膏中挥发性成分的变化,旨在为青蒿-陈艾水煎液的浓缩选择最佳的浓缩方法提供参考。
1 材料与方法
1.1 药材与仪器
药材:青蒿和陈艾均购自遵义市中药材批发市场,按药典(2010版)要求进行鉴定,结果符合药典要求。
仪器:HP6890/5975C GC/MS联用仪(美国安捷伦公司),手动固相微萃取装置,萃取纤维为:2 cm-50/30 μm DVB/CAR/PDMS StableFlex(美国Supelco公司),BUCHI R114旋转蒸发仪(Switzerland 公司),DK-98-II电热恒温水浴锅(天津泰斯特仪器有限公司),RT2134电磁炉(广东美的生活电器制造有限公司)。
1.2 青蒿-陈艾水煎液及各浓缩样品的制备
青蒿-陈艾粉末500 g,混合均匀,提取2次,第1次8倍量水,第2次4倍量水,均为水沸后文火煎煮30 min,抽滤,合并2次滤液,记录体积数,取均匀液3.5 mL置于4 mL塑料离心管中,得水煎液(样1)。取1 000 mL水煎液50℃减压旋转浓缩,浓缩后取样液1 mL置于1.5 mL离心管中,得50℃减压浓缩液(样2)。剩余50℃减压浓缩液于65℃水浴干燥成浸膏,得50℃减压+65℃水浴干燥浸膏(样3)。最后剩余水煎液文火煎煮至浓溶液,在65℃水浴干燥成浸膏,得文火煎煮+65℃水浴干燥浸膏(样4)。
1.3 顶空固相微萃取-气相色谱/质谱条件
1.3.1 顶空固相微萃取 分别取样1、样2、样3和样4置于10 mL固相微萃取仪采样瓶中,插入手动进样器,在85℃左右顶空萃取30 min后,快速移出萃取头并立即插入气相色谱仪进样口(温度250℃)中,热解析3 min进样。
1.3.2 气相色谱条件 色谱柱为ZB-5MSI 5% Phenyl-95% DiMethyLpolysiloxane (30 m× 0.25 mm×0.25 μm)弹性石英毛细管柱,柱温45℃(保留2 min),以4℃/min升温至220℃,保持2 min;汽化室温度250℃;载气为高纯He (99.999%);柱前压7.62 psi,载气流量1.0 mL/min;不分流进样,溶剂延迟时间:1.5 min。
1.3.3 质谱条件 离子源为EI源,离子源温度230℃,四极杆温度150℃,电子能量70 eV,发射电流34.6 μA,倍增器电压1 315 V,接口温度280℃,质量范围20~450 amu。
1.4 挥发性成分分析
1.4.1 定性分析 对总离子流图中的各峰经质谱计算机数据系统检索及核对Nist 2008和Wiley 275标准质谱图,确定不同种类的挥发性成分。
1.4.2 定量分析 用峰面积归一化法测定各化学成分的相对质量分数,分别求得各化学成分在4种样品挥发性成分中的相对百分含量。
2 结果与分析
2.1 不同浓缩方法所得样品的主要挥发性成分
如表和图1所示:样1共检测出54种挥发性成分,占总峰面积的94.13%。其中,醇类物质含量最高,占66.62%;其次是酮类物质,占17.83%;醛类和酸类物质没有检测到。样2共检测出35种挥发性成分,占总峰面积的96.72%。其中,醇类、醛类和烃类物质含量较高,分别占20.56%、30.05%和32.98%,酸类物质没有检测到。样3共检测出39种挥发性成分,占总峰面积的86.97%。其中,酸类物质含量最高,占34.65%;其次是醇类物质,占26.20%;烃类物质含量较少,占1.69%。样4共检测出58种挥发性成分,占总峰面积的87.83%。其中酸类物质含量最高,占36.08%;其次是醇类物质,占21.84%。

表 不同浓缩方法所得样品的挥发性成分含量
续表
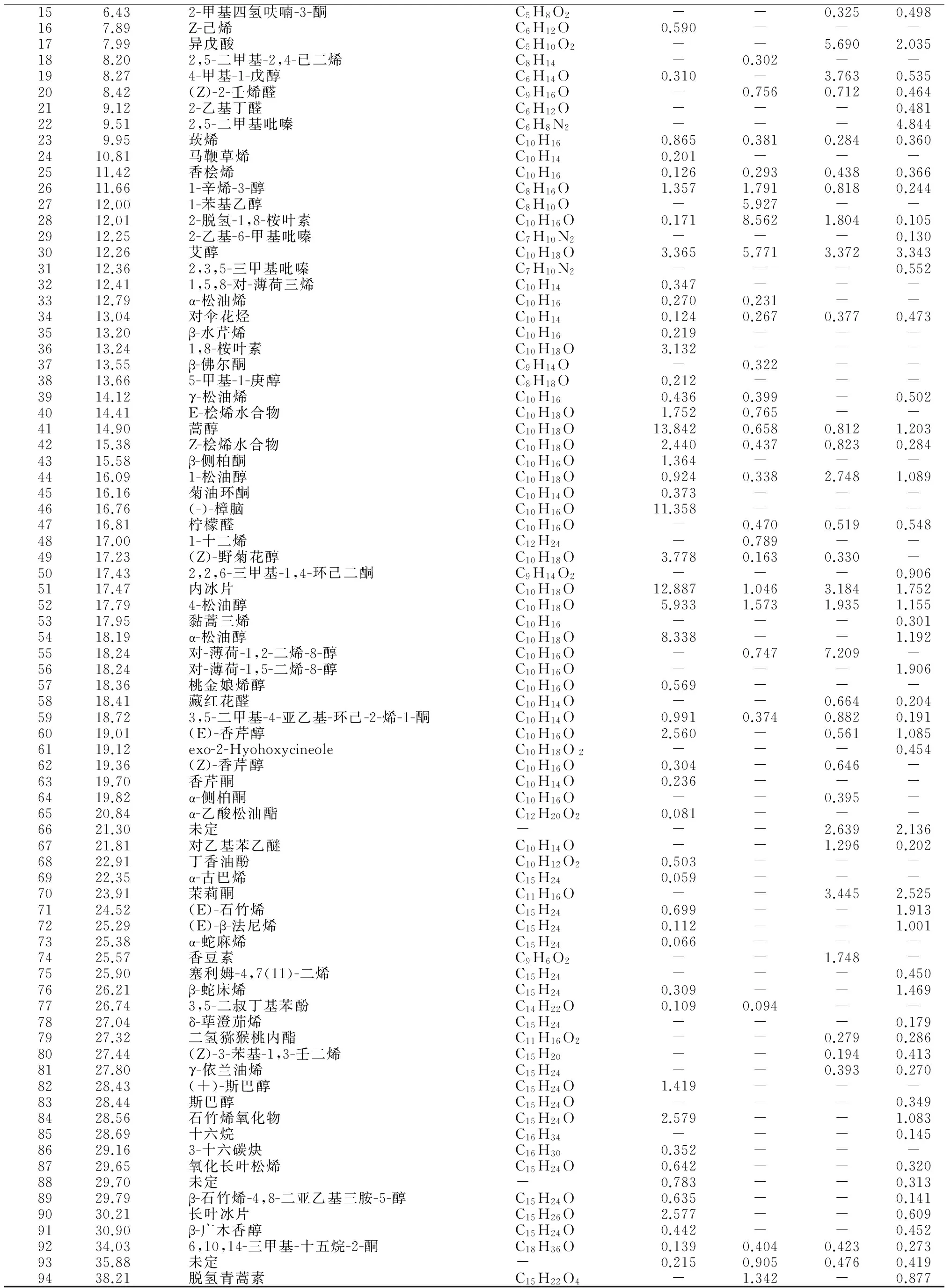
156.432-甲基四氢呋喃-3-酮C5H8O2--0.3250.498167.89Z-己烯C6H12O0.590---177.99异戊酸C5H10O2--5.6902.035188.202,5-二甲基-2,4-已二烯C8H14-0.302--198.274-甲基-1-戊醇C6H14O0.310-3.7630.535208.42(Z)-2-壬烯醛C9H16O-0.7560.7120.464219.122-乙基丁醛C6H12O---0.481229.512,5-二甲基吡嗪C6H8N2---4.844239.95莰烯C10H160.8650.3810.2840.3602410.81马鞭草烯C10H140.201---2511.42香桧烯C10H160.1260.2930.4380.3662611.661-辛烯-3-醇C8H16O1.3571.7910.8180.2442712.001-苯基乙醇C8H10O-5.927--2812.012-脱氢-1,8-桉叶素C10H16O0.1718.5621.8040.1052912.252-乙基-6-甲基吡嗪C7H10N2---0.1303012.26艾醇C10H18O3.3655.7713.3723.3433112.362,3,5-三甲基吡嗪C7H10N2---0.5523212.411,5,8-对-薄荷三烯C10H140.347---3312.79α-松油烯C10H160.2700.231--3413.04对伞花烃C10H140.1240.2670.3770.4733513.20β-水芹烯C10H160.219---3613.241,8-桉叶素C10H18O3.132---3713.55β-佛尔酮C9H14O-0.322--3813.665-甲基-1-庚醇C8H18O0.212---3914.12γ-松油烯C10H160.4360.399-0.5024014.41E-桧烯水合物C10H18O1.7520.765--4114.90蒿醇C10H18O13.8420.6580.8121.2034215.38Z-桧烯水合物C10H18O2.4400.4370.8230.2844315.58β-侧柏酮C10H16O1.364---4416.091-松油醇C10H18O0.9240.3382.7481.0894516.16菊油环酮C10H14O0.373---4616.76(-)-樟脑C10H16O11.358---4716.81柠檬醛C10H16O-0.4700.5190.5484817.001-十二烯C12H24-0.789--4917.23(Z)-野菊花醇C10H18O3.7780.1630.330-5017.432,2,6-三甲基-1,4-环己二酮C9H14O2---0.9065117.47内冰片C10H18O12.8871.0463.1841.7525217.794-松油醇C10H18O5.9331.5731.9351.1555317.95黏蒿三烯C10H16---0.3015418.19α-松油醇C10H18O8.338--1.1925518.24对-薄荷-1,2-二烯-8-醇C10H16O-0.7477.209-5618.24对-薄荷-1,5-二烯-8-醇C10H16O---1.9065718.36桃金娘烯醇C10H16O0.569---5818.41藏红花醛C10H14O--0.6640.2045918.723,5-二甲基-4-亚乙基-环己-2-烯-1-酮C10H14O0.9910.3740.8820.1916019.01(E)-香芹醇C10H16O2.560-0.5611.0856119.12exo-2-HyohoxycineoleC10H18O2---0.4546219.36(Z)-香芹醇C10H16O0.304-0.646-6319.70香芹酮C10H14O0.236---6419.82α-侧柏酮C10H16O--0.395-6520.84α-乙酸松油酯C12H20O20.081---6621.30未定---2.6392.1366721.81对乙基苯乙醚C10H14O--1.2960.2026822.91丁香油酚C10H12O20.503---6922.35α-古巴烯C15H240.059---7023.91茉莉酮C11H16O--3.4452.5257124.52(E)-石竹烯C15H240.699--1.9137225.29(E)-β-法尼烯C15H240.112--1.0017325.38α-蛇麻烯C15H240.066---7425.57香豆素C9H6O2--1.748-7525.90塞利姆-4,7(11)-二烯C15H24---0.4507626.21β-蛇床烯C15H240.309--1.4697726.743,5-二叔丁基苯酚C14H22O0.1090.094--7827.04δ-荜澄茄烯C15H24---0.1797927.32二氢猕猴桃内酯C11H16O2--0.2790.2868027.44(Z)-3-苯基-1,3-壬二烯C15H20--0.1940.4138127.80γ-依兰油烯C15H24--0.3930.2708228.43(+)-斯巴醇C15H24O1.419---8328.44斯巴醇C15H24O---0.3498428.56石竹烯氧化物C15H24O2.579--1.0838528.69十六烷C16H34---0.1458629.163-十六碳炔C16H300.352---8729.65氧化长叶松烯C15H24O0.642--0.3208829.70未定-0.783--0.3138929.79β-石竹烯-4,8-二亚乙基三胺-5-醇C15H24O0.635--0.1419030.21长叶冰片C15H26O2.577--0.6099130.90β-广木香醇C15H24O0.442--0.4529234.036,10,14-三甲基-十五烷-2-酮C18H36O0.1390.4040.4230.2739335.88未定-0.2150.9050.4760.4199438.21脱氢青蒿素C15H22O4-1.342-0.877
注:“-”为未检出。
Note: “-”means that the compound is not detected.
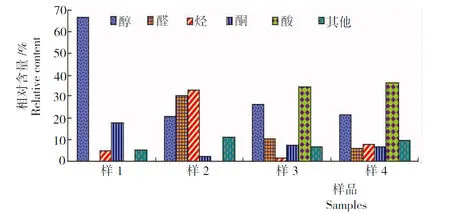
图1 不同浓缩方法所得样品挥发性成分种类及相对含量
Fig.1 Kinds and relative content of volatile components of tested samples under different concentration method
2.2 4个样品间各特有的挥发性成分对比分析
2.2.1 样1与样2 由表1可知,样1与样2相同的挥发性成分有乙酸乙酯、异丁醇、莰烯、香桧烯、1-辛烯-3-醇、2-脱氢-1,8-桉叶素、艾醇、α-松油烯、对伞花烃、γ--松油烯、E-桧烯水合物、蒿醇、Z-桧烯水合物、1-松油醇、(Z)-野菊花醇、内冰片、4-松油醇、3,5-二甲基-4-亚乙基-环己-2-烯-1-酮、3,5-二叔丁基苯酚、6,10,14-三甲基-十五烷-2-酮。
样2与样1相比,挥发性成分个数有所减少,可能是有些低沸点挥发性成分在减压浓缩过程中被水蒸气带走[15]。由图2(A)可知,样1特有的挥发性成分中醇和酮的相对含量较高,分别为20.10%和16.83%,醛的相对含量为0;样2特有的挥发性成分中醛和烃的相对含量较高,分别为30.05%和31.41%。由此可知,在50℃减压浓缩过程中,可能发生了氧化反应,将不稳定的醇氧化为醛;可能发生了消除反应,将不稳定的醇还原为烯烃;也有可能加氢反应和氧化反应或加氢反应和消除反应一起发生,将酮还原为醇,在继续氧化为醛或将酮还原为醇,再发生消除反应,还原为烯烃[16]。
2.2.2 样1与样3 由表1可知,样1与样3相同的挥发性成分有2,3-丁二酮、4-甲基-1-戊醇、莰烯、香桧烯、1-辛烯-3-醇、2-脱氢-1,8-桉叶素、艾醇、对伞花烃、蒿醇、Z-桧烯水合物、1-松油醇、(Z)-野菊花醇、4-松油醇、内冰片、3,5-二甲基-4-亚乙基-环己-2-烯-1-酮、(E)-香芹醇、(Z)-香芹醇、6,10,14-三甲基-十五烷-2-酮。
由图2(B)可知,样1特有的挥发性成分中醇和酮的相对含量较高,分别为19.51%和16.69%,醛和酸的相对含量为0;样3特有的挥发性成分中醛和酸的相对含量变化巨大,分别为0%~10.39%和34.65%。由此可知,水煎液在50℃减压浓缩时将不稳定的醇和酮经过各种反应变为醛和烃,在65℃水浴干燥成浸膏的过程中,又发生了剧烈的氧化反应,继续将不稳定的醛和烯烃氧化为酸[16]。
2.2.3 样1与样4 由表1可知,样1与样4相同的挥发性成分有2,3-丁二酮、4-甲基-1-戊醇、香桧烯、莰烯、1-辛烯-3-醇、2-脱氢-1,8-桉叶素、艾醇、对伞花烃、γ-松油烯、蒿醇、Z-桧烯水合物、1-松油醇、内冰片、4-松油醇、(α-松油醇、3,5-二甲基-4-亚乙基-环己-2-烯-1-酮、(E)-香芹醇、(E)-石竹烯、(E)-β-法尼烯、(β-蛇床烯、石竹烯氧化物、氧化长叶松烯、Caryophylla-4,8-dien-5,β-ol、长叶冰片、β-广木香醇、6,10,14-三甲基-十五烷-2-酮。
由图2(C)可知,样1中醛和酮的相对含量较高,分别为11.60%和13.33%,醛和酸的相对含量为0;样4中酸的相对含量较高,为36.08%。由此可知,文火煎煮+65℃水浴干燥成浸膏过程中发生了轻微的和剧烈的氧化反应,将醇和酮氧化为醛和酸[16]。
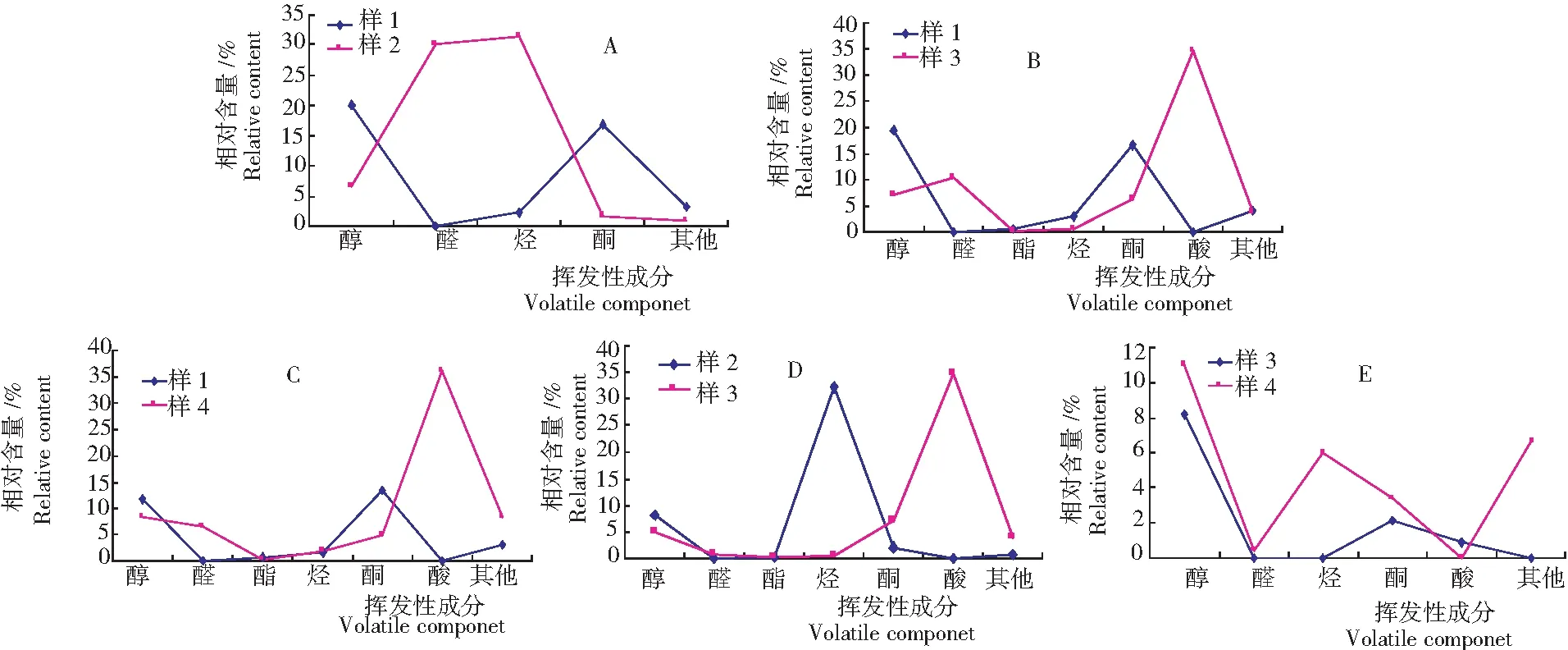
图2 4个样品间各特有的挥发性成分相对含量
2.2.4 样2与样3 由表1可知,样2与样3相同的挥发性成分有异丁醛、3-甲基丁醛、2-甲基丁醛、己醛、(Z)-2-壬烯醛、莰烯、香桧烯、1-辛烯-3-醇、艾醇、2-脱氢-1,8-桉叶素、对伞花烃、Z-桧烯水合物、蒿醇、1-松油醇、柠檬醛、(Z)-野菊花醇、4-松油醇、内冰片、对-薄荷-1,2-二烯-8-醇、3,5-二甲基-4-亚乙基-环己-2-烯-1-酮、6,10,14-三甲基-十五烷-2-酮。
由图2(D)可知,样2中烃含量最高,为32.04%,其次是醇,为8.06%,醛和酸的相对含量为0;样3中酸的含量最高,为34.65%,其次是酮,为7.13%,烃和醛的相对含量较少,分别为0.59%和0.66%。由此可知,样3在水浴的过程中,主要发生了剧烈的氧化反应,将烃氧化为酸[16]。
2.2.5 样3与样4 由表1可知,样3与样4相同的挥发性成分有异丁醛、2,3-丁二酮、乙酸、3-甲基丁醛、2-甲基丁醛、己醛、2-甲基四氢呋喃-3-酮、异戊酸、4-甲基-1-戊醇、(Z)-2-壬烯醛、莰烯、香桧烯、1-辛烯-3-醇、2-脱氢-1,8-桉叶素、艾醇、对伞花烃、蒿醇、Z-桧烯水合物、1-松油醇、柠檬醛、4-松油醇、内冰片、3,5-二甲基-4-亚乙基-环己-2-烯-1-酮、藏红花醛、(E)-香芹醇、对乙基苯乙醚、茉莉酮、二氢猕猴桃内酯、(Z)-3-苯基-1,3-壬二烯、γ-依兰油烯、6,10,14-三甲基-十五烷-2-酮。
由图2(E)可知,样3中醇和酮的相对含量较高,为8.19%和2.14%;醛和烃的相对含量为0。样4中醇的相对含量最高,为10.94%;其次是其他成分和酮,分别为6.71%和5.96%;酸的相对含量为0。由此可知,50℃减压+65℃水浴干燥浸膏与文火煎煮+65℃水浴干燥浸膏2种浓缩方法对青蒿-陈艾水煎液挥发性成分的影响差异不大[16]。
3 结论与讨论
试验采用文火煎煮法提取青蒿-陈艾中的挥发性成分,并采用与民间文火煎煮浓缩相似的浓缩方法文火煎煮法浓缩,同时还采用现代实验室常用的浓缩方法50℃减压旋转浓缩法,并用顶空固相微萃取-气相色谱/质谱法分析青蒿-陈艾浓缩前后、不同浓缩方法挥发性成分的影响,用面积归一化法测定其相对百分含量。结果表明,4种浓缩方法所得样品的挥发性成分在种类和含量上均存在较大差异。
水煎液、50℃减压旋转浓缩液、50℃减压旋转+65℃水浴干燥浸膏、文火煎煮+65℃水浴干燥浸膏4个样品在挥发性成分上既有相同的组分又有各自特有的组分。首先,无论是50℃减压旋转浓缩还是文火煎煮浓缩,浓缩后醇类、酮类物质的含量都显著下降,酸类物质的含量显著增加,烃类和醛类物质的含量在50℃旋转减压浓缩后显著增加,但65℃水浴干燥成浸膏后,又显著下降。其次,水煎液、50℃减压旋转浓缩液、50℃减压旋转浓缩+65℃水浴干燥浸膏、文火煎煮浓缩+65℃水浴干燥浸膏共有的挥发性成分有14种,为莰烯、香桧烯、1-辛烯-3-醇、艾醇、2-脱氢-1,8-桉叶素、对伞花烃、蒿醇、1-松油醇、内冰片、4-松油醇、(Z)-桧烯水合物、3,5-二甲基-4-亚乙基-环己-2-烯-2-酮、6,10,14-三甲基-十五烷-2-酮。该结果表明,这些化合物结构非常稳定,不受浓缩方法的影响。最后,从50℃减压旋转浓缩+65℃水浴干燥浸膏与文火煎煮浓缩+65℃水浴干燥浸膏挥发性成分种类的变化情况可以总结得出,50℃减压旋转浓缩与文火煎煮浓缩最后所得的挥发性成分种类相似,差异不大,但文火煎煮浓缩比50℃减压旋转浓缩发生的化学反应更为剧烈,50℃减压旋转浓缩更能保持煎煮液的色泽。但若从生产实践的角度考虑,可选择样4(文火煎煮+65℃水浴干燥)浓缩方法,其与样1共有挥发性成分的种类最多为26种,且该法操作简便。
[1] 何道文,马有度.大众中医药[M].北京:中国广播电视出版社,1986.
[2] 孟昭蓉,辛力华,张文胜,等.中药防疫熏剂在突发公共卫生事件中作用探讨[J].中华医院感染学杂志,2011,21(13):2755-2756.
[3] 候宝华.治疗仔猪白痢的药物组合物[P].中国专利:201110236357.6:2013-02-13.
[4] 郑汉臣,蔡少青.药用植物学与生药学[M].北京:人民卫生出版社,2005:422-423.
[5] 张秋红,朱子微,李 晋.中药青蒿化学成分与种植研究现状[J].中国医药导报,2011,8(19):10-12.
[6] 金美花.青蒿的药理作用与临床新用[J].现代医药卫生,2009,25(15):2352-2352.
[7] 田小曼,吴云锋,张 珏.青蒿内生菌的分离及抗病活性物质的筛选[J].西北农业学报,2008,17(4):186-190.
[8] 沈铬高,金 阳,沈国军.艾草化学成分的GC/MS分析[J].中国林副特产,2008(3):26-28.
[9] 沈铭高.对艾草生物活性的研究[J].安徽农业科学,2008,36(20):8636-8636.
[10] 刘永国,张晓梅,艾娜丝,等.同时蒸馏萃取-气质联用分析艾草挥发性成分[J].食品工业科技,2013,34(6):170-177.
[11] 周 峰,秦路平,连佳芳,等.艾叶的化学成分、生物活性和植物资源[J].药学实践杂志,2000,18(2):96-98.
[12] 刘文英.药物分析[M].北京:人民卫生出版社,2007.
[13] 刘为广,张 东,杨 岚.HS-SPME-GC/MS法分析紫萁挥发性化学成分[J].中国实验方剂学杂志,2011,17(8):63-66.
[14] 曹 敏,王建刚.紫丁香鲜花挥发性成分的HS-SPME-GC/MS法分析[J].化学工程师,2010(8):23-25.
[15] 吴立军,娄红祥,周 晶.天然药物化学[M].北京:人民卫生出版社,2011.
[16] 闻 韧.药物合成反应[M].北京:化学工业出版社,2010.
(责任编辑: 孙小岚)
Effects of Different Concentration Methods on Volatile Components ofArtemisiaannua-Artemisiaargyi
LI Chunyan1,2, CHEN Yuangu1,2, ZENG Ting2, WANG Ruoyan3, YANG Juan2*
(1.CollegeofPharmacy,GuizhouUniversity,Guiyang,Guizhou550025, 2.GuizhouKeyLaboratoryforChemistryofNaturalProducts,ChineseAcademyofSciences,Guiyang,Guizhou550002; 3.TheTechnologicalCenterofZunyiTobaccoCompany,Zunyi,Guizhou563000,China)
A.annua-A.argyiwas decocted under mild fire, then concentrated by 50℃ decompression rotation, 50℃ decompression rotation + 65℃ water bath and 65℃ water bath methods respectively. The volatile components and content of the extracts from different concentration methods were analyzed and determined by HS-SPME-GC/MS and area normalization method to screen the optimum concentration method ofA.annua-A.argyi. Results:54 volatile components are identified from the extract under water decoction method and the content of alcohol and ketone is higher. 35 volatile components are identified from the extract under 50℃ decompression rotation concentration method and the content of aldehydes, hydrocarbon and alcohol is higher. 39 volatile components are identified from the extract under 50℃ decompression rotation + 65℃ water bath concentration method and the content of acids, alcohol and aldehydes is higher. 58 volatile components are identified from the extract under mild fire decoction + 65℃ water bath concentration method and the content of acids and alcohol is higher. 14 kinds of volatile components are detected from four samples and 26 kinds of volatile components are detected from the sample under water decoction and the sample under mild fire decoction + 65℃ water bath concentration. Different concentration methods have different effects on kinds and content of volatile components inA.annua-A.argyi. The optimum concentration method forA.annual-A.argyiis mild fire decoction + 65℃ water bath concentration method.
Artemisiaannua-Artemisiaargyi; volatile component; concentration; headspace SPME; GC-MS
2014-11-12; 2015-06-15修回
贵州省烟草公司遵义市公司科技项目“烤烟专用植物提取物复配剂研究与开发”[遵烟技 (2013)6号201312]
李春燕(1989-),女,在读硕士,研究方向:药物化学。E-mail:1251585306@qq.com
*通讯作者:杨 娟(1971-),女,研究员,博士,从事天然活性成分研究。E-mail:yangxz2002@126.com
1001-3601(2015)07-0387-0159-05
S567.1; R284.1
A

