磷尾矿表层土壤解磷菌的筛选及鉴定
田 多, 王修俊*, 周沅洁, 王纪辉, 刘佳慧, 尹 爽
(1.贵州大学 酿酒与食品工程学院, 贵州 贵阳 550025; 2.贵州省发酵工程与生物制药重点实验室, 贵州 贵阳 550025)
磷尾矿表层土壤解磷菌的筛选及鉴定
田 多1,2, 王修俊1,2*, 周沅洁2, 王纪辉2, 刘佳慧2, 尹 爽2
(1.贵州大学 酿酒与食品工程学院, 贵州 贵阳 550025; 2.贵州省发酵工程与生物制药重点实验室, 贵州 贵阳 550025)
为实现废弃资源利用、提高磷利用率,采用无机磷培养基筛选、透明圈试验、形态学观察、生理生化测定以及16S rDNA序列测定等方法对磷尾矿表层土壤中解磷菌进行研究。结果表明:从磷尾矿表层土壤中分离出具有解磷效果的菌株11株,命名为K1~K11,其中,K4和K7菌株的解磷能力较强;接种K4和K7菌株的无机磷发酵液发酵2 d后其磷含量分别达335.47 μg/mL和282.31 μg/mL,Ca3(PO4)2分解率分别达16.83%和14.16%。经鉴定,K4属荧光假单胞菌,K7属胶质芽孢杆菌。
磷尾矿; 解磷菌; 废弃资源; 磷利用率
磷矿是化学矿物的一种,2005年全球磷矿产量达1.85亿t[1]。我国虽是磷矿生产和使用大国[2],但80%磷矿为中低品位[3],富矿稀少[4],且由于选矿技术落后,每年产生的磷尾矿达700万t左右[5]。
磷尾矿是磷矿开采浮选后的副产物,磷含量低,有害杂质含量较高,进一步投入工业生产成本高,且无法实现预期的经济价值,从而成为生产的负累。因此,大量的磷尾矿未能得到利用,甚至被无控地堆积、废弃,造成巨大的资源浪费,环境也受到严重破坏[6-7]。如何处理废弃的磷尾矿,成为各大矿业公司的技术与环境难题。
N、P和K等元素的缺乏是限制作物增产的主要因素,我国农田土壤普遍缺磷,而磷在土壤中大多以难溶的形态存在,植物对土壤磷元素的利用率很低,严重影响植物生长特别是农作物的产量[8],施肥是影响土壤质量及其可持续利用的农业措施之一[9],但施肥不科学易导致产量低、品质不稳[10]。目前,有关如何提高植物对磷利用率的研究国内已有文献报道。李蓉[11]从杉木根际筛选出有机、无机解磷菌各12株。李剑峰[12]筛选苜蓿根瘤菌和红豆草根瘤菌LW107、RSW96,在固氮的同时能够转化一部分有效磷。王义[13]通过试验筛选得到37株解磷菌,其中,5株为高效解磷菌,并通过大豆大棚试验验证。俞新玲[14]筛选得到解磷菌7株,分别为芽孢杆菌属、葡萄球菌属和梭形杆菌属,其对磷酸一氢钙的解磷活力较强。叶震[15]筛选得到解磷菌13株,分别为欧文氏菌、假单胞菌和蒲城沙雷菌。贺梦醒[16]从尾矿废弃处根际土样筛选得到2株解磷菌,分别为芽孢杆菌和出芽短梗霉菌。贵州各大矿业公司普遍存在磷尾矿大量堆积无法利用的现象,为此,笔者于2012年对贵州磷尾矿表层土壤的微生物进行研究,以期能筛选出具有高效解磷能力的微生物,为实现微生物降解磷尾矿渣和废弃资源利用做出贡献,并为生产含磷有机肥料奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 土壤 参考黄新荣等[17]的方法从贵州瓮福(集团)有限责任公司磷尾矿渣堆积处采集表层土壤。
1.1.2 仪器与设备 漩涡混合器,海门其林贝尔仪器制造有限公司;移液枪,大龙医疗设备(上海)有限公司;垂直净化工作台,上海博迅实业有限公司;手提式灭菌锅,浙江新丰医疗器械有限公司;恒温恒湿培养箱,博讯实业有限公司医疗设备厂;恒温振荡器,常州澳华仪器有限公司;722S分光光度计,上海精密科学仪器有限公司。
1.1.3 试剂 硫酸铵、硫酸镁、硫酸锰、硫酸亚铁、磷酸钙、酒石酸氧锑钾、钼酸铵、左旋抗坏血酸、浓硫酸等,均为分析纯。
0.5 mol/L NaHCO3浸提液:溶解NaHCO342.0 g于800 mL水中,以0.5 mol/L NaOH溶液调节浸提液的pH至8.5。
磷标准溶液:准确称取在105℃烘箱中烘干的KH2PO4(分析纯)0.219 5 g,溶解在400 mL水中,加入浓H2SO45 mL(加H2SO4防长霉菌,可使溶液长期保存),转入1 L容量瓶中,加水至刻度。此溶液为50 μg/mL P标准溶液。
1.1.4 培养基
1) 牛肉膏蛋白胨液体培养基。牛肉膏3 g,蛋白胨10 g,NaCl 5 g,蒸馏水1 000 mL,pH7.2~7.4,121℃灭菌30 min。
2) 牛肉膏蛋白胨固体培养基。牛肉膏蛋白胨液体培养基中加入20 g琼脂粉,121℃灭菌30 min。
3) 无机磷液体培养基。葡萄糖10 g、(NH4)2SO40.5 g、NaCl 0.3 g、KCl 0.3 g、MgSO4·7H2O 0.3 g、FeSO4·7H2O 0.03 g、MnSO4·4H2O 0.03 g、Ca3(PO4)210 g、蒸馏水1 000 mL,121℃灭菌30 min。
4) 无机磷固体培养基。无机磷液体培养基中加入20 g琼脂粉,121℃灭菌30 min。
1.1.5 其他 无磷活性炭。活性炭常含有磷,需做空白试验检验有无磷存在。
1.2 菌种的分离
1.2.1 富集培养 将采集的土样加入适当无菌水润湿,放入30℃的恒温培养箱中静置,富集培养若干天。然后取5 g土样置于250 mL三角瓶中,加入玻璃珠和无菌水50 mL,在摇床上,以120 r/min的转速持续20 min。取0.2 mL菌悬液装于有50 mL牛肉膏蛋白胨液体培养基的250 mL三角瓶中,30℃摇床培养4 d。
1.2.2 纯化培养 将富集后的菌液稀释5个梯度,分别为10-1~10-5,涂布于牛肉膏蛋白胨固体培养基上,30℃培养2~3 d。待平板上的菌落可分辨时,在无菌条件下,将菌落接种至牛肉膏蛋白胨固体培养基上,划线分离,30℃下恒温静置培养3 d后转接,直至得到单菌落。
1.3 菌种解磷能力测定
1.3.1 溶磷圈测量 在无菌条件下,将纯化后的单菌用无菌水稀释,然后点接于无机磷固体培养基上,3个平行,30℃下恒温静置培养1~3 d后观察。有透明溶磷圈者即为解磷菌株,将得到的解磷菌株命名为Ki(i=1,2,3…n)。测量菌落直径(φ)和透明圈直径(Φ),计算透明圈与菌落直径比(Φ/φ)。将解磷菌株纯化后接种于试管斜面上,4℃冰箱保藏备用。选择透明圈直径与菌落直径比(Φ/φ)较大的菌株进行解磷能力定量测定。
1.3.2 种子液的制备 1) 活化。配置牛肉膏蛋白胨液体培养基,分装于250 mL窄口三角瓶中,每瓶100 mL,每菌2个平行。灭菌、冷却、备用。在无菌条件下将解磷菌K4、K7、K9,从斜面上接种到三角瓶中,30℃恒温摇床培养24 h。2) 发酵。配置无机磷液体培养基,分装于250 mL广口三角瓶中,每瓶100 mL,每菌2个平行。灭菌、冷却、备用。将活化后的液体菌液,按照5%的接种量,接种于广口瓶中,30℃恒温摇床培养2 d。对照接入与解磷菌等体积的无菌水。
1.3.3 测定方法 1) 绘制标准曲线。分别准确吸取5 μg/mL磷标准溶液0 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL和5.0 mL放入150 mL三角瓶后,加入0.5 mol/LNaHCO3溶液10 mL,并加水使各瓶的总体积达45 mL,摇匀;然后加入钼锑抗试剂5 mL混匀显色;绘成标准曲线。最后溶液中磷的浓度分别为0 μg/mL、0.1 μg/mL、0.2 μg/mL、0.3 μg/mL、0.4 μg/mL和0.5 μg/mL。2) 样品测定。将待测解磷菌活化后接种至无机磷液体培养基,30℃培养2 d后,按照上述方法,对无机磷发酵液进行前处理,用分光光度计测定其光吸收值。将试验得出的吸光度值,在标准曲线上查出对应的磷浓度,再根据公式计算出发酵液中的有效磷含量(mg/kg)。计算公式如下:
式中:ρ,从工作曲线上查得P的质量浓度(μg/mL);V,显色时定容体积(mL);ts,为分取倍数(即浸提液总体积与显色对吸取浸提液体积之比);m,风干土质量(g);k,将风干土换算成烘干土质量的系数。
1.4 菌种的鉴定
1.4.1 菌种的形态特征 1) 菌落形态特征观察。将解磷菌株接种于平板上,在恒温培养箱中30℃培养3~5 d,观察菌落形态,并记录。2) 菌株个体形态特征观察。对解磷菌株个体形态进行观察,分别进行镜检、革兰氏染色、鞭毛染色、芽孢染色和运动性观察等试验,并记录。
1.4.2 菌种测序
1) 提取基因。按照生工SK1201-UNIQ-10柱式细菌基因组DNA抽提试剂盒说明书提取。对菌株进行基因DNA的提取纯化,16S rDNA序列分析参考汪华等[19]的鉴定方法进行。
上引物序列:P1(5’-CAGAGTTTGATCCTGGCT-3’)
下引物序列:P2(5’-AGGAGGTGATCCAGCCGCA-3’)
2) PCR反应体系(25 μL)。模板DNA 1 μL,10 μmol/L前引物0.5 μL,10 μmol/L后引物0.5 μL,10 mmol/L dNTP 0.5 μL,10×PCR Buffer 2.5 μL,TaqDNA聚合酶0.2 μL,加水至25 μL。
3) PCR反应条件。94℃预变性5 min;94℃变性30 s,55℃复性35 s,72℃延伸1 min,35个循环,延伸8 min。反应结束后,以琼脂糖凝胶电泳对DNA产物进行鉴定,纯化回收产物并鉴定。
1.5 菌种的生理生化特性测定
1.5.1 耐温性 将解磷菌株接种于平板上,分别在4℃、10℃、20℃、30℃、37℃、41℃、45℃和65℃的恒温培养箱中培养3~5 d,观察菌株生长情况并记录。
1.5.2 pH耐受性 配置固体培养基,并用HCl、NaOH调节培养基的pH分别为4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5和11,灭菌倒平板、冷却后接种,30℃下培养3~5 d后观察菌株生长情况并记录。
1.5.3 耐盐性 配置固体培养基,并用NaCl调节培养基的盐浓度,使其分别为1%、2%、3%、4%、5%、6%和7%。灭菌倒平板、冷却后接种,30℃下培养3~5 d后观察菌株生长情况并记录[18]。
1.5.4 其他生理生化特性 参照《常用细菌系统鉴定手册》考察解磷菌株的荧光色素、接触酶、淀粉水解、明胶液化、V-P测定、吲哚、甲基红、硝酸盐还原、过氧化氢酶等指标。
2 结果与分析
2.1 解磷菌的菌株分离
将纯化后的菌种接种于无机磷固体培养基中,其中,有11株菌株能够产生透明圈,说明其具有一定的解磷能力,确定为解磷菌株,按1.3.1中所述命名为K1~K11。从表1可知,解磷菌K2、K5、K7、K9和K10的透明圈直径均≥10 mm,解磷菌K1、K4、K8和K11的透明圈直径均≥8 mm,解磷菌K4、K7和K9的透明圈直径与菌落直径比(Φ/φ)均超过2,说明,解磷菌K4、K7和K9具有相对优势的解磷能力。
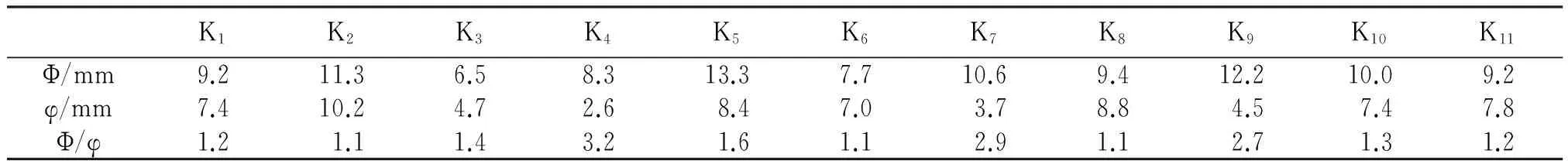
表1 解磷菌不同菌株的透明圈与菌落直径
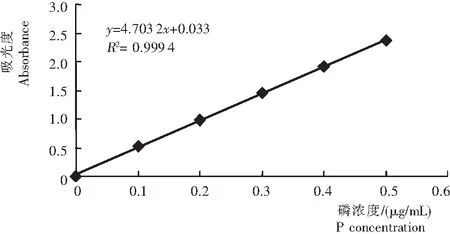
图1 有效磷的标准曲线
Fig.1 The standard curve of available phosphorus in soil
2.2 解磷菌株的解磷能力
2.2.1 标准曲线绘制 从图1可见,各测试点分布均匀,均在直线y=4.703 2x+0.033(R2=0.999 4>0.99)附近。说明,其线性关系很好,标准品稀释梯度恰当,加样误差较小,对试验结果的影响较小。
2.2.2 解磷菌株的解磷效果 对接种解磷菌K4、K7、K9菌株2 d后的无机磷发酵液进行磷含量测定发现:K4和K7菌株对发酵液中Ca3(PO4)2的分解率分别为16.83%和14.16%,发酵液有效磷含量分别为335.47 μg/mL和282.31 μg/mL,均超过200 μg/mL,与空白(18.72 μg/mL)相比,差异显著;K9菌株对发酵液中Ca3(PO4)2的分解率为2.52%,发酵液中有效磷含量只有50.32 μg/mL,与空白之间的差异不显著。说明,K4、K7菌株具有明显的解磷能力,K9菌株解磷效果不明显。后续试验对K4、K7菌株进行菌种鉴定。
2.3 菌种鉴定
2.3.1 形态观察 K4菌株为杆菌,革兰氏染色呈阴性、无芽孢、有单极生鞭毛,能运动,菌落颜色为淡黄色,菌落形态呈光滑的圆形;K7菌株为杆菌,革兰氏染色呈阴性,有椭圆形芽孢,有周生鞭毛,能运动、菌落颜色无色透明,菌落形态呈光滑的圆形。
2.3.2 菌种的耐受性 K4菌株的耐受温度为4~41℃,耐受pH为6~8.5,耐盐浓度为6%;K7菌株的耐受温度为10~45℃,耐受pH为6~9,耐盐浓度为3%。
2.3.3 生理生化指标 从表2可知,16组生理生化试验中,呈现阳性、阴性和未反应的组数K4菌株分别为10组、3组、3组,K7菌株为5组、8组、3组。
表2 解磷菌K4和K7的生理生化试验结果
Table 2 Physiological and biochemical results of K4and K7Strains of phosphate dissolving bacteria
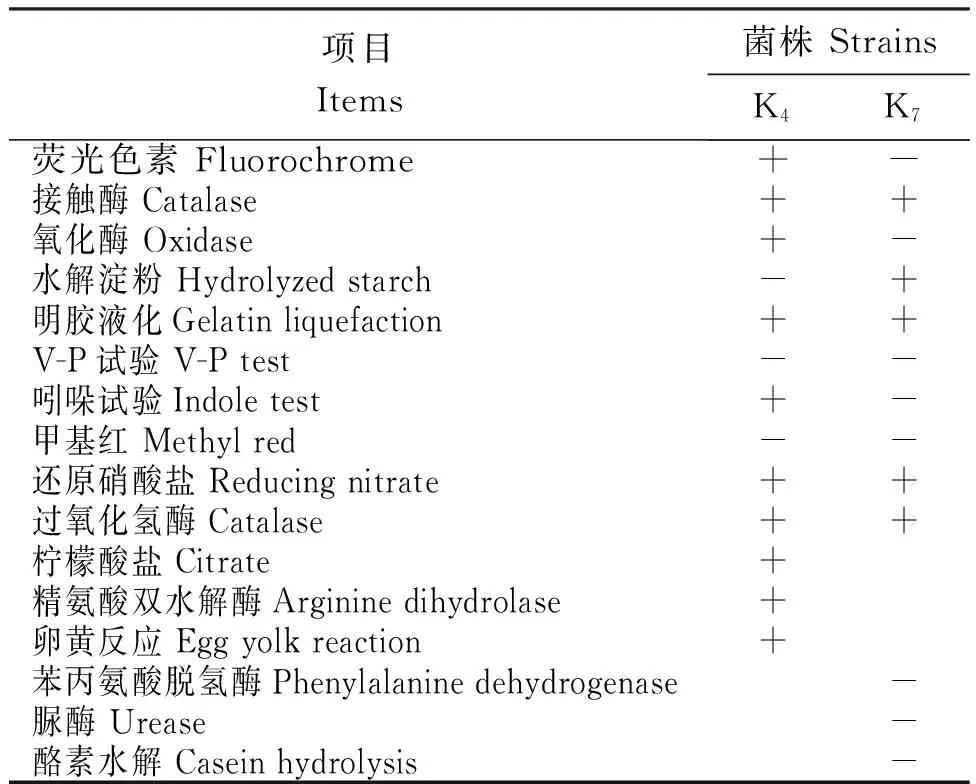
项目Items菌株StrainsK4K7荧光色素Fluorochrome+-接触酶Catalase++氧化酶Oxidase+-水解淀粉Hydrolyzedstarch-+明胶液化Gelatinliquefaction++V-P试验V-Ptest--吲哚试验Indoletest+-甲基红Methylred--还原硝酸盐Reducingnitrate++过氧化氢酶Catalase++柠檬酸盐Citrate+精氨酸双水解酶Argininedihydrolase+卵黄反应Eggyolkreaction+苯丙氨酸脱氢酶Phenylalaninedehydrogenase-脲酶Urease-酪素水解Caseinhydrolysis-
注:空白表示未发生反应。
Note: Black means that the reaction is not occurred.
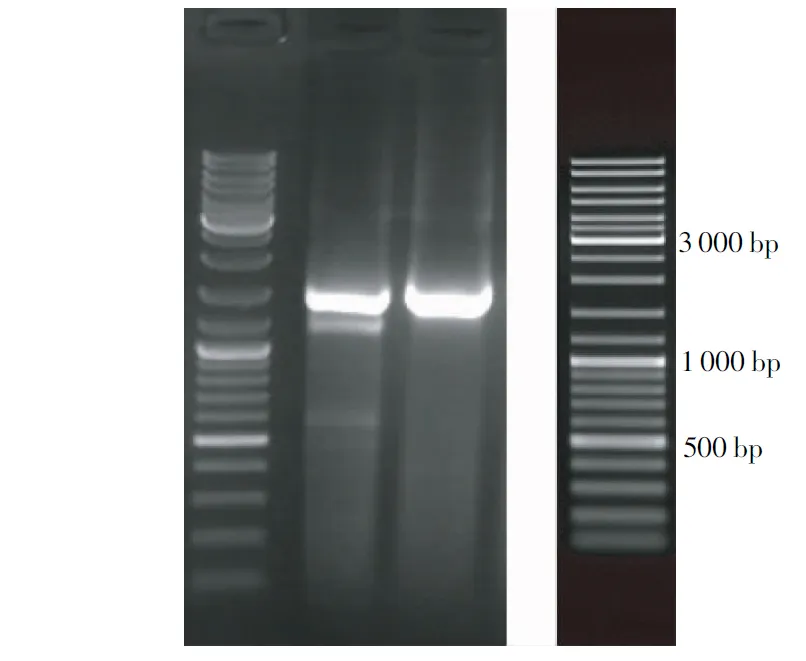
注:左图为K4和K7菌株的PCR产物电泳图谱,右图为DNA Marker。
Note:Left, Electrophoretogram of PCR products of K4and K7strains; Right, DNA marker.
图2 解磷菌K4和K7的PCR产物电泳图谱
Fig.2 Electrophoretogram of PCR products of K4and K7strains

注:左为K4菌株,右为K7菌株。
Note: Left, K4strain; Right, K7strain.
图3 解磷菌K4和K7的16S rDNA序列
Fig.3 16S rDNA sequence of K4and K7strains
2.3.4 16S rDNA序列测定 从图2可知,在1 200~1 500 bp出现2条明显的亮带,说明,PCR扩增成功,满足DNA序列测定要求;且K4和K7菌株的分子量接近,均处于1 200~1 500 bp。从图3可知,K4菌株属细菌域—变形菌门—γ-变形菌纲—假单胞菌目—假单胞菌科—假单胞菌属—荧光假单胞菌。K7菌株属细菌域—厚壁菌纲—芽孢杆菌目—芽孢杆菌科—类芽孢杆菌属—胶质芽孢杆菌。
3 结论与讨论
1) 研究结果表明,从磷尾矿表层土壤分离筛选出解磷菌11株。其中,K4、K7和K9菌株的透明圈直径与菌落直径比(Φ/φ)均超过2,说明,有一定的解磷效果。
2) K4和K7菌株的解磷能力相对较强。接种K4的无机磷发酵液发酵2 d后磷含量达335.47 μg/mL,Ca3(PO4)2分解率达16.83%;K7略低于K4,发酵液中磷含量达282.31 μg/mL,Ca3(PO4)2分解率达14.16%。
3) 通过形态观察、耐受性试验、生理生化试验及16S rDNA测序,最终确定K4属荧光假单胞菌,K7属于胶质芽孢杆菌。
[1] 李海廷.我国磷矿资源的合理开发利用[J].中国石油和化工,2006,24(8):20-23.
[2] K Rinu. Anita Pandey Temperature-dependent phosphate solubilization by cold- and pH-tolerant species of Aspergillus isolated from Himalayan soil[J].Mycoscience,2010,51:263-271.
[3] 孙洪丽,刘全军,林文军.我国磷矿发展现状及可持续性发展[J].云南冶金,2006,35(4):13-15.
[4] 贺周初.我国磷资源开发利用现状与发展方向探讨[J].矿冶工程,2012(6):128-131.
[5] 尹丽文.中国磷矿资源分布及开发建议[J].资源与人居环境,2009,10(10):26-27.
[6] 王金玲,叶力佳,申士富.选磷尾矿中磷的综合回收[J].中国有色金属,2012(22):66-67.
[7] 李露莉,邱树毅,王义娟,等.一株黑曲霉转化低品位磷尾矿能力的研究[J].中国农学通报,2010,26(20):335-338.
[8] 郑世仲,江胜滔,黄燕翔.土壤中有机磷解磷细菌的分离筛选及鉴定[J].安徽农学通报,2009,15(15):24-26.
[9] 喻田甜,彭思利,朱 劲,等.施肥对潮土肥际微域微生物数量分布的影响[J].贵州农业科学,2014,42(3):83-87.
[10] 罗光琼,赵仁全,周 勇,等.种植密度及氮、磷、钾肥对薏仁产量的影响[J].贵州农业科学,2014,42(7):77-80.
[11] 李 蓉.杉木PGPR菌分离筛选及其微生物复合菌肥研制[D].长沙:中南林业科技大学,2012.
[12] 李剑峰.解磷根瘤菌诱变选育及抗污染菌剂制备关键技术研究[D].兰州:甘肃农业大学,2011.
[13] 王 义.热带土壤解磷菌的筛选和种类鉴定及利用的初步评价[D].海口:海南大学,2009.
[14] 俞新玲.桉树土壤高效解磷菌的筛选及其对桉树生长的影响[D].福州:福建农林大学,2011.
[15] 叶 震.东祁连山高寒草地土壤优良解磷细菌的研究[D].兰州:甘肃农业大学,2010.
[16] 贺梦醒.尾矿废弃地优势植物根际解磷菌的筛选、鉴定及其对植物生长的影响[D].合肥:安徽大学,2011.
[17] 黄新荣,黄承标,覃其云,等.不同密度马尾松人工林土壤肥力的差异[J].贵州农业科学,2015,43(1):135-139.
[18] 王 芳,沙桦欣,马焕成,等.云南干热河谷地区台湾相思树根瘤菌的抗逆性[J].贵州农业科学,2014,42(3):88-93.
[19] 汪 华,杨立军,曾凡松,等.鄂西北小麦全蚀病病原菌的分离与鉴定[J].贵州农业科学,2014,42(1):98-101.
(责任编辑: 王 海)
Screening and Identification of Phosphate Dissolving Bacteria in Surface Soil of Phosphate Tailings
TIAN Duo1,2, WANG Xiujun1,2*, ZHOU Yuanjie2, WANG Jihui2, LIU Jiahui2, YIN Shuang2
(1.SchoolofLiquorandFoodEngineering,GuizhouUniversity,Guiyang,Guizhou550025; 2.GuizhouKeyLaboratoryofFermentationEngineeringandBiologicalPharmacy,Guiyang,Guizhou550025,China)
Phosphate dissolving bacteria in surface soil of phosphate tailings were studied by selection of inorganic phosphorus medium, transparent zone test, morphological observation, physiological and biochemical determination and 16S rDNA sequence analysis to screen strains with phosphate dissolving capacity, realize utilization of waste resources and improve utilization rate of phosphate.Results:11 strains (K1~K11) with phosphate dissolving capacity are isolated. K4and K7strains have the strong phosphate dissolving capacity. The phosphate content of K4and K7strains inoculated on inorganic phosphate fermentation liquor after 2 d reaches 335.47 μg/mL and 282.31 μg/mL and their Ca3(PO4)2decomposition rates are 16.83% and 14.16% respectively. K4and K7strain is identified asPseudomonasfluorescensandBacillusmucilaginosusseparately.
phosphate tailings; phosphate dissolving bacteria; waste resources; phosphate utilization rate
2015-03-08; 2015-06-19修回
贵州省社会发展攻关项目“基于生物技术的磷尾矿渣与秸秆综合利用技术研发”[黔科合SY(2010)3041];生物重大专项“调味品行业酶应用与酿造共性关键技术研发”[筑科农合(2010)8-2]
田 多(1992-),男,在读硕士,研究方向:畜产品加工及贮藏工程。E-mail:1058550572@qq.com
*通讯作者:王修俊(1965-),男,教授,从事发酵工艺方面的研究。E-mail:wangxiujun678@sohu.com
1001-3601(2015)07-0397-0202-04
S154.39
A

