西妥昔单抗对人胰腺癌细胞SW1990、PANC-1的影响研究
韩慧芳,史健
·论著·
西妥昔单抗对人胰腺癌细胞SW1990、PANC-1的影响研究
韩慧芳,史健
目的探讨西妥昔单抗对人胰腺癌细胞SW1990、PANC-1的影响。方法常规培养人胰腺癌细胞SW1990、PANC-1,分别加入12.5、25.0、50.0、100.0 μg/ml浓度的西妥昔单抗,分别于24、48、72 h时在显微镜下观察细胞形态,计算细胞抑制率;再加入DMEM培养基(空白对照组)、最佳细胞抑制浓度西妥昔单抗DMEM培养基(实验组),采用流式细胞技术检测细胞周期,Westen blot法检测细胞EGFR、β-catenin蛋白表达。结果100 μg/ ml西妥昔单抗作用24 h时对人胰腺癌细胞SW1990、PANC-1的抑制率最高,西妥昔单抗对人胰腺癌细胞SW1990、PANC-1的抑制作用呈时间和浓度依赖性。实验组人胰腺癌细胞SW1990、PANC-1 G0/G1期细胞比例较空白对照组增加,S期、G2/M期细胞比例较空白对照组减少。实验组人胰腺癌细胞SW1990、PANC-1的EGFR、β-catenin蛋白表达均较对照组减少。结论西妥昔单抗对人胰腺癌细胞SW1990、PANC-1具有抑制作用,且呈时间和浓度依赖性,其可能作用机制为阻断Wnt/β-catenin/EGFR信号通路。
胰腺肿瘤;西妥昔单抗;受体,表皮生长因子;分子靶向治疗
胰腺癌是一种恶性度极高的恶性肿瘤,约占全部恶性肿瘤的2%,早期诊断率低,治疗效果不理想,预后差,病死率接近100%,5年生存率不足5%。手术是目前胰腺癌的主要治疗手段,但即使进行了根治性肿瘤切除手术,患者术后5年生存率也仅为15%~25%,而许多胰腺癌患者因多种原因无法进行手术治疗,经一线化疗药物吉西他滨治疗的胰腺癌患者中位生存期仅为5.7个月,1年生存率仅为16%~19%[1]。
西妥昔单抗是由鼠表皮生长因子受体(EGFR)单抗M225可变区和人IgG1恒定区相融合而成的单克隆抗体,2004年2月被批准用于经伊立替康治疗后复发的转移性结肠癌,体外实验研究发现,西妥昔单抗可抑制多种肿瘤细胞系生长[2-7];临床研究发现,西妥昔单抗能抑制人非小细胞肺癌(NSCLC)细胞增殖,联合放疗或化疗(如顺铂)等具有协同抑制肿瘤作用[8]。本研究旨在探讨西妥昔单抗对人胰腺癌细胞SW1990、PANC-1的影响。
1 材料与方法
1.1 材料人胰腺癌细胞SW1990、PANC-1获赠于南京中国人民解放军总医院肿瘤中心实验室;西妥昔单抗购自美国施贵宝公司;Annexin-V-FITC试剂盒、细胞周期检测试剂盒、EGFR抗体、小鼠β-actin单克隆抗体购自Sigma公司;胰蛋白酶、RIPA、PMSF、aprotinin、leupeptin、Trizol购自美国Invitrogen公司; MTT、DMSO、小牛血清、PI、BCA蛋白检测试剂盒购自四季青生物有限公司;辣根过氧化物酶标记的山羊抗兔IgG、驴抗山羊IgG及山羊抗小鼠IgG、RNA酶、SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)低分子量标准蛋白质购自南京凯基生物公司;高糖DMEM培养基购自美国Gibco公司;β-catenin抗体购自美国Santa Cruz Biotechnology公司。
1.2 细胞复苏、培养、传代将冻存的原代人胰腺癌细胞SW1990、PANC-1置于37℃水浴中快速溶解,在超净台内将溶化的细胞液转移至离心管中,1 000 r/min离心5 min,弃上清液,加入DMEM培养液1 ml,吹散打匀,转至含有10%小牛血清DMEM培养液,37℃、5%CO2、饱和湿度条件下培养,24 h后观察细胞并更换培养液。人胰腺癌细胞SW1990、PANC-1为贴壁生长细胞,换液时间为2~3 d,传代时间为3~5 d。
1.3 细胞抑制率取处于对数生长期的细胞,采用胰蛋白酶消化,将DMEM培养基细胞悬液浓度调整为5× 105个/ml;采用96孔板,每孔加细胞悬液100 μl,每孔细胞数约为4 000个;5%CO2、37℃培养箱孵育细胞贴壁后,分别加入12.5、25.0、50.0、100.0 μg/ml浓度的西妥昔单抗,每个浓度组设5个复孔;继续孵育,分别于24、48、72 h时在显微镜下观察细胞形态;吸去培养液,每孔加100 μl含MTT的DMEM培养基,继续培养4 h;吸去含MTT的DMEM培养基,加入DMSO 150 μl/每孔,摇床低速振荡10 min,充分溶解结晶物;采用酶联免疫检测仪测量490 nm波长处各孔吸光度值。同时设置调零孔,即空白对照组。采用MTT法检测不同浓度、不同作用时间西妥昔单抗对胰腺癌细胞增殖SW1990、PANC-1的影响,计算细胞抑制率,细胞抑制率=(1-实验组平均吸光度值)/空白对照组平均吸光度值×100%。
1.4 细胞周期取处于对数生长期的细胞,采用胰蛋白酶消化,将DMEM培养基细胞悬液浓度调整为5× 105个/ml;采用6孔板,每孔加细胞悬液2 ml;培养箱孵育细胞贴壁后,加入DMEM培养基(空白对照组)、最佳抑制细胞浓度西妥昔单抗培养基孵育48 h;收集悬浮及贴壁细胞放置于离心管中,1 200 r/min离心5 min; PBS洗涤3次,将细胞浓度调整为1×105个/ml,采用70%乙醇固定,4℃保存24 h;1 200 r/min离心5 min后收集细胞,PBS洗涤3次;加入RnaseA 100 μl,37℃水浴30 min;加PI 400 μl染色混匀,4℃避光30 min;上机检测,采用流式细胞技术检测细胞周期,记录488 nm波长处红色荧光。
1.5 细胞EGFR、β-catenin蛋白表达取处于对数生长期的细胞,采用胰蛋白酶消化,将DMEM培养基细胞悬液浓度调整为5×105个/ml;孵育细胞贴壁后分别加入DMEM培养基(空白对照组)、最佳细胞抑制浓度西妥昔单抗DMEM培养基(实验组);5%CO2、37℃孵育48 h;分别加入胰蛋白酶1 ml进行消化,37℃、5%CO2孵育3 min后停止消化;将细胞液转移至10 ml离心管,1 200 r/min离心5 min,弃上清液,PBS洗涤3次;采用PBS 1 ml混匀,沉淀,移入1.5 ml EP管,3 000 r/min高速离心5 min,弃上清液,-70℃保存;采用RIPA细胞裂解液裂解细胞,设2个复孔,标准曲线5个孔,每孔加入200 μl工作液;配成BCA工作液(A∶B=50∶1);稀释待测蛋白;每孔加入25 μl蛋白;37℃温箱孵育2 h;标准蛋白曲线分别为1 mg/ml、750 μg/ml、500 μg/ml、250 μg/ml、125 μg/ml、50 μg/ml;变性蛋白,把蛋白样品和2×SDS加样缓冲液等体积配置混合,100℃、5 min,之后冰浴10 min,-20℃保存;SDS-PAGE(聚丙烯酰胺)凝胶电泳分离蛋白(分离胶含TEMED 2 μl、10%过硫酸铵0.05 ml、10% SDS 0.05 ml、Tris 1.3 ml、丙烯酰胺2 ml、消毒水1.6 ml,积层胶含TEMED 3 μl、10%过硫酸铵0.03 ml、10%SDS 0.03 ml、Tris 0.038 ml、丙烯酰胺0.5 ml、消毒水2.1 ml);蛋白质电转移、丽春红染色,加抗体,显色,以β-actin作为参照,采用Image J凝胶图像分析软件进行半定量分析,采用Westen blot法检测细胞EGFR、β-catenin蛋白表达。
2 结果
2.1 细胞抑制率12.5、25.0、50.0、100.0 μg/ml西妥昔单抗作用24 h时对人胰腺癌细胞SW1990的抑制率分别为70.9%、86.6%、114.9%、142.4%,作用48 h时对人胰腺癌细胞SW1990的抑制率分别为-22.8%、7.3%、54.2%、63.1%,作用72 h时对人胰腺癌细胞SW1990的抑制率分别为-14.2%、26.7%、60.8%、76.3%(见图1);作用24 h时对人胰腺癌细胞PANC-1的抑制率分别为53.9%、65.9%、99.4%、108.3%,作用48 h时对人胰腺癌细胞PANC-1的抑制率分别为-14.3%、26.7%、60.8%、76.3%,作用72 h时对人胰腺癌细胞PANC-1的抑制率分别为-20.0%、1.8%、40.0%、61.8%(见图2)。100 μg/ml西妥昔单抗作用24 h时对人胰腺癌细胞SW1990、PANC-1的抑制率最高,西妥昔单抗对人胰腺癌细胞SW1990、PANC-1的抑制作用呈时间和浓度依赖性。
2.2 细胞周期实验组人胰腺癌细胞SW1990、PANC-1 G0/G1期细胞比例较空白对照组增加,S期、G2/M期细胞比例较空白对照组减少(见图3~4)。
2.3 细胞EGFR、β-catenin蛋白表达实验组人胰腺癌细胞SW1990、PANC-1 EGFR、β-catenin蛋白表达均较空白对照组减少(见图5~6)。

图1 不同浓度不同作用时间西妥昔单抗对人胰腺癌细胞SW1990的抑制作用Figure 1 Inhibiting effect of cetuximab on human pancreatic cancer cell SW1990 at different densities and different time
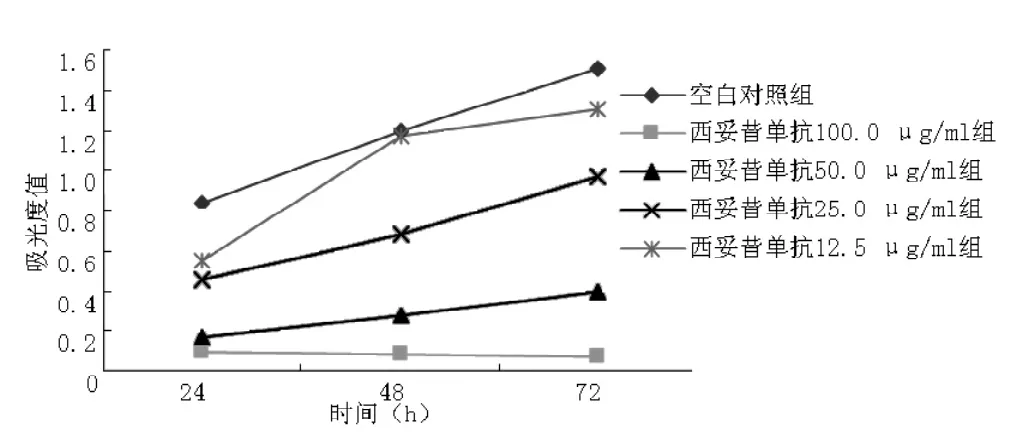
图2 不同浓度不同作用时间西妥昔单抗对人胰腺癌细胞PANC-1的抑制作用Figure 2 Inhibiting effect of cetuximab on human pancreatic cancer cell PANC-1 at different densities and different time

图3 100 μg/ml西妥昔单抗作用24 h时对人胰腺癌细胞SW1990细胞周期的影响Figure 3 Effect of cetuximab on cell cycle of human pancreatic cancer cell SW1990 at density of 100 μg/ml and 24 hour

图4 100 μg/ml西妥昔单抗作用24 h时对人胰腺癌细胞PANC-1细胞周期的影响Figure 4 Effect of cetuximab on cell cycle of human pancreatic cancer cell PANC-1 at density of 100 μg/ml and 24 hour
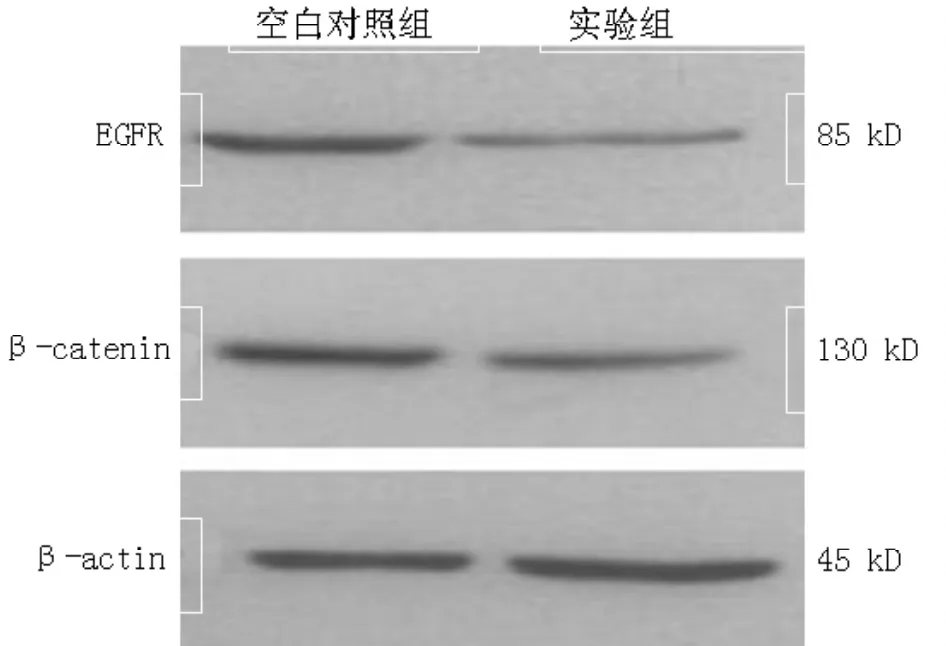
图5 100 μg/ml西妥昔单抗作用24 h时对人胰腺癌细胞SW1990 EGFR、β-catenin蛋白表达的影响Figure 5 Effect of cetuximab on EGFR,β-catenin protein expression of human pancreatic cancer cell SW1990 at density of 100 μg/ml and 24 hour

图6 100 μg/ml西妥昔单抗作用24 h时对人胰腺癌细胞PANC-1 EGFR、β-catenin蛋白表达的影响Figure 6 Effect of cetuximab on EGFR,β-catenin protein expression of human pancreatic cancer cell PANC-1 at density of 100 μg/ml and 24 hour
3 讨论
EGFR突变常见于多种恶性肿瘤,且存在EGFR突变的恶性肿瘤患者预后不佳[9],胰腺癌患者EGFR突变率为30%~95%。EGFR基因位于7号染色体短臂上,胰腺癌患者EGFR突变与7号染色体数量或结构变异有关[10]。2004年美国食品和药物管理局(FDA)批准美国ImClone Systems公司与施贵宝公司联合研发的一种EGFR特异性单克隆抗体——西妥昔单抗上市。西妥昔单抗由鼠抗EGFR抗体和人IgG1重链和轻链的恒定区组成,其一方面通过与表皮生长因子(EGF)、转化生长因子α(TGF-α)竞争性结合肿瘤细胞表面EGFR而阻断EGF、TGF-α等配体对EGFR的酪氨酸磷酸化作用,另一方面与EGFR发生特异性结合并介导EGFR自身降解,下调其表达,阻断EGFR的酪氨酸磷酸化作用及信号传导途径,可抑制肿瘤细胞增殖,促进肿瘤细胞凋亡。
临床前研究表明,西妥昔单抗能够有效抑制各种EGFR过表达肿瘤细胞的增殖,包括体外培养肿瘤细胞和移植模型中肿瘤细胞。研究表明,西妥昔单抗联合放疗较单一使用西妥昔单抗或放疗更能促进头颈部肿瘤细胞凋亡,更好地抑制肿瘤细胞增殖[11-12];西妥昔单抗对人肝癌细胞具有有效的体内外抑制作用[13],且西妥昔单抗对人肝癌细胞的增殖抑制作用呈剂量依赖性。本研究结果显示,100 μg/ml西妥昔单抗作用24 h时对人胰腺癌细胞SW1990、PANC-1的抑制率最高,西妥昔单抗对人胰腺癌细胞SW1990、PANC-1的抑制作用呈时间和浓度依赖性,为临床应用西妥昔单抗治疗胰腺癌提供了实验依据。
目前研究认为,EGFR突变与恶性肿瘤发展阶段有关,但其对患者生存期的影响仍存在争议[14-15]。几乎所有胰腺癌患者均存在1个KRAS致癌基因突变点[16-18],KRAS突变作为EGFR拮抗剂治疗的预测信号已在结肠直肠癌研究中证实,但其在胰腺癌中的预测价值尚未被研究证实。本研究结果显示,实验组人胰腺癌细胞SW1990、PANC-1 G0/G1期细胞比例较空白对照组增加,S期、G2/M期细胞比例较空白对照组减少,且人胰腺癌细胞SW1990、PANC-1的EGFR、βcatenin蛋白表达均较对照组减少,提示其作用机制可能是通过阻断Wnt/β-catenin/EGFR信号通路、抑制EGFR和β-catenin蛋白表达而抑制胰腺癌细胞增殖。
[1]Burris HA 3rd,Moore MJ,Andersen J,et al.Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer:a randomized trial[J].J Clin Oncol,1997,15(6):2403-2413.
[2]Huether A,Höpfner M,Baradari V,et al.EGFR blockade by cetuximab alone or as combination therapy for growth control of hepatocellular cancer[J]Biochem Pharmacol,2005,70(11): 1568-1578.
[3]Inoue K,Slaton JW,Perrotte P,et al.Paclitaxel enhances the effects of the anti-epidermal growth factor receptor monoclonal antibody ImClone C225 in mice with metastatic human blander transitional cell carcinoma[J].Clin Cancer Res,2000,6(12): 4874-4884.
[4]Ciardiello F,Bianco R,Damiano V,et al.Antitumor activity of sequential treatment with topotecan and anti-epidermal growth factor receptor monoclonal antibody C225[J].Clin Cancer Res,1999,5 (4):909-916.
[5]Fan Z,Baselga J,Masui H,et al.Antitumor effect of antiepidermalgrowthfactorreceptormonoclonalantibodiesplus cisdiamminedichloroplatinum on well established A431 cell xenografts[J].Cancer Res,1993,53(19):4637-4642.
[6]Saleh MN,Raisch KP,Stackhouse MA,et al.Combined modality therapy of A431 human epidermoid cancer using anti-EGFr antibody C225 and radiation[J].Cancer Biother Radiopharm,1999,14 (6):451-463.
[7]Raben D,Helfrich B,Chan DC,et al.The effects of cetuximab alone and in combination with radiation and/or chemotherapy in lung cancer[J].Clin Cancer Res,2005,11(2 Pt 1):795-805.
[8]Milojkovic D,Apperley J.Mechanisms of Resistance to Imatinib and Second-Generation Tyrosine Inhibitors in Chronic Myeloid Leukemia[J].Clin Cancer Res,2009,15(24):7519-7527.
[9]Rubin Grandis J,Melhem MF,Gooding WE,et al.Levels of TGF-alpha and EGFR protein in head and neck squamous cell carcinoma and patient survival[J].J Natl Cancer Inst,1998,90(11):824-832.
[10]Korc M,Meltzer P,Trent J.Enhanced expression of epidermal growth factor receptor correlates with alterations of chromosome 7 in human pancreatic cancer[J].Proc Natl Acad Sci USA,1986,83 (14):5141-5144.
[11]Bonner JA,Raisch KP,Trummell HQ,et al.Enhanced apoptosis with combination C225/radiation treatment serves as the impetus for clinical investigation in head and neck cancer[J].J Clin Oncol,2000,18(21 Suppl):47S-53S.
[12]王芳,王汉渝,胡伟汉,等.调强放疗联合西妥昔单抗及顺铂治疗晚期鼻咽癌[J].中国肿瘤生物治疗杂志,2008,15 (5):489-493.
[13]吕汪霞,马胜林.西妥昔单抗的临床研究新进展[J].医学综述,2010,16(9):1345-1348.
[14]Bloomston M,Bhardwaj A,Ellison EC,et al.Epidermal growth factor receptorexpressioninpancreaticcarcinomausingtissue microarray technique[J].Dig Surg,2006,23(1/2):74-79.
[15]Tobita K,Kijima H,Dowaki S,et al.Epidermal growth factor receptor expression in human pancreatic cancer:Significance for liver metastasis[J].Int J Mol Med,2003,11(3):305-309.
[16]Watanabe M,Nobuta A,Tanaka J,et al.An effect of K-ras gene mutation on epidermal growth factor receptor signal transduction in PANC-1 pancreatic carcinoma cells[J].Int J Cancer,1996,67 (2):264-268.
[17]Immervoll H,Hoem D,Kugarajh K,et al.Molecular analysis of theEGFR-RAS-RAFpathwayinpancreaticductal adenocarcinomas:lack of mutations in the BRAF and EGFR genes[J].Virchows Arch,2006,448(6):788-796.
[18]Lee J,Jang KT,Ki CS,et al.Impact of epidermal growth factor receptor(EGFR)kinase mutations,EGFR gene amplifications,and KRAS mutations on survival of pancreatic adenocarcinoma[J].Cancer,2007,109(8):1561-1569.
ObjectiveTo investigate the impact of cetuximab on human pancreatic cancer cells SW1990 and PANC-1.MethodsHuman pancreatic cancer cells SW1990 and PANC-1 were routinely cultivated,and then given different concentrations of cetuximab(12.5,25.0,50.0,100.0 μg/ml),and then observed the cell morphology after 24 hours,48 hours,72 hours,respectively,calculated the cell inhibition rate.After that,DMEM culture medium(control group)and the best cell inhibition concentration of cetuximab(experiment group)was given respectively,flow cytometry was used to detect the cell cycle,and Westen blot method was used to detect the protein expressions of EGFR and β-catenin.ResultsThe best cell concentration of cetuximab to inhibit the proliferation of human pancreatic cancer cells SW1990 and PANC-1 was 100 μg/ml,and the best acting time was 24 hours,it was time and concentration dependent.G0/G1phase cell proportion of experiment group was higher than that of control group,but S phase and G2/M phase cell proportion were lower.The protein expressions of EGFR and β-catenin of experiment group were lower than those of control group.ConclusionCetuximab has certain inhibiting effect on human pancreatic cancer cells SW1990 and PANC-1,and it is time and concentration dependent;its possible mechanism is interdict the Wnt/β-catenin/EGFR signal pathway.
Pancreatic neoplasms;Cetuximab;Receptor,epidermal growth factor;Molecular targeted therapy
R 735.9
A
10.3969/j.issn.1008-5971.2015.01.014
2014-08-10;
2014-12-20)
(本文编辑:鹿飞飞)
·用药指导·
050011河北省石家庄市,河北医科大学第四医院肿瘤内科(韩慧芳,史健);邯郸市第二医院肿瘤内科(韩慧芳)
韩慧芳,史健.西妥昔单抗对人胰腺癌细胞SW1990、PANC-1的影响研究[J].实用心脑肺血管病杂志,2015,23(1):45-48.[www.syxnf.net]
Han HF,Shi J.Impact of cetuximab on human pancreatic cancer cells SW1990 and PANC-1[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2015,23(1):45-48.
Impact of Cetuximab on Human Pancreatic Cancer Cells SW1990 and PANC-1HAN Hui-fang,SHI Jian.Department of Oncology,the Fourth Hospital of Hebei Medical Liniversity,Shijiazhuang 050011,China
【编者按】本期“用药指导”栏目围绕急诊重症监护室肺部真菌感染、住院患者常见革兰阳性球菌感染、慢性阻塞性肺疾病并发肺部感染情况及其耐药情况展开,结合各地方、各医院实际情况及具体数据,总结了其发病特点、高危因素、发展变化、病原菌分布等,这对促进临床合理用药、规范使用抗菌药物、减少细菌耐药等均具有一定指导意义,敬请关注!

