影响早期胃癌内镜治愈性切除的相关因素研究
肖江梅 孟祥杰
影响早期胃癌内镜治愈性切除的相关因素研究
肖江梅 孟祥杰
目的探讨影响早期胃癌(early gastric cancer,EGC)内镜治愈性切除的相关因素。方法回顾性分析行内镜下黏膜下剥离术的80例早期胃癌患者的临床资料,统计分析肿瘤部位、肿瘤大小、大体类型、分化程度、肿瘤浸润深度、脉管瘤栓和区域淋巴结转移情况。结果80例早期胃癌癌灶一次性完整切除率及组织学完整治愈率为98.75%,患者术后1、3年生存率分别为97.5%、92.5%。Logistic回归分析结果显示术后患者预后与肿瘤部位、大体类型无关(P>0.05),与分化程度、浸润深度及淋巴结转移有显著相关性(P<0.05)。结论低分化、组织类型、浸润深度深及伴有区域淋巴结转移的早期胃癌患者预后较差,临床上要高度关注这些因素来评估预后,伴有高危险因素的患者术后应接受综合治疗并严密随访。
早期胃癌;内镜黏膜下切除术;预后;组织学类型
(The Practical Journal of Cancer,2015,30:901~903)
内镜诊断及内镜下治疗技术的革新,提高了胃癌的早期诊断水平,并可以在内镜下进行早期胃癌(early gastric cancer,EGC)的微创根治治疗[1]。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)可以对肿瘤组织进行整块切除,目前已成为早期胃癌的有效治疗方法。但在临床上ESD术后还存在复发和转移现象,极大地影响了早期胃癌的治愈性切除率。为了探讨影响早期胃癌内镜治愈性切除的相关因素,现统计分析我院2009年1月至2011年8月期间行内镜切除的80例早期胃癌患者的临床资料,报告如下。
1 资料与方法
1.1 一般资料
2009年1月至2011年8月间经我院超声内镜及术后病理明确诊断早期胃癌并行内镜黏膜下剥离术治疗的患者80例,其中男性58例,女性22例,年龄43~75岁,平均年龄(52.7±4.8)岁,伴有糖尿病2例,慢性阻塞性肺病4例,高血压5例,患者的临床表现主要为胃部不适。
1.2 ESD治疗适应证及禁忌证
早期胃癌ESD的适应证[2]:①肿瘤直径≤2 cm,无溃疡的未分化型黏膜内癌;②无溃疡的分化型黏膜内癌;③肿瘤直径≤30 mm,伴溃疡的分化型黏膜内癌;④肿瘤直径≤30 mm,无溃疡的分化型SM1黏膜下癌。禁忌证包括患有严重心肺疾患、凝血功能障碍、血液病、恶液质患者及非抬举征阳性患者。
1.3 黏膜下剥离术手术方法
患者全身静脉麻醉成功后,喷洒0.2%靛胭脂于病灶表面以显示肿瘤的边界,在病灶边缘1 cm内用针刀或氩气刀进行电凝标记,标记间隔2 mm左右。将靛胭脂5 ml、肾上腺素1 ml和生理盐水混合液多点注射于病灶边缘标记点外侧的黏膜下,每点2 ml,黏膜下注射病灶被明显抬举后,以IT刀或Flex刀沿着标记外的侧行环形切开,术中为了保持病灶的充分抬举及视野清晰需要随时追加黏膜下注射,通过反复的黏膜下注射、分离,根据情况采用钩形电刀或IT刀将病灶从黏膜下层进行剥离,完整地切除病灶,肿块被完整切除后,需进行止血及保护创面等常规治疗,并将切除的肿瘤组织送病理检查。
1.4 观察指标
统计分析80例早期胃癌患者的肿瘤部位、肿瘤大小、大体类型、分化程度,肿瘤浸润深度、脉管瘤栓和区域淋巴结转移情况,随访患者1年及3年生存率,并进行Logistic回归分析这些因素与早期胃癌内镜治愈性切除预后的相关性。
1.5 统计学方法
采用SPSS 19.0进行数据处理分析,计数资料的比较采用χ2检验,计量资料用(¯x±s)表示,组间比较采用t检验;采用二元Logistic回归分析探讨影响早期胃癌内镜治愈性切除的相关因素,采用95%置信区间表示危险程度。P<0.05为差异具有统计学意义。
2 结果
2.1 手术结果
80例患者均顺利完成黏膜下剥离术,术中有3例胃窦部出现出血,术后于胃体胃窦部及胃底贲门部出现迟发性出血共6例,均予金属夹夹闭后成功止血,术后经禁食、抑酸及胃肠减压等治疗后出院。术后病理显示79例癌灶完整切除,有1例出现肿瘤累及基底部,一次性完整切除率及组织学完整治愈率为98.75%。
2.2 术后随访结果
患者术后1、3年生存率分别为97.5%和92.5%。患者3年生存率与肿瘤部位、大体分型、性别及年龄均无关(P>0.05),而与肿瘤大小、分化程度、组织类型、浸润深度及淋巴结转移有关(P<0.05)。见表1。Logistic回归分析结果显示术后患者预后与肿瘤大小、分化程度、组织类型、浸润深度及有无淋巴结转移有显著相关性(P<0.05),见表2。

表1 患者各临床病理特征对患者3年生存的影响比较
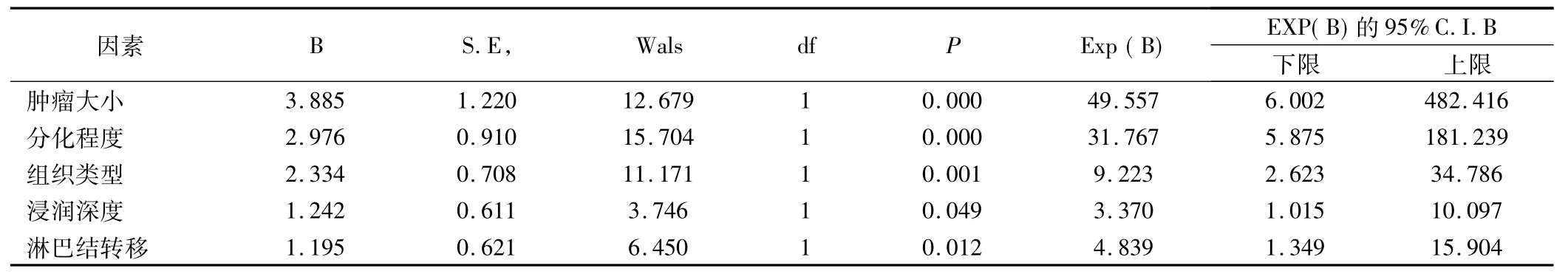
表2 早期胃癌内镜治愈性切除因素的Logistic回归分析结果
3 讨论
内镜下黏膜下剥离术是在内镜下进行微创治疗的新技术,较外科手术具有创伤小、手术时间短、肿瘤切除率高等优点,目前在临床广泛应用。本研究中患者早期胃癌的治愈性切除率为98.75%,略高于Choi等[3]报道的96.7%和Kosaka等[4]报道的97.7%,可能和病例的选择有一定的关系。本研究中患者术后1、3年生存率分别为97.2%和92.8%,和周平红报道的97.8%和93.4%相近[5]。内镜下黏膜下剥离术的主要并发症就是术中或术后出现出血,本组病例于术中出现有3例胃窦部出血,6例于术后在胃体、胃窦部及胃底贲门部发现迟发性出血,均予金属夹夹闭后成功止血,并经禁食、抑酸及胃肠减压等治疗后好转,无1例出现大出血甚至死亡的严重并发症,因此,内镜下黏膜下剥离术治疗早期胃癌是安全有效的。
早期胃癌虽然定义为癌细胞局限于胃壁黏膜或黏膜下层,不论病灶大小及是否存在局部淋巴结转移,早期胃癌的手术预后较好。有文献报道[6]早期胃癌根治术后的5年生存率可以达到为94.9%,但临床上发现肿瘤局限在黏膜内和浸润到黏膜下其预后却不相同,尤其是有淋巴结转移患者的预后明显差于无淋巴结转移。将本组80例早期胃癌数据进行Logistic回归分析,结果显示早期胃癌黏膜下剥离术后的预后与肿瘤大小、分化程度、组织类型、浸润深度及有无淋巴结转移有显著相关性。局限于黏膜内的肿瘤患者的3年生存率分别为98.3%,高于浸润至黏膜下的肿瘤患者的75%,且差异具有统计学意义(P<0.05),这可能是因为胃壁黏膜下层具有很多的毛细淋巴管,当肿瘤浸润至黏膜下层时,淋巴管受到了侵犯,导致淋巴结转移或远处转移的发生;本组患者中有无淋巴结转移患者的3年生存率为50%,明显低于无淋巴结转移患者的98.5%,差异具有统计学意义(P<0.05),均与国内外其他文献报道相仿[7]。另外,本研究还发现早期胃癌患者的预后还和肿瘤大小、组织类型及分化程度有关,大于4 cm的肿瘤患者的3年生存率明显低于小于4 cm的肿瘤患者,差异具有统计学意义(P<0.05),有文献报道随着瘤灶大小的增大,淋巴结转移率也会随之增加,直径在1.1~2.0 cm及>2.0 cm时的淋巴结转移率分别为5.6%~7.0%及10.9%~19.4%[8]。本组研究中,腺癌3年生存率明显高于印戒细胞癌,高分化肿瘤患者的3年生存率与中低分化肿瘤患者相比具有显著性差异,与李宇等[9]的肿瘤组织学类型和分化程度是早期胃癌术后患者预后的独立影响因素的结论相符合。
本研究的局限性在于病例数偏少,在肿瘤大小、分化程度、组织类型、浸润深度及有无淋巴结转移的分组中,各组的病例数有差别,这可能会在统计上出现一些误差,在后续的研究中,随着病例的增多,统计结果会逐渐完善。综上所述,内镜下黏膜下剥离术治疗早期胃癌是安全有效的,早期胃癌行黏膜下剥离术后的预后与肿瘤大小、分化程度、组织类型、浸润深度及有无淋巴结转移有显著相关性,在临床实践中,要考虑多种因素,对早期胃癌患者的病情进行综合评估,制定准确的治疗方案。
[1]夏阳.电子染色内镜对早期胃癌及癌前病变边界的评估价值〔J〕.实用癌症杂志,2014,29(3):290-291.
[2]Hoteya S,Yahagi N,Lizuka T,et al.Endoscopic resection for early gastric cancers by EMR/ESD〔J〕.Gan To Kagaku Ryoho,2007,34(1):16-20.
[3]Choi MK,Kim GH,Park do Y.Long-term outcomes of endoscopic submucosal dissection for early gastric cancer:a single center experience〔J〕.Surg Endosc,2013,27(11):4250-4258.
[4]Kosaka T,Endo M,Toya Y.Long-term outcomes of endoscopic submucosal dissection for early gastric cancer:a singlecenter retrospective study〔J〕.Dig Endosc,2014,26(2): 183-191.
[5]周平红,彭贵勇,杨仕明,等.内镜黏膜下剥离术治疗早期胃癌及癌前病变的临床疗效分析〔J〕.第三军医大学学报,2014,36(14):1507-1511.
[6]Saragoni L,Morgagni P,Gardini A,et al.Early gastric cancer:diagnosis,staging,and clinical impact.Evaluation of 530 patients.New elements for an updated definition and classification〔J〕.Gastric Cancer,2013,16(4):549-554.
[7]Ji YA,Hwoon YJ,Kee DC,et al.Endoscopic and oncologic outcomes after endoscopic resection for early gastric cancer: 1370 cases of absolute and extended indications〔J〕.Gastrointest Endosc,2011,74(3):485-493.
[8]Lee SE,Lee JH,Ryu KW,et al.Sentinel node mapp ing and skip metastases in patients with early gastric cancer〔J〕.Ann Surg Oncol,2009,16(3):603-608.
[9]李宇,王浩,王东升,等.109例早期胃癌的预后分析〔J〕.中国肿瘤外科杂志,2014,6(1):9-11,24.
Analysis of the Relative Risk Factors of Endoscopic Submucosal Dissection for Early Gastric Cancer
XIAO Jiangmei,MENG Xiangjie.Mining Bureau Central Hospital of Tongchuan,Tongchuan,727000
ObjectiveTo study the relative risk factors of endoscopic submucosal dissection(ESD)for early gastric cancer.MethodsThe clinic data of 50 cases of early gastric cancer treated by ESD were analyzed retrospectively.Tumor site,tumor size,macroscopic type,histological grade,tumor infiltration,lymph node metastases and vascular invasion were analyzed.ResultsThe complete resection rate and the histologically complete resection rate was 98.75%,1-,3-year survival rates were 97.5%and 92.5%.Logistic analysis indicated that histological type,tumor infiltration,lymph node metastases and vascular invasion were significant prognostic factors regarding overall survival(P<0.05),but tumor site and macroscopic type were not significant prognostic factors(P>0.05).ConclusionEarly gastric cancer patients with lower histological grade,deeper infiltration and lymph node metastases have poor prognosis,they should receive comprehensive therapy after ESD and strict follow-up.
Early gastric cancer;Endoscopic submucosal dissection(ESD);Prognosis;Histological type
10.3969/j.issn.1001-5930.2015.06.035
R735.2
:A
:1001-5930(2015)06-0901-03
2014-12-10
2015-03-25)
(编辑:甘艳)
727000陕西省铜川矿务局中心医院

