实验大鼠颅眶联合损伤后依达拉奉对其视神经的保护作用
高 晨,荔志云,贾 平,张景科兰州军区兰州总医院安宁分院脑外科,兰州 70070;兰州军区兰州总医院神经外科,兰州7000;兰州大学医学实验动物中心,兰州 70000
实验大鼠颅眶联合损伤后依达拉奉对其视神经的保护作用
高 晨1,荔志云2,贾 平1,张景科3
1兰州军区兰州总医院安宁分院脑外科,兰州 730070;2兰州军区兰州总医院神经外科,兰州730030;3兰州大学医学实验动物中心,兰州 730000
目的:探讨实验性大鼠颅眶联合损伤(cranio-orbital injury,COI)后视神经损伤机制及依达拉奉的保护作用。方法:144只清洁级SD大鼠,雌雄各半,随机分为对照组、损伤组和治疗组,每组48只。损伤组和治疗组大鼠利用液压冲击颅脑损伤仪建立颅眶联合伤模型,治疗组造模以后腹腔注射依达拉奉30 mg·kg-1,每日2次,共14日。3组分别在造模后3、6、10、14 d取视网膜组织,检测视网膜神经节细胞(retinal ganglion cells,RGCs)活性氧(reactive oxygen species,ROS)含量及不同时间点RGCs凋亡率,光镜下观察视网膜HE染色微观结构,共聚焦显微镜下观察RGCs的TUNEL荧光标记凋亡情况。结果:造模后损伤组RGCs的ROS含量逐渐升高,第10天达到高峰,RGCs凋亡率变化趋势与此相一致,与对照组及治疗组差异有统计学意义(P<0.05),治疗组与对照组相比较无明显差异。光镜下损伤组视网膜结构紊乱,损伤组RGCs的TUNEL荧光标记阳性率明显高于其余两组。结论:COI后RGCs的ROS含量明显升高,导致细胞出现凋亡失调。依达拉奉通过清除ROS逆转这一病理过程,具有明确的视神经保护作用,值得临床推广。
依达拉奉;颅眶联合损伤;视神经;活性氧;凋亡
颅眶联合损伤(cranio-orbital injury,COI)发生率占颅脑损伤的0.3%~5.2%[1],其颅脑损伤合并视神经损伤的临床特点决定了救治的关键在于伤后视神经功能的保护[2-3]。伤后视功能损害的病理机制之一是活性氧簇 (reactive oxygen species,ROS)爆发引起的视网膜神经节细胞(retinal ganglion cells,RGCs)的凋亡失调[2,4]。因此,抑制ROS成为治疗视神经损伤的有效途径。新型自由基清除剂依达拉奉已广泛应用于临床氧化应激性损伤的救治。本研究将依达拉奉应用于COI动物模型的治疗中,通过RGCs内ROS含量测定,RGCs凋亡率检测以及视网膜微观、RGCs超微结构的观察,探讨依达拉奉对颅眶联合损伤后RGCs的保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 健康成年清洁级Sprague-Dawley大鼠144只,购自兰州大学医学实验动物中心[SCXK(甘)-0016];室温饲养,相对湿度55%~75%,维持12 h光照,自由摄食饮水。
纳入标准:体重230~250 g,雌雄兼用;健康无眼疾;双眼瞳孔直接对光反射和间接对光反射正常。
随机分为3组:对照组、损伤组和治疗组,每组48只。分别于造模后3、6、10、14 d取材。动物实验经过医院伦理委员会书面同意,具备动物实验资格。1.1.2 主要试剂及仪器 DCFH-DA试剂盒购自江苏碧云天生物技术研究所;AnnexinV异硫氰酸荧光素 (fluorescein isothiocyanate,FITC)试剂盒购自Pharmingen公司;TUNEL(TdT-mediated dUTP nick end labeling)检测试剂盒购自美国Promega公司;依达拉奉注射液 (Edaravone,MCI-186)购自南京先声东元制药有限公司(批号:80-051007)。
实验设备均由兰州大学医学实验中心提供:液压冲击颅脑损伤仪 (fluid percussion brain injury device,FPI)(天津市神经病学研究所);荧光显微镜(日本Olympus-AX80);流式细胞仪 (美国Beck-man-Coulter Epics XL-4型);激光共聚焦显微镜(德国Leica TCS SP2);透射电镜(日本电子公司JEM-1230)。
1.2 方法
1.2.1 建立大鼠COI模型[5]利用FPI建立损伤组和治疗组大鼠COI模型。平均打击力量为(6.9±0.6)atm(1 atm=101.322 kPa)。术后2 d伤眼出现Mar-cus-gun瞳孔,眼球无明显突出,眼睑闭合完全且直接检眼镜观察眼底无明显出血者为成功模型。造模后大鼠均存活2周以上。对照组大鼠始终正常饲养。1.2.2 依达拉奉干预治疗 根据药品说明书,利用灭菌生理盐水将依达拉奉配制成0.9 g·L-1溶液,治疗组大鼠在造模后立即以30 mg·kg-1剂量腹腔注射依达拉奉[6],12h后重复给药。此后依照此剂量持续腹腔给药,每日2次,连续14日。给药后大鼠正常饲养。1.2.3 ROS检测[7]采用双乙酸双氯双氢荧光素(CM-H2DCF-DA)法检测RGCs内ROS含量。各组取3只大鼠,制作患侧眼球RGCs单细胞悬液,每个样品收集1.0×103个细胞。检测2′,7′-二氯荧光素(DCF)荧光强度,间接测定细胞内活性氧水平。
1.2.4 细胞凋亡检测[8]采用AnnexinV/PI双染色法,通过流式细胞仪定量检测RGCs的凋亡率。各组取3只大鼠,制作患侧眼球RGCs单细胞悬液,调整待测细胞浓度为1×109/L,上机检测。
采取末端脱氧核苷酸转移酶(TdT)介导生物素标记的脱氧尿嘧啶核苷三磷酸缺口末端(terminal deoxynucleotidyl transferase mediated dUTP biotin nick end labelling,TUNEL)标记原位荧光法观察视网膜切片RGCs凋亡情况。各组取3只大鼠患侧眼球,10%中性甲醛固定24 h,弃去眼前节,取后极部视网膜,常规脱水,浸蜡,包埋,连续切片,片厚2.5 μm,常规脱蜡。用蛋白酶K孵育后滴加TUNEL反应混合液。孵育后在激光共聚焦显微镜下观察视网膜结构,凋亡RGCs细胞核呈强绿色荧光。
1.2.5 视网膜切片HE染色及观察[5]各组取3只大鼠患侧眼球,制作患侧眼球石蜡切片,苏木素-伊红染色,封片。光镜下观察视网膜微观结构。
1.3 统计学方法
本研究数据资料采用SPSS13.0统计软件包进行分析。计量资料采用均数±标准差(±s)表示。样本均数间的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组RGCs细胞内ROS检测(见表1)
不同时间点损伤组大鼠RGCs的ROS含量均高于对照组及治疗组大鼠,差异在伤后6 d后均具有统计学意义(P<0.05),第10天达到高峰108.3±15.6;治疗组大鼠RGCs的ROS含量在损伤后呈现逐渐下降的趋势,损伤后3 d时较对照组仍有轻度升高,但各时间点与对照组相比均无统计学差异(P>0.05)。
2.2 各组RGCs细胞凋亡检测(见表1、图1)
损伤组大鼠 RGCs凋亡率在损伤后 3 d为(30.51±2.09)%,2周内均维持于30%~40%的高水平状态,各时间点均高于对照组及治疗组大鼠,差异均具有统计学意义 (P<0.05)。治疗组大鼠RGCs凋亡率2周内呈现逐渐下降趋势,损伤后14 d为(8.67±2.98)%,达到正常水平。各时间点治疗组与对照组均无显著差别。
表1 各组大鼠不同时间点RGCs的ROS含量及凋亡率(±s)

表1 各组大鼠不同时间点RGCs的ROS含量及凋亡率(±s)
观察项目损伤组治疗组对照组F值P值ROS含量(F480/F420)(%)伤后3 d 51.8±8.9 49.2±6.2 40.2±6.5 2.086 0.205伤后6 d 99.9±11.7 44.7±2.4*45.5±9.6*38.374 0.000伤后10 d 108.3±15.6 41.8±7.6*42.6±8.8*34.629 0.001伤后14 d 62.5±2.2 40.1±5.2*41.9±5.2*23.660 0.001 RGCs凋亡率(%)伤后3 d 30.51±2.09 13.19±3.11*7.50±0.33*91.296 0.000伤后6 d 35.55±1.36 10.65±2.44*8.34±0.64*248.318 0.000伤后10 d 38.22±4.01 9.26±6.42*9.51±1.22*106.446 0.000伤后14 d 32.32±1.35 8.67±2.98*8.42±0.83*148.890 0.000注:与损伤组比较*P<0.05,n=3
激光共聚焦显微镜下观察视网膜TUNEL荧光染色提示:在伤后各时间点,损伤组视网膜神经节细胞层(retinal ganglion layer,GCL)内强绿色荧光着染的异常凋亡RGCs均明显多于对照组及治疗组,损伤后10 d最为明显。损伤后治疗组GCL层内凋亡细胞呈逐渐减少趋势,与对照组无明显差别。对照组仅显示少量正常凋亡RGCs。
2.3 视网膜微观结构(见图2)
光镜下观察视网膜HE染色微观结构提示:对照组大鼠视网膜HE染色显示正常结构。自外向内由3层细胞组成,分别为RGCs细胞层、双极细胞层和感光细胞层。其中RGCs呈单层排列,卵圆形。按照细胞核大小分为两类:一类大核浅染,核内有时可见核仁;另一类为小核深染,核内染色质分布均匀。细胞边界清晰,呈条带状。双极细胞层和感光细胞层呈多层排列,前者厚度约为后者2倍。在损伤后各时间点,损伤组大鼠视网膜整体结构均遭受破坏,损伤后10 d破坏程度最为明显,表现为整体视网膜水肿增厚,RGCs数量明显减少,且呈空泡变性,细胞核固缩,染色质分布不均匀,边聚;细胞排列稀松紊乱,失去正常结构。治疗组大鼠视网膜破坏程度较损伤组明显减轻,RGCs数量略微减少,至损伤后14 d时已基本呈现为正常视网膜结构。

图1 实验10天各组大鼠视网膜TUNEL荧光染色情况
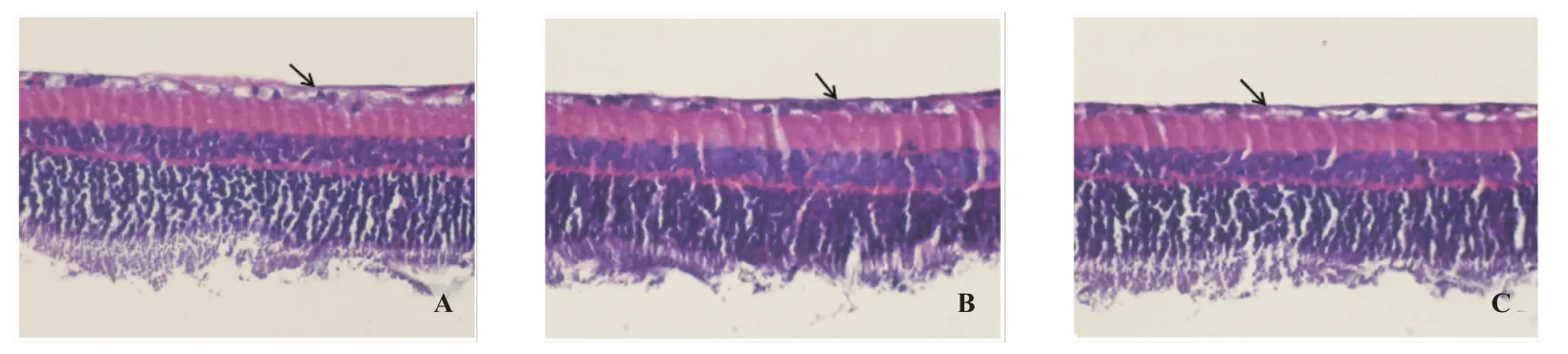
图2 实验第10天各组大鼠视网膜微观结构
3 讨 论
3.1 COI后视神经损伤特点及RGCs凋亡机制
颅眶联合损伤后外力对视神经的冲击或挤压是造成视神经损伤的主要原因。Gross等[9]研究表明,施加到额骨的外力经传导最终集中在视神经管的区域,加之视神经管的特殊解剖结构构成了颅脑损伤,是易致视神经损伤的病理基础[1]。视神经损伤后,发生血管营养障碍,造成局部组织缺血、缺氧、水肿,反过来又加重局部缺血和轴索损伤,能否逆转这一恶性循环决定着伤眼的视力预后[10]。
与视神经损伤有关的诸多眼科疾病的共同病理特征是RGCs的凋亡失调,最终导致视力障碍[11]。总结已有研究表明,RGCs发生凋亡失调的机制包括:①视神经损伤后富含不饱和脂肪酸的RGCs轴索及细胞膜受到异常增多的ROS的攻击而发生脂质过氧化反应,同时自由基可介导Ca2+超载及蛋白质损伤等途径,诱导细胞凋亡;②由于神经损伤后轴浆运输障碍,导致由上丘或外侧膝状体运输至视网膜RGCs的神经营养因子等物质缺乏或减少;③损伤后细胞外液谷氨酸、天门冬氨酸等兴奋性氨基酸毒性作用促进细胞外Ca2+内流,Ca2+的增加作为第二信使,激活其他诱发凋亡的物质,导致细胞凋亡[12-15];④一氧化氮(nitric oxide,NO)作为神经毒素因子,参与神经系统的多种病理损伤过程,可介导神经元及胶质细胞的凋亡;⑤半胱氨酸蛋白酶(Caspase)是RGCs继发性死亡的主要介质,Caspase抑制剂可以通过直接抑制凋亡和减少来自免疫系统的继发性损害而减轻缺血对神经元的损害[16]。
3.2 RGCs的ROS含量测定以及凋亡检测
RGCs凋亡失调的重要原因之一是ROS的损伤作用。外伤应激状态下,ROS含量异常增多,通过活化死亡受体通路、线粒体凋亡通路、c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)介导的凋亡信号通路以及破坏细胞内谷胱甘肽相关的氧化还原平衡等多种机制,引起细胞凋亡失调[7]。本研究采用CM-H2DCF-DA荧光法测定RGCs的ROS含量,可以间接反映损伤后视神经氧化性损伤的严重程度。检测结果显示:损伤组ROS水平始终高于治疗组及对照组,伤后6 d即有统计学差异,10 d达到高峰(P<0.05)。治疗组ROS含量呈逐渐下降趋势,与对照组无明显统计学差异。实验结果表明,依达拉奉通过清除组织内异常增多的ROS,有效抑制脂质过氧化反应,起到视神经保护作用。
本研究采用AnnexinV/PI双染色法,通过流式细胞仪定量检测了RGCs的凋亡情况,这是目前量化检测凋亡细胞的可靠方法。同时通过荧光双标的细胞滴片,在共聚焦显微镜下进行正常细胞、凋亡细胞及坏死细胞的形态学观察。检测结果提示:损伤组RGCs凋亡率在伤后3 d以后即维持于30%~40%的高点,与治疗组及对照组均有统计学差异(P<0.05)。依达拉奉干预治疗后3 d,RGCs凋亡率仍高于对照组近1倍,10 d后逐渐接近正常水平。细胞形态学观察也印证了流式细胞检测结果。另外,本研究进行了RGCs的电镜超微结构对比观察,镜下损伤组大量RGCs表现出细胞核固缩,染色质边集以及核膜内陷的凋亡特征,这是判断细胞凋亡最经典、最可靠的佐证[17-18]。
凋亡检测结果与RGCs的ROS含量变化互相印证,表明颅眶联合损伤后由ROS爆发引起RGCs凋亡失调,进而导致视功能障碍。依达拉奉应用3 d后开始表现出视神经保护作用,10 d后保护最为明显。
3.3 依达拉奉对COI后视神经的保护作用机制
近年来不少学者在神经细胞膜代谢研究中发现自由基的毒害作用,由此特别强调神经损伤中生物化学影响的重要性。因此,及早应用自由基清除剂对保护神经功能、改善预后业已成为神经损伤临床救治的新思路。依达拉奉是一种新型的自由基清除剂,在体内正常解离常数下游离出一个质子,成为依达拉奉阴离子。现有研究表明,依达拉奉神经保护机制如下:①体内解离出的依达拉奉阴离子迅速与氧自由基的不配对电子配对,使自由基失去作用,从而阻断自由基的连锁反应[21]。②依达拉奉可有效清除具有毒性作用的羟基基团,通过抑制黄嘌呤氧化酶和次黄嘌呤氧化酶的活性,刺激前列环素的生成,减少炎症介质白三烯产生,降低羟自由基的浓度[19-23]。③机体总抗氧化能力(TAOC)可作为多种神经系统疾病的预后指标[24-25]。依达拉奉激活机体的防御体系,增强TAOC,提高对抗缺血缺氧性改变的能力,减轻缺血再灌注损伤而起到保护作用。④依达拉奉可提高超氧化物歧化酶活性,减少丙二醛产生,抑制脂质过氧化,从而减轻神经细胞的氧化损伤[26]。⑤依达拉奉通过调控凋亡相关基因表达对实验性视网膜脱离视神经细胞凋亡有明显的抑制作用[27]。
本研究通过对颅眶联合损伤大鼠的依达拉奉干预治疗发现,依达拉奉可以有效清除RGCs内异常增多的ROS,减轻细胞损伤,逆转凋亡失调,有效保护视神经功能。视神经损伤后RGCs凋亡是多因素作用的结果,依达拉奉作为高效的自由基清除剂,其视神经损伤早期保护作用的循证医学依据有待于进一步深入研究,临床应用前景值得期待。
[1] 曹文捷,施彩虹.视神经损伤细胞凋亡与神经保护的实验研究进展[J].医学综述,2006,12(5):276-8.
[2] Steinsapir KD,Goldberg RA.Traumatic optic neuropa-thy:evolving understanding[J].Am J Ophthalmol,2011, 151(6):928-93.
[3] 张 颖,张卯年.间接视神经损伤的治疗和视力预后分析[J].中华眼科杂志,2007,43(3):217-21.
[4] Levkovitch-verbin H,Harris-cerruti C,Groner Y,et al. RGC death in mice after optic nerve crush injury:ox-idative stress and neuroprotection[J].Invest Ophthalmol Vis Sci,2000,41(13):4169-74.
[5] 高 晨,周海燕,荔志云,等.三种大鼠颅眶联合损伤模型的比较观察 [J].中国微侵袭神经外科杂志,2012,32(6):1-6.
[6] 周海燕,高 晨,周丽雅,等.依达拉奉对大鼠视神经钳夹伤后视网膜细胞的保护作用[J].眼科新进展,2012,32(12):1113-6.
[7] 高 晨,周海燕,荔志云,等.颅眶联合伤后视网膜神经节细胞活性氧含量与凋亡研究[J].中国微侵袭神经外科杂志,2013,18(10):468-71.
[8] 周海燕,高 晨,张景科,等.新型自由基清除剂对鼠视神经挫伤后视网膜细胞的保护作用[J].西安交通大学学报(医学版),2014,35(1):40-4.
[9] Gross CE,Dekock JR,Painje WR,et al.Evidence for orbital deformation that may contribute to monocular blindness following minor frontal head trauma[J].J Neurosurg,1981,55(6):963-6.
[10] 胡运韬,彭秀军,卢成戎,等.外伤性视神经病变临床救治的初步观察[J].中华神经医学,2003,2(2):92-4.
[11] 方 庆,陆卫华,赵智刚,等.人参皂苷Rg1对大鼠视网膜神经节细胞的保护作用 [J].实用医学杂志,2011,27(29):1548-50.
[12] Yoles E,Sehwarz M.Potential neuroprotective therapy for glaucomatous optic neuropathy[J].Surv Ophthalmol, 1998,42(4):367-72.
[13] Yoles E,Sehwarz M.Elevation of intraocular gluta-mate levels in rats with partial lesion of the optic nerve[J].Arch Ophthalmol,1998,116(7):906-10.
[14] Yoles E,Wheeler LA,Schwartz M.Alpha2-adrenore-ceptor agonists are neuroprotective in a rat model of optic nerve degeneration[J].Invest Ophthalmol Vis Sci, 1999,40(1):65-73.
[15] Naskar R,Quinto K,Romann I,et al.Phenytoin blocks retinal ganglion cell death after partial optic nerve crush[J].Exp Eye Res,2002,74(6):747-52.
[16] Weishaupt JH,Diem R,Kermer P,et al.Contribution of caspase-8 to apoptosis of axotomized rat retinal ganglion cells in vivo[J].Neurobiol Dis,2003,13(2): 124-35.
[17] Kerr JF,Wyllie AH,Currie AR.Aoptosis:A basicbiological phenomenon with wide-ranging implication in tissue kinetics[J].Br J Cancer,1972,26(4):239-57.
[18] Qtsuki Y.Aoptosis in human endometrium:apoptotic detection method and singaling[J].Med Electron Mi-crosc,2001,34(3):166-73.
[19] Tanaka M.Pharmacological and clinical profile of the free radical scavenger edaravone as a neuroprotevtive agent[J].Nippon Yakarigaku Zasshi,2002,119(5): 301-8.
[20] Tomoaki K,Xia YX,Masatoki K,et al.Effect of the free radical scavenger 3-methy 1-pheny-2-pyrazolin-5-one(MCI-186)on hypoxia-inchemia-induced brain injury inneonatal rats[J].Neurosci Lett,2002,329(1): 33-6.
[21] Kozue S,Yukio I,Seiji S,et al.Edaravone scavenger-snitric oxide[J].Redox Report,2002,7(4):219-22.
[22] Shichinohe H,Kuroda S,Yasuda H,et al.Neuropro-tective effects of the free radical scavenger Edaravone (MCI-186)in mice permanent focal brain ischemia[J]. Brain Res,2004,1029(2):200-6.
[23] Takabatake Y,Uno E,Wakamatsu K,et al.The clinical effect of combination therapy with edaravone and sodiumozagrel for acute cerebral infarction[J].No To Shinekei,2003,55(7):589-93.
[24] Lesgards JF,Durand P,Lassarre M,et al.Assessment of lifestyle effects on the overall antioxidant capacity of healthy subjects[J].Environ Health Perspect,2002, 110(5):479-86.
[25] Sofic E,Rustembegovic A,Kroger G,et al.Serum antioxidant capacity in neurological,psychiatric,renal diseasesand cardiomyopathy [J].JNeuralTransm, 2002,109(5-6):711-9.
[26] 蒋 杰,陈亦江,陈 亮,等.依达拉奉对心脏瓣膜置换术患者脑损伤的影响[J].南京医科大学学报(自然科学版),2006,26(7):570-3.
[27]Roh MI,Murakami Y,Thanos A,et al.Edaravone,an ROS scavenger,ameliorates photoreceptor cell death after experimental retinal detachment[J].Invest Oph-thalmol Vis Sci,2011,52(6):3825-31.
Protective Effects of Edaravone on the Optic Nerve after Experimental Cranio-orbital Injury in Rats
GAO Chen1,LI Zhi-yun2,JIA Pin1,ZHANG Jing-ke3
1Department of Neurosurgery,AnNing Branch Hospital,Lanzhou General Hospital of Lanzhou Military Com-mand,Lanzhou 730070,China;2Department of Neurosurgery,Lanzhou General Hospital of Lanzhou Military Command,Lanzhou 730030,China;3Laboratory Animal Center of Lanzhou University,Lanzhou 730000,China
Objective:To investigate the mechanism of optic nerve injury and protective effects of edar-avone on rats with experimental cranio-orbital injury (COI).Methods:A total of 144 rats (clean grade) were randomly divided into control group,injury group and treatment group,with 48 rats in each group. The animal model of COI was established in the left eyes of rats of injury and treatment groups by a fluid percussion brain injury (FPI)device.Edaravone (30 mg·kg-1)diluted with normal saline was injected in-traperitoneally to the rats of treatment group after modeling every 12 hours for 14 days.Rat retina was ob-tained at 3,6,10 and 14 day,respectively,after injury,to check the content of reactive oxygen species (ROS)in retinal ganglion cells (RGCs)and the apoptosis rate of RGCs.The HE stained microstructure of RGCs was observed under an optical microscope.The TUNEL fluorescence labeled apoptosis of RGCs was observed under a laser confocal microscope.Results:The content of ROS as well as the apoptosis rate of RGCs increased gradually and reached maximum in 10 days after modeling in the injury group.There were statistically significant differences between the injury group and the other two groups (P<0.05).The retina structure of the injury group was disorganized after injury.The positive rate of TUNEL fluorescence labeled RGCs in the injury group was significantly higher than the other two groups.Conclusion:The content of ROS in RGCs increased significantly after COI,resulted in apoptosis imbalance of RGCs.Edaravone pre-vents this pathological process by eliminating ROS and thus has a protective effect on optic nerve,which is worthy of clinical promotion.
Edaravone;Cranio-orbital injury;Retinal ganglion cells;Reactive oxygen species;Apoptosis
R965.1
A
1673-7806(2015)02-107-05
高晨,男,主治医师,外科学博士。主要研究方向:颅脑损伤规范化诊疗 E-mail:gc2006418@163.com
2014-09-19
2014-11-27

