FasL及Fas LASODN在舌鳞癌细胞免疫逃逸中的作用*
何志良,陈乔尔,王承阳,曹 雷,贺成功
(1.河北省承德市中心医院承德医学院第二附属医院067000;2.安徽医科大学附属口腔医院口腔颌面外科,合肥230032)
舌癌是口腔癌中第一大癌。目前仍不能准确的早期诊断和早期有效治疗。对它的发病机制有学者提出了免疫监视学说,认为免疫系统起了监视机体,识别和杀伤肿瘤细胞作用,而肿瘤细胞能逃避机体的免疫监视系统而无限制地生长下去。本实验通过检测Fas 配体(Fas L)反义寡核苷酸(ASODN)转染舌鳞癌细胞前后,Fas L 蛋白表达及m RNA水平的变化。从基因-蛋白-细胞效应3 个水平进行观察,旨在进一步证实和探索舌鳞癌细胞通过Fas/FasL 途径的免疫抑制机制及探讨反义寡核苷酸能否通过有效封闭细胞表面Fas L表达,使舌鳞癌细胞诱导T细胞凋亡的能力减弱,为寻找免疫治疗的新的靶点提供理论依据。
1 材料与方法
1.1 实验仪器及材料Jurkat 细胞株为中国典型培养物保藏中心产品;SCC-9 细胞株来自美国ATCC产品,RPMI-1640 培养液、DMEM/F12 培养液为美国HyClone 公司产品,PE标记的小鼠抗人Fas 抗体,PE标记的小鼠抗人Fa s L抗体为美国eBioscience 公司产品,小鼠抗人Fas L 中和性抗体NOK-2 为美国BD公司产品,流式细胞仪为美国Beckman Coulter 公司产品,荧光定量PCR仪为美国Applied Biosystems 公司产品,紫外分光光度仪为尤尼柯仪器有限公司产品,荧光倒置显微镜为日本Olympus 公司产品。
1.2 方法
1.2.1 寡核苷酸链的序列合成 参考文献[1]完成,合成FasL ASODN 5′-CTC TCG GAG TTC TGC CAG CT-3′;正义寡脱 氧 核 苷 酸(SODN)5′-AGC TGG CAG AAC TCC GAG AG-3′;对每条序列两端的各3个碱基进行硫代磷酸化修饰,对5′端进行FAM绿色荧光标记。
1.2.2 细胞培养SCC-9细胞应用含10%胎牛血清的DMEM/F12 培养液,在37 ℃、5%CO2的条件下进行培养[2],含有0.02%乙二胺四乙酸的0.25%胰蛋白酶消化传代;人急性T细胞白血病细胞系Jurkat 细胞用含10%胎牛血清的RPMI-1640 培养液,在37 ℃、5% CO2的条件下培养,1~2d 换液1 次,相差显微镜下观察细胞聚集成团时将细胞悬液按1∶4 传代培养。待细胞生长至对数生长期开始实验。
1.2.3 Jurkat 细胞Fas 蛋白表达量检测 采用FCM检 测Jurkat 细胞Fas 蛋白表达量,取对数生长期的Jurkat 细胞,阴性对照(同型对照)和实验组;每组3 个复孔,1000r/min 离心5 min 收集细胞,倒掉培养基,PBS 洗1 次,调整细胞浓度为1 ×106个/mL。分别加入同型抗体、Fas-PE 抗体,4 ℃下避光反应达30 min;PBS 清洗1 次,再加入PBS 500μL 作流式细胞仪检测[3]。以FSC/SSC 设门,获取门内细胞104个,以对数放大荧光强度,并将光散射数据存盘,使用Win MDI 软件进行分析。每个指标重复检测3 次。
1.2.4 舌鳞癌细胞FasL 功能检测 调SCC-9 细胞为1 ×106个/m L,每孔取1 m L接种至6 孔培养板,当孔底有80%以上被单层细胞覆盖时,则将培养液去除,并冲洗板孔,分组检测。实验1 组(A组):SCC-9 细胞每孔加1 ×106 个/mL Jurkat 细胞400μL;实验2 组(B 组):SCC-9 细胞每孔加400μL FasL 中和抗体NOK-2,浓度为10μg/mL,孵育1 h 后加400μL Jurkat细胞[2];对照1 组(C组):单 独培养Jur kat 细胞;对照2组(D组):Jurkat 细胞加400μL NOK-2。每组设置3 个复孔,各补充培养液至2 mL,培养24 h 后收集悬浮的Jurkat 细胞,再以PBS 清洗2 次,将细胞以1 ×106 个/mL重悬于1 ×Annexin ⅤBinding Buffer 中。另取试管1支,将其中100μL移至其中,分别加入PI 10μL,Annexin Ⅴ-FITC 5μL,轻轻混匀,在常温下避光孵育15 min,再加入400μL 1 ×Annexin ⅤBinding Buffer,进行FCM检测,定量分析细胞凋亡[4]。以FSC/SSC设门,获取门内细胞2 ×104 个,以对数放大荧光强度,并将光散射数据存盘,使用Win MDI 软件进行分析。
1.2.5 SCC-9细胞转染效率检测 采用流式细胞术检测SCC-9 细胞转染效率,当细胞转染12h,以PBS 冲洗6 孔培养板板孔,2 次/孔,而后每孔加入0.25%胰蛋白酶1 m L,在显微镜下观察,待细胞间隙增大,加入含血清的培养基,收集细胞,并将其置于流式细胞管中,以PBS洗2次,细胞浓度调整为1 ×106 个/mL,以PBS 500μL 重悬细胞[5],进行流式细胞术检测。通过检测选出ASODN和Lipo-fectamineTM 2000的最佳转染比例[6],为后续试验提供依据。
1.2.6 逆转录聚合酶链反应(RT-PCR)法检测Fas L ASODN/SODN作用前后Fa s LmRNA水平的变化 (1)抽提总RNA:收集FasL ASODN/SODN转染浓度为0.4μmol/L,作用24 h 的处理组及对照组细胞,抽提总RNA[2]。①细胞(>1 ×106)用PBS 清洗2 次,移入eppendrof 管中。②于细胞沉淀中加入1 m L Trizol Reagent 吹打均匀,置于室温环境5 min,使其充分裂解。放入离心机,12000 ×g,离心5 min,弃沉淀。③加入氯仿200μL,轻微震荡摇振15 s,冰上放置5 min。④4 ℃,12000 ×g,离心15min,另取1 支eppendrof 管,取上层水相置入。⑤加入异丙醇500μL,混匀后于室温下放置10 min。⑥4 ℃,12000 ×g,离心10 min,上清液弃之,沉淀为RNA。⑦用焦碳酸二乙酯(DEPC)水配置75%乙醇1 m L,摇振后充分洗涤、沉淀,4 ℃,8000 ×g,5 min,上清液弃之,重复洗涤1次。⑧上清液弃之,置于无菌干燥环境10 min,加入100μL 无核糖核酸酶(Rnase)的水,沉淀重悬[7],-80 ℃保存备用。(2)RNA定量:取上述样品,用DEPC水将样品稀释100 倍,并以DEPC 水作空白管调零;用紫外分光光度仪检测260 nm和280 nm吸光度(A),计算RNA浓 度,公式为RNA浓度(μg/μL)=A260×40 ×稀释倍数/1000[8]。(3)逆转录过程(反应体系为20μL):①将1μg 总RNA加入微量离心管中,并于70℃温育10 min,短暂离心后置于冰上备用。②依照所列顺序加入以下试剂,建立一个20μL的反应体系。(4)荧光定量PCR结果定量分析:目的基因的表达量采用相对定量法计算结果:相对含量(%)=2-△△Ct-△△Ct=(目的基因Ct-内参基因Ct)对照组-(目的基因Ct-内参基因Ct)实验组。
1.2.7 流式细胞术检测Fas L ASODN/SODN作用前后Fas L蛋白表达量的变化消化并收集0.4 μmol/L的Fas LASODN/SODN转染并作用24 h的SCC-9细胞。实验分为4组:脂质体组(转染时仅加脂质体)、正义链组(以脂质体转染SODN)、反义链组(以脂质体转染ASODN)、空白对照组(细胞不进行转染),每组各3 个复管,1 ×106 个细胞/管;以PBS 清洗2 次,细胞沉淀加入100μL PBS,吹打混匀,PE 标记的FasL 抗体5μL,轻轻吹打,混匀。阴性对照组采用同型对照代替一抗,将其置于4 ℃避光环境30 min[9];以PBS 清洗1 次,加500 μL PBS,采取流式细胞仪进行检测。以FSC/SSC设门,获取门内细胞104个,以对数放大荧光强度,并将光散射数据存盘,使用Win MDI 软件进行分析。
1.2.8 FCM检测Fas LASODN/SODN作用后SCC-9 细胞与Jurkat 细胞共同培养后Jurkat 细胞凋亡率的变化 胰酶消化收集细胞,PBS 清洗2 次,调细胞浓度1 ×106 个/m L;以每孔2 m L接种于六孔板中,24 h后,用0.4 μmol/L的Fas L ASODN/SODN转染液转染六孔板中的SCC-9 细胞,并设空白对照组及脂质体对照组,分别作用48 h 后,以含10%胎牛血清的PMRI-1640 调整Jurkat 细胞浓度为2 ×105 个/m L,加入不同处理组和对照组SCC-9 细胞中,每孔2mL[5],培养24h 后收集 悬 浮Jurkat细胞,以PBS清洗2次,将细胞重悬于500μL ×Annexin V Binding Buferr 之中,与Annexin V-FITC 5 μL 混匀后,加入浓度为250μg/m L的碘化丙啶(PI)5μL,混匀,置于室温避光环境10 min。随后上机分析,光源为448 nm氩离子激光器,FITC 受激发后现绿色荧光,PI 现红色荧光,每份标本收集细胞104个[10]。结果判断标准见参考文献[11]:(1)FITC-/PI-为活细胞;(2)FITC+/PI-为早期凋亡细胞;(3)FITC+/PI+为晚期凋亡细胞;(4)FITC-/PI+为坏死细胞。实验重复3次。
1.3 统计学处理 采用SPSS17.0 统计学软件进行分析,计量资料以±s表示,两组间均数比较采用t 检验,多组间均数的比较采用单因素方差分析,两两比较采用方差分析及q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 荧光显微镜下观察细胞的转染情况及流式细胞术检测的转染效率 转染6 h 后,通过荧光倒置显微镜下观察转染的情况,并在转染12 h后用流式细胞术检测细胞效率,0.1、0.2、0.4、0.8μmol/L ASODN的转染效率分别为66.5%、72.6%、99.7%、99.8%。研究结果表明,将脂质体定量,通过流式细胞术检测及倒置显微镜观察发现,随着FasL ASODN的浓度在一定范围内增加,其转染效率也随之增加。当浓度为0.4 μmol/L 和0.8μmol/L 时,转染效率均为100%左右。图1A、图1D分别为0.4μmo l/LASODN与0.8μmo l/LASODN转染后的眀视野图;图1B、图1E中箭头标注为荧光显微镜下绿色荧光的细胞即为转染成功的细胞。
2.2 MTT 法检测FasL ASODN转染前后对肿瘤细胞增殖的影响FasL ASODN的浓度分别为0.1、0.2、0.4、0.8μmol/L,采用MTT 法检测不同时间段对SCC-9 细胞的增殖的影响。与空白对照组比较,除0.1μmol/L ASODN外,各反义链组24 h的抑制率均有明显的抑制作用(P<0.05);各反义链组48 h 抑制率与空白对照组比较,差异均有统计学意义(P<0.05),且随着ASODN 浓度的升高,抑制作用不断增加,见表1。

图1 FAM绿色荧光标记的Fa s LASODN转染结果示意图(×200)

图2 Fas L ASODN对SCC-9 细胞凋亡的影响
表1 FasL ASODN对SCC-9 细胞增殖的影响(±s,n=3)
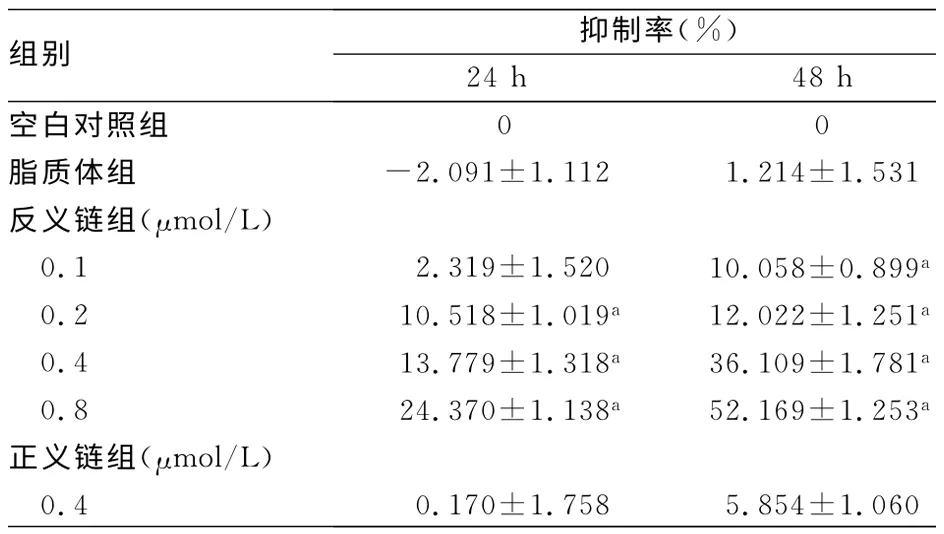
表1 FasL ASODN对SCC-9 细胞增殖的影响(±s,n=3)
a:P<0.05,与空白对照组比较。
组别 抑制率(%)24 h 48 h空白对照组00脂质体组 -2.091±1.1121.214±1.531反义链组(μmol/L)0.12.319±1.52010.058±0.899a 0.210.518±1.019a 12.022±1.251a 0.413.779±1.318a 36.109±1.781a 0.824.370±1.138a 52.169±1.253a正义链组(μmol/L)0.40.170±1.7585.854±1.060
2.3 FasL ASODN诱导SCC-9 细胞的凋亡率的变化 转染6 h 后,通过倒置显微镜进行观察发现反义链组细胞产生凋亡作用,且与空白对照组相比明显增高。转染FasL ASODN 24 h后,流式细胞术检测舌鳞癌细胞的凋亡发现各组间凋亡率无明显的差异。而转染48 h 后,与空白对照组比较的结果,同与脂质体组比较的结果相一致,即反义链组除早期凋亡率外,其余各项指标差异均有统计学意义(P<0.05);反义链组与正义链组比较,其晚期凋亡率、总凋亡率、总病死率差异均有统计学意义(P<0.05)。见图2。
3 讨 论
研究表明,肿瘤的发生和发展与细胞的过度增殖[12]和凋亡的减少有 关[13],1989年,Yonehara 等[14]发 现了Fas 系统 及其诱导多种人细胞系发生凋亡的特性,使其成为重要的凋亡基因之一。肿瘤细胞存在多种免疫逃逸机制,而Fas/Fas L系统则在肿瘤免疫逃逸中发挥着极其重要的作用。肿瘤细胞既可以通过Fas/FasL 系统反击免疫细胞促进T细胞凋亡,从而使肿瘤细胞逃避效应细胞的杀伤和攻击,实现免疫逃逸;还能够通过基因突变、异常转录等方式低表达及不表达Fas 分子,或者表达无功能的Fas,抵抗细胞毒T淋巴细胞(CTL)的杀伤机制,参与免疫逃逸[15]。研究表明,肿瘤细胞对于Fas L触发信号凋亡的敏感性,主要依赖于自身表面正常Fas 蛋白的表达水平,同时也依赖于自然杀伤细胞(NK)和CTL细胞表面正常FasL 蛋白的表达[16]。以往有研究认为,Fas L 表达的升高与肿瘤的生长和转移有着密切的关系,很多恶性肿瘤中都存在Fas L 表达升高的现象,如结肠癌、胰腺癌、胃癌等,其肿瘤细胞表面均存在Fas L 表达,它能够使周围正常表达Fa s 的细胞凋亡,或者使浸润到肿瘤内的肿瘤浸润性淋巴细胞(TIL)凋亡,FasL 通过与激活的T细胞表面F a s 相结合来诱导T细胞凋亡[17],反击宿主免疫系统,从而实现肿瘤细胞逃避免疫活性细胞的监视,促进肿瘤的发生、发展。口腔鳞状细胞癌是口腔颌面部最常见的恶性肿瘤,目前口腔癌患者中有45.9%得的是舌癌,是口腔癌中第一大癌[18]。目前手术治疗是治疗舌癌的主要手段。但术后会引起进食、吞咽或言语困难等。而由于放疗化疗没有辨别能力,所以需要重复放、化疗,多次放、化疗以后,患者免疫功能下降,抵抗力降低,容易转移,因此免疫治疗、基因治疗等新兴治疗手段应运而生。陈乔尔等[19]的研究显示,健康人口腔黏膜的Fas L 为阴性表达,鳞癌组织的Fas L阳性表达率则高达60.5%,而鳞癌组织中TIL的Fas 阳性表达率可高达81.6%,表明口腔鳞癌中存在着Fas/Fas L的表达异常。经过进一步的研究发现并证实,从健康人口腔黏膜→异常增生→口腔鳞癌的发展过程中,Fas L表达表现为逐渐增高[20]。此外,这一研究结果提示Fas 系统介导的凋亡异常对于口腔鳞癌的发生、发展具有重要作用,说明Fas 系统介导的肿瘤逃逸存在于口腔肿瘤中,那么,通过下调Fas L的表达,则可有效地降低肿瘤细胞的抗凋亡能力,免疫逃逸也有望得以逆转,这一结论无疑为后续研究提供了重要理论依据。
本研究中,将脂质体定量,通过流式细胞术检测及倒置显微镜观察发现,随着FasL ASODN的浓度在一定范围内增加,其转染效率也随之增加。结果显示,浓度为0.4μmol/L和0.8μmol/L 时,转染效率均接近100%,因此选用0.4μmol/L Fas L ASODN进行后续试验的检测。研究结果显示,脂质体组和SODN对SCC-9 细胞的增殖并未发生抑制作用,不同浓度的FasL ASODN对SCC-9 的增殖存在不同程度的抑制作用,且Fas L ASODN对SCC-9 增殖的抑制作用有一定的浓度依赖性和时间依赖性,即随着时间的延长和ASODN浓度的增加,FasL ASODN对SCC-9 细胞的抑制作用也增加。流式细胞仪的检测显示,反义组与脂质体组、正义组、空白组比较,晚期凋亡率、总凋亡率及总病死率差异有统计学意义(P<0.05);而早期凋亡率之间虽有变化,但差异无统计学意义(P>0.05),这可能因为检测凋亡时间为转染后48 h,造成作用时间相对过长,致使早期凋亡多已发展为晚期凋亡。笔者认为,Fas L ASODN可以促进舌鳞癌细胞SCC-9 的凋亡,究其原因,是与其逃避免疫系统杀伤的途径有关,研究表明,肿瘤细胞不仅可以通过上调Fas L表达主动杀伤侵入肿瘤内的T细胞凋亡,且能够通过产生可溶性的sFasL与自身Fas 结合,从而封闭Fas 的结合位点,实现降低肿瘤细胞自身的凋亡[21],同时使肿瘤周围正常的细胞产生凋亡;这就是肿瘤细胞逃避免疫细胞Fas 途径攻击并形成肿瘤侵袭的机制之一,且Fas/FasL相互作用不但能引起细胞凋亡,也能引起细胞坏死。此即为本研究中Fas L ASODN能够对SCC-9 的增殖活性产生抑制以及诱导其凋亡的原因之一,然而由于Fas 系统介导的凋亡及非凋亡机制较广泛且复杂,具体的机制尚需要进一步研究。
综上所述,本研究从宏观效应方面证明了FasL ASODN对于舌鳞癌细胞SCC-9 的增殖具有明显的抑制作用,体现了其对于舌癌治疗方法探索的重要价值,为后续研究提供了方向。从理论方面分析,通过减低Fas L的表达,能够减少舌鳞癌细胞对免疫细胞及周围正常细胞的杀伤作用,从而降低其转移与浸润作用。FasL ASODN具体的作用机制及其作用效应有待进一步深入探讨。
[1] Ji J,Wernli M,Buechner S,et al.Fas ligand downregulation with antisense oligonucleotides in cells and in cultured tissues of normal skin epidermis and basal cell carcinoma[J].J Invest Dermatol,2003,120(6):1094-1099.
[2] 张娇,刘倩,王杰,等.Fas L反义寡核苷酸逆转肝癌细胞免疫逃逸的实验研究[J].中国现代普通外科进展,2006,9(3):147-150.
[3] 康敏,钟德君,李鹏,等.Fas/FasL 信号传导通路对NAFLD大鼠肝细胞凋亡的影响[J].重庆医学,2011,40(7):633-635.
[4] 方丽,陈乔尔.Fas L 的反义基因在肿瘤治疗中的作用[J].安徽医药,2013,17(3):370-372.
[5] 方丽,陈乔尔,任翠平,等.Fas L反义寡核苷酸对舌鳞癌细胞Tca8113 增殖和凋亡的影响[J].安徽医科大学学报,2012,47(11):1300-1303.
[6] 路秀英,王垚,李晓明.低氧条件下Stat3 反义寡核苷酸对喉癌细胞Hep-2的化疗增敏作用[J].中国癌症防治杂志,2013,5(4):308-311.
[7] Zheng J,Fu R,Li J,et al.CpG oligonucleotides suppress Hep G2 cells-induced Jurkat cell apoptosis via the Fas-Fas L-mediated pathway[J].J Exp Clin Cancer Res,2011,30(1):48-54.
[8] 李广章,刘长剑,汤欣.PKC-δ在TRAIL 与阿霉素联合诱导骨肉瘤细胞株MG-63 凋亡中的作用[J].中国骨肿瘤骨病,2011,10(3):281-284,310.
[9] 祖谷,陈乔尔,胡芳芳,等.Fas 基因转染联合应用顺铂对舌鳞癌细胞的杀伤作用[J].安徽医科大学学报,2011,46(9):890-892,896.
[10] 刘海威,程乐,吴非,等.脂质体转染survivin 反义寡核苷酸对人胰腺癌细胞凋亡的影响[J].中国普外基础与临床杂志,2010(10):1056-1061.
[11] 郭唐猛,杨群芳,刘承云,等.大鼠心肌缺血再灌注损伤SOCS-1/3 m RNA的 表 达 和 意 义[J].医 学 研 究 杂 志,2011,40(4):89-92.
[12] 张薇.口腔鳞癌细胞Fas/Fas L 的表达及对癌细胞凋亡的影响[J].皖南医学院学报,2010,29(2):92-95.
[13] Shatnyeva OM,Kubarenko AV,Weber CE,et al.Modulation of the CD95-induced apoptosis:the role of CD95 Nglycosylation[J].PLoS One,2011,6(5):e19927.
[14] Yonehara S,Ishii A,Yonehara M.A cell-killing monoclonal antibody(anti-Fas)to a cell surface antigen codownregulated with the receptor of tumor necrosis factor[J].J Exp Med,1989,169(5):1747-1756.
[15] Southwell AL,Skotte NH,Bennett CF,et al.Antisense oligonucleotide therapeutics for inherited neurodegenerative diseases[J].Trends Mol Med,2012,18(11):634-643.
[16] 江磊,林泓磊,张长源,等.口腔临床常用烤瓷合金对小鼠肺成纤维细胞体外毒性研究[J].中国实用口腔医学,2012,5(10):600-609.
[17] 王红梅,张国强,戴纪纲,等.人淋巴瘤细胞Jurkat通过Fas/FasL途径抑制人肺癌细胞A549的免疫逃逸[J].中国肺癌杂志,2010(7):681-685.
[18] 金成日,金彬,玄云泽.Ki-67和Bcl-2在延边地区口腔鳞状细胞癌患者中的表达及其意义[J].重庆医学,2012,41(31):3316-3318.
[19] 陈乔尔,王元银,李倩,等.口腔黏膜癌前病变和口腔鳞癌组织Fas/FasL 的表达及其意义[J].临床口腔医学杂志,2006,22(7):413-416.
[20] 李俊玫,杨宁,王行天,等.野黄芩苷对人舌鳞癌Tca8113细胞周期及Fas蛋白表达的影响[J].实用口腔医学杂志,2013,29(2):250-252.
[21] Fang L,Sun L,Hu FF,et al.Effect of FasL expression in oral squamous cell cancer[J].Asian Pacific J Cancer Prev,2013,14(1):281-285.

