吡非尼酮对肝癌HepG2细胞增殖和凋亡的影响*
韩 枫,凌 心
徐州市肿瘤医院,徐州221005
吡非尼酮对肝癌HepG2细胞增殖和凋亡的影响*
韩 枫,凌 心
徐州市肿瘤医院,徐州221005
目的:研究吡非尼酮(pirfenidone,PF)对人肝癌细胞系HepG2增殖和凋亡的影响。方法:CCK-8法测定不同浓度PF对HepG2细胞增殖活性的影响;Hoechst 33258荧光染色法观察PF处理后HepG2细胞形态的变化;流式细胞仪检测细胞凋亡率。结果:PF对HepG2细胞具有显著增殖抑制作用,并呈浓度和时间依赖性;Hoechst 33258染色可见PF处理后细胞出现典型的凋亡形态学变化;流式细胞仪检测结果显示,与空白组比较,PF处理后的HepG2细胞凋亡率显著增加(P<0.01)。结论:PF对人肝癌细胞系HepG2细胞增殖具有抑制作用,且与诱导HepG2细胞凋亡有关。
吡非尼酮;HepG2细胞;细胞凋亡
肝细胞癌(Hepatocellular carcinoma,HCC)[1-2]是最常见的恶性肿瘤之一,同时也是第三大引起患者死亡的肿瘤。原发性肝癌是我国常见恶性肿瘤,其死亡率居恶性肿瘤的第二位。然而,因早期症状不明显,一经诊断,多为晚期,丧失手术机会,其治疗仍有赖于化疗或与化疗相关的治疗。因此,寻找并开发有效的治疗肝癌药物显得极其重要。
吡非尼酮(pirfenidone PF)[3-4]为近年来用于治疗肺纤维化的药物,该药物是由日本盐野义于2008年上市。研究证实其具有抗炎、抗氧化作用[5-6]。在体外,PF可抑制子宫肌瘤细胞和平滑肌瘤细胞的增殖[7]。而其对人肝癌细胞株HepG2作用尚未见研究报道。本实验旨在研究PF对肝癌HepG2细胞的体外增殖抑制作用及能否诱导HepG2发生凋亡,为临床研究提供理论依据。
1 材料和方法
1.1 仪器
3111型CO2培养箱(美国Thermo公司);倒置荧光显微镜(德国Leica公司);流式细胞仪(美国BD公司);Power Pac系列垂直电泳仪(美国Bio-Rad公司)。
1.2 主要试剂
RPMI 1640培养基(美国Gibco公司);胎牛血清 (杭州四季青生物工程材料有限公司);CCK-8(Cell counting kit-8)检测试剂盒 (日本同仁堂);Hoechst 33258染色液、膜联蛋白V-异硫氰酸荧光素/碘化丙啶细胞凋亡双染试剂盒 (Annexin VFITC/PI apoptosis kit,碧云天生物技术研究所);活性天冬氨酸-胱氨酸特异性抗体 (Actived-caspase-3)一抗(Bioworld Technology,Inc)。
1.3 药物与细胞株
吡非尼酮(纯度99%,购自南京荣世医药科技有限公司);人肝癌细胞株HepG2(购自中国科学院上海细胞库,本实验室传代保存)。
1.4 细胞培养及给药
人肝癌细胞株HepG2培养于含10%胎牛血清的RPMI 1640培养基中,置于37℃、5%CO2饱和湿度的培养箱中,每1~2 d换一次液,常规消化传代,取对数生长期细胞进行实验。PF溶于二甲基亚砜(DMSO),给药时用培养基稀释至所需浓度,DM-SO的最终浓度小于0.001(体积分数);对照组给予相应体积的溶媒,DMSO终浓度为0.001(体积分数)。
1.5 CCK-8法检测PF对HepG2细胞增殖的抑制
取对数生长期的HepG2细胞,0.25%胰酶消化,用培养基吹打成单细胞悬液,接种于96孔板中,每孔5000个细胞,贴壁培养24 h后,分组:0.1%DM-SO为溶媒对照组和不同浓度(0.5、1、2、5、10 mM)的PF组,每组设5个复孔。分别培养24、48、72 h后,吸除培养基,加入无血清培养基(含10%CCK-8)溶液,2 h后于450 nm波长处测定吸光度值,并计算细胞增殖抑制率。
1.6 Hoechst 33258染色检测细胞形态学变化
取对数生长期的HepG2细胞,消化后接种于6孔板中,待长至80%,加入无血清培养基饥饿12 h后更换培养液,分别设0.1%DMSO组和10 mmol· L-1PF组,各设3个复孔。继续培养48 h后弃去培养基,各孔加入1 mL 4%多聚甲醛固定15 min,吸除固定液,PBS洗涤 2次每次 4 min,各孔加入Hoechst 33258染色液500 μL,避光室温放置 8 min,吸除染色液,PBS洗涤2次每次4 min,加入抗猝灭液后于荧光显微镜下观察并拍照。
1.7 流式细胞术检测细胞凋亡率
取对数生长期的HepG2细胞,消化后接种于6孔板中,待长至80%,加入无血清培养基饥饿12h后,更换培养液,分别设0.1%DMSO组和10 mmol·L-1PF组,各3个复孔。继续培养48 h,常规消化细胞后,PBS重悬细胞并计数,取5万~10万细胞,1000 g离心5 min,弃上清液,加入195 μL Annexin VFITC结合液轻轻重悬细胞,加入5 μL Annexin VFITC,轻轻混匀,室温避光孵育10 min,1000 g离心5 min,弃上清液,加入190 μL Annexin V-FITC结合液,轻轻重悬细胞,加入10 μL碘化丙啶染色液,轻轻混匀,冰浴避光放置,随后进行流式细胞仪检测。
1.8 免疫印迹(Western blot)检测凋亡蛋白Actived-caspase-3表达情况
取同代长至80%的细胞两瓶,无血清培养基同步化12 h后,分别设0.1%DMSO组和10 mmol·L-1PF组。继续培养48 h后,搜集细胞,提取蛋白。Western blot实验参照文献方法进行[8]。显影、定影、拍照后,用Image J软件对条带进行灰度值分析,actived-caspase-3蛋白的含量用目的条带灰度值比上内参β-actin条带灰度值的比值。
1.9 统计学分析
采用SPSS 13.0软件进行统计分析,数据均采用均数±标准差(±s),组间比较采用单因素方差分析,两两比较采用LSD法。P<0.05表示差异有统计学意义。
2 结 果
2.1 CCK-8法检测PF对HepG2细胞增殖的抑制
CCK-8法结果显示,不同浓度 PF组作用HepG2细胞24、48、72 h后,对细胞增殖有抑制作用,见表1,P<0.05,有统计学意义,且随着给药浓度的增加和时间的延长,细胞增殖抑制率呈现浓度、时间依赖性。
2.2 Hoechst 33258染色检测细胞形态学变化
Hoechst 33258荧光染色结果显示,0.1%DMSO对照组,细胞无荧光浓染,细胞核无固缩,细胞数目密集,见图1A;PF组出现细胞凋亡现象,细胞核出现固缩、浓染、细胞核碎裂,并可见凋亡小体产生,见图1B。
表1 CCK-8法检测不同浓度下PF对HepG2细胞增殖的影响(±s,n=5)

表1 CCK-8法检测不同浓度下PF对HepG2细胞增殖的影响(±s,n=5)
同一时间点,PF下一浓度与上一浓度比较:*P<0.05、**P<0.01;同一PF浓度,下一时间点与上一时间点比较:#P<0.05、##P<0.01
组别剂量/ mmol·L-1抑制率/% 24 h 48 h 72 h DMSO 0 0 0 PF 0.5 2.06±3.55 5.99±2.99 13.33±4.04#PF 1 7.32±2.91*14.73±4.19**#20.07±2.73*#PF 2 15.16±4.53*30.95±3.42**##41.93±3.89**##PF 5 31.01±4.37**45.21±3.67**##61.06±2.71**##PF 10 48.21±2.33**62.39±2.11**##85.78±3.34**##
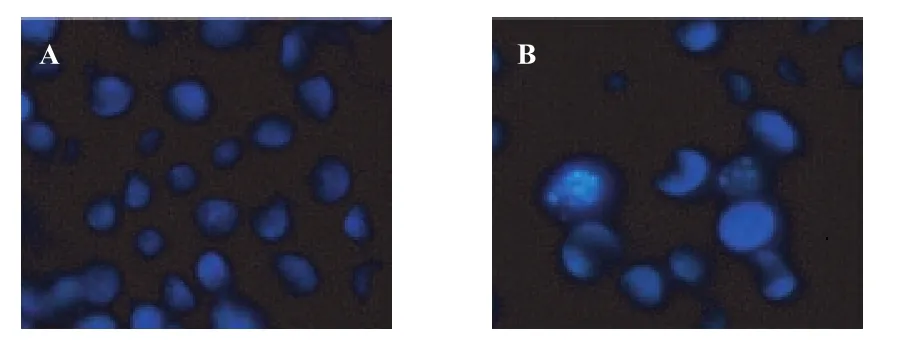
图1 荧光显微镜观察HepG2细胞形态
2.3 流式细胞术检测细胞凋亡率
流式细胞仪检测结果显示,PF处理HepG2细胞48 h后发生细胞凋亡,见图2B,凋亡率为(12.53± 1.35)%;DMSO组为 (3.43±0.86)%,见图2A,P<0.01,有统计学意义。
2.4 PF对凋亡蛋白actived-caspase-3表达的影响
Western blot结果显示,PF处理HepG2细胞48 h后,可激活caspase-3蛋白表达,使activedcaspase-3蛋白表达增加,见图3,与DMSO组相比,P<0.01,有统计学意义。
3 讨 论
吡非尼酮是一种新型抗纤维化药物,近年来通过大量试验证明,吡非尼酮具有较好的抑制细胞增殖作用,其在抗肿瘤方面的作用也受到医药界的关注。
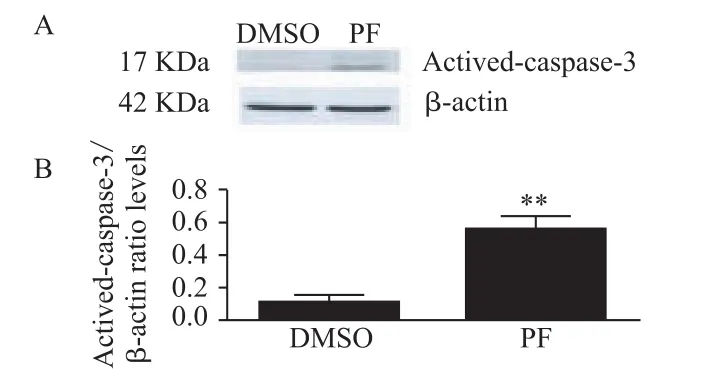
图3 0.1%DMSO组,10 mmol·L-1PF组activedcaspase-3蛋白表达情况
使用化学药物诱导癌细胞发生凋亡是一种很有前景的治疗癌症的方法。由Hoechst 33258染色及Western blot结果显示,吡非尼酮可诱导HepG2细胞发生凋亡,且可能是通过细胞特异性caspase依赖的信号途径,其中caspase-3为凋亡的效应因子,负责对凋亡途径最后执行阶段的全部或部分关键性蛋白酶的剪切,被称为凋亡的“执行者”。
综上所述,本研究证实吡非尼酮可抑制HepG2细胞增殖和诱导其发生凋亡,且增殖抑制作用具有浓度、时间依赖性。吡非尼酮可能是通过诱导HepG2细胞发生凋亡来抑制HepG2细胞的生长,为进一步研究吡非尼酮抗肿瘤的机制,提供了理论依据。然而,其能否对肝癌实体瘤的生长有抑制作用及对正常肝细胞是否有影响,还需通过今后的进一步实验来验证。
[1]Moudgil V,Redhu D,Dhanda S,et al.A review of molecular mechanisms in the development of hepatocel-lular carcinoma by aflatoxin and hepatitis B and C viruses[J].J Environ Pathol Toxicol Oncol,2013,32(2): 165-75.
[2]Mitchell KA.Hepatocellular carcinoma:histologic con-siderations:pure,mixed,and motley[J].J Clin Gas-troenterol,2013,47 Suppl:S20-6.
[3]Burghardt I,Tritschler F,Opitz CA,et al.Pirfenidone inhibits TGF-β expression in malignant glioma cells[J].Biochem Biophys Res Commun,2007,354(2):542-7.
[4]Xaubet A,Serrano-Mollar A,Ancochea J.Pirfenidone for the treatment of idiopathic pulmonary fibrosis[J].Expert Opin Pharmacother,2013,15(2):275-81
[5]Choi YH,Back KO,Kim HJ,et al.Pirfenidone attenu-ates IL-1beta-induced COX-2 and PGE2 production in orbital fibroblasts through suppression of NF-kappaB activity[J].Exp Eye Res,2013,113:1-8.
[6]Hisatomi K,Mukae H,Sakamoto N,et al.Pirfenidone inhibits TGF-beta1-induced over-expression of collagen type I and heat shock protein 47 in A549 cells[J].BMC Pulm Med,2012,12:24.
[7]Lee BS,Margolin SB,Nowak RA.Pirfenidone:a novel pharmacological agent that inhibits leiomyoma cell pro-liferation and collagen production[J].J Clin Endocrinol Metab,1998,83(1):219-23.
[8]Konopleva M,Contractor R,Tsao T,et al.Mechanisms ofapoptosissensitivity and resistance to the BH3 mimetic ABT-737 in acute myeloid leukemia[J].Cancer Cell,2006,10(5):375-88.
Effect of Pirfenidone on Proliferation and Apoptosis of Human Hepatocellular Carcinoma HepG2 Cells*
HAN Feng,LING Xin
Xuzhou Cancer Hospital,Xuzhou 221005
Objective:To investigate the effect of pirfenidone(PF)on cell proliferation and apoptosis of HepG2 cells in vitro.Methods:The cell proliferation inhibition of HepG2 cells by PF was observed by CCK-8 assay.The morphology of HepG2 cells with Hoechst 33258 staining was observed under a fluores-cent microscope.The apoptosis was analyzed by flow cytometry.Results:PF obviously inhibited the prolif-eration of HepG2 cells in a time and dose dependent manner.Hoechst 33258 staining showed apoptosis was induced after PF treatment.Flow cytometry results showed that PF could induce HepG2 cells apopto-sis,compared with the control group (P<0.01).Conclusion:PF inhibits the proliferation of HepG2 cells probably because of inducing HepG2 cells apoptosis.
Pirfenidone;HepG2 cells;Apoptosis
R965.1
A
1673-7806(2015)03-223-03
徐州市科技发展指导计划项目(No.XZZDY1404)
韩枫,女,副主任药师 E-mail:hanfeng1966@126.com
2015-01-13
2015-02-25

