姜黄素通过血红素加氧酶-1信号通路促进脂肪源干细胞增殖和旁分泌研究
刘剑锋 朱平 马守原 陈海旭 王曙霞 李珊
·基础研究·
姜黄素通过血红素加氧酶-1信号通路促进脂肪源干细胞增殖和旁分泌研究
刘剑锋 朱平 马守原 陈海旭 王曙霞 李珊
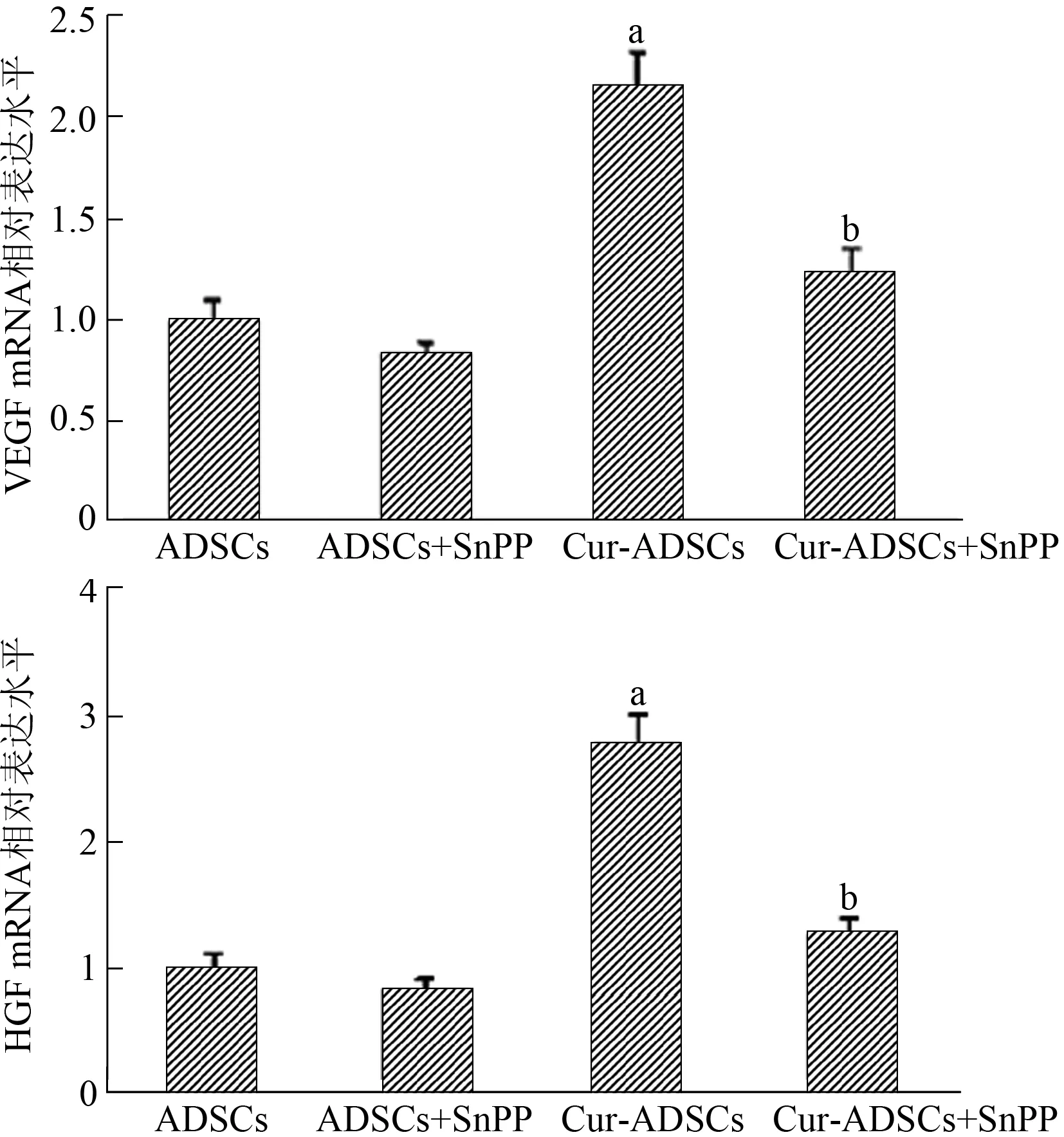
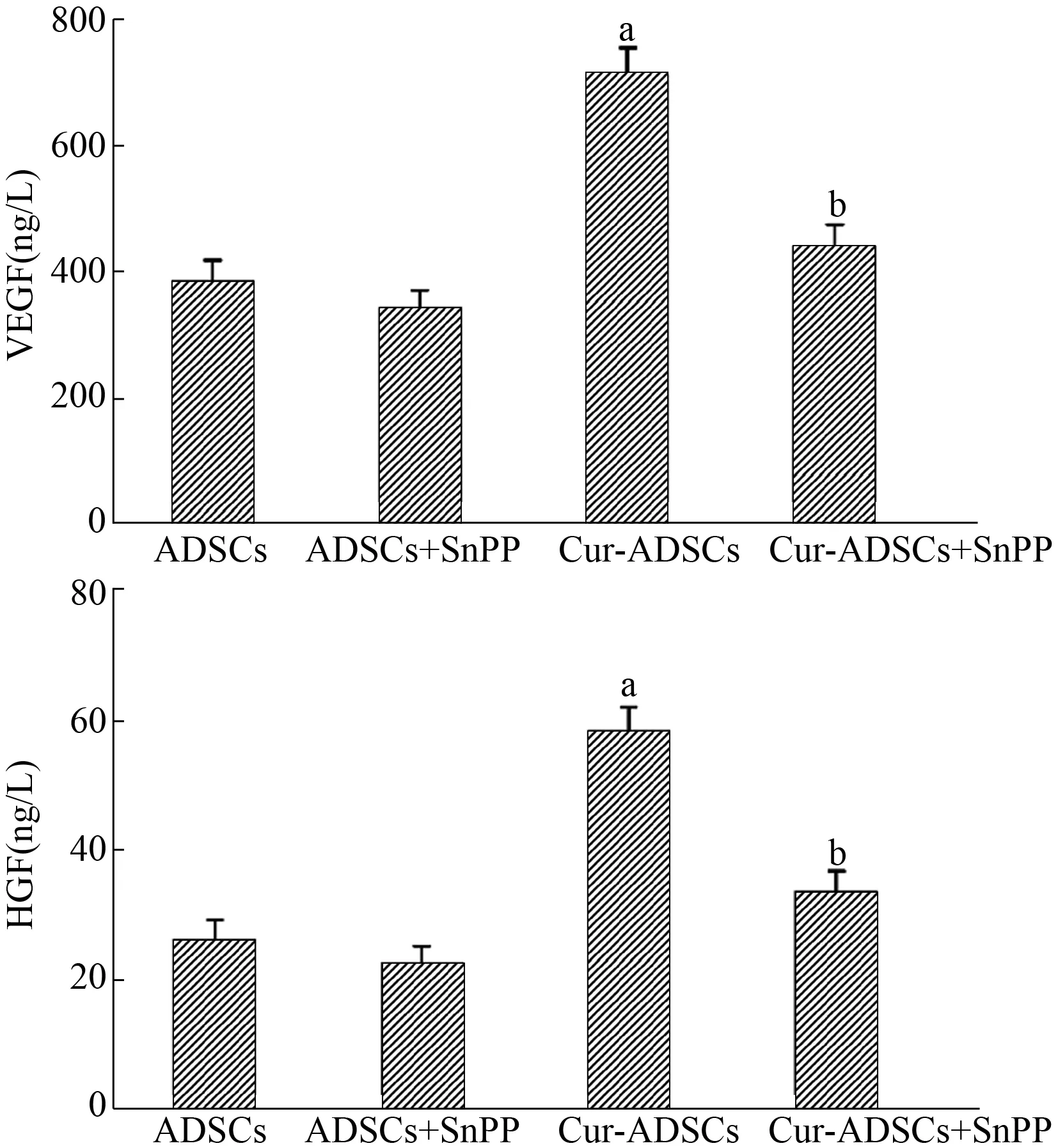
目的 探讨姜黄素对脂肪源干细胞(ADSCs)增殖和旁分泌的作用及其机制。方法酶法分离、扩增SD大鼠腹股沟的ADSCs,流式细胞仪检测细胞表型;MTT法检测不同浓度姜黄素对细胞生长曲线的影响,筛选最佳姜黄素处理浓度;姜黄素预处理ADSCs 24 h,加用血红素加氧酶-1(HO-1)抑制剂SnPP阻断HO-1活性;qPCR和Western blot检测HO-1信号在姜黄素处理ADSCs过程中的变化;MTT法检测HO-1活性对姜黄素促进细胞增殖的影响;PCR和Elisa法分别检测姜黄素对ADSCs分泌VEGF和HGF的影响。结果 第3代ADSCs的CD29、CD90阳性,CD31、CD34、CD45阴性。姜黄素促进ADSCs增殖的作用呈时间依赖性,最佳处理浓度为10 μmol/L。加用SnPP后,促增殖作用显著降低(P=0.001)。姜黄素能显著促进ADSCs分泌VEGF和HGF(分别为P=0.001和P=0.007),SnPP能明显抑制姜黄素的促分泌作用[Cur-ADSCs比Cur-ADSCs+SnPP:VEGF为(712.2±43.1)ng/L比(442.3±33.2)ng/L,P=0.001;HGF为(58.3±3.7)ng/L比(33.7±3.1)ng/L,P=0.001]。在此过程中,HO-1表达的变化方向和姜黄素促进ADSCs增殖和旁分泌的方向一致。结论HO-1介导了姜黄素促进ADSCs增殖和旁分泌的作用。姜黄素是一种有前景的增强干细胞治疗疗效的候选药物。
姜黄素; 血红素加氧酶-1; 脂肪干细胞; 细胞增殖; 旁分泌
干细胞是心脏再生研究的热点之一。脂肪间充质干细胞(adipose-derived stem cells,ADSCs)具有来源丰富、取材方便、易培养扩增、潜在的向心肌自发分化等优点,并且与骨髓间充质干细胞具有相似的性质,日益受到青睐,广泛应用于基础与临床研究。然而,ADSCs的数量及旁分泌功能严重影响其功能发挥。因此,亟须开发新的方法和策略增加ADSCs的数量及其旁分泌功能。
姜黄素(curcumin)是从姜科姜黄属植物姜黄根茎中提取的一种酚性色素,具有强大的抗炎、抗氧化作用,能刺激胚胎神经祖细胞的增殖[1]。而且,姜黄素能诱导ADSCs中血红素氧合酶-1(heme oxygenase-1,HO-1)的表达,降低ADSCs的氧化应激损伤[2]。虽然HO-1的高表达促进骨髓间充质干细胞的增殖与旁分泌[3],但姜黄素能否通过上调HO-1表达促进ADSCs的增殖和旁分泌尚未见报道。本研究拟通过探索姜黄素对ADSCs增殖能力的影响,结合HO-1抑制剂,探讨姜黄素促进ADSCs增殖和旁分泌的作用机制,为ADSCs移植治疗心肌梗死提供新策略。
1 材料与方法
1.1 动物和药物准备
选取60~80 g雌性SD大鼠(3~4周龄),实验步骤依据美国国立卫生研究院(NIH)2011年公布的实验动物管理及使用指南(第8版),并获得解放军总医院的动物伦理委员会(IACUC)批准。姜黄素源自Biomol 公司(AG-CN2-0059-M010,美国)。
1.2 ADSCs的分离、培养、鉴定
1.2.1 ADSCs的分离、培养 将SD大鼠麻醉并断颈处死,无菌条件下取出腹股沟处脂肪组织,经PBS洗涤、剪碎,Ⅳ型胶原酶和胰酶消化后,匀速搅拌1 h,经中和、过滤、离心、弃上清、重悬等步骤后,将细胞悬液(1×106/ml)接种至10 cm培养皿中,添加10% α-MEM培养基,待细胞生长至70%~80%汇合时,消化、收集贴壁的细胞(原代细胞,P0),以1∶3的比例进行传代。本实验中使用的细胞均为第3代(P3)。贴壁培养24 h后使用普通光学显微镜(SZ51,日本Olympus公司)进行细胞形态观察。
1.2.2 流式细胞仪表型鉴定 取P3的ADSCs,以1×106细胞/ml悬液的密度,分装至1.5 ml的Eppendoff离心管中,以细胞染色缓冲液(Cell Staining Buffer,美国Biolegend公司)洗涤2次后,根据CD34、CD31、CD45、CD90和CD29的抗体说明书,加入适量抗体,37℃暗室孵育30 min,再次以细胞染色缓冲液洗涤,最后每管加入1 ml细胞染色缓冲液重悬细胞,进行流式细胞仪(美国BD accrri C6)检测。
1.3 ADSCs的活性检测
ADSCs以3 000细胞/孔接种于96孔板中,分别给予0、1、5、10和20 μmol/L姜黄素处理24 h,采用MTT法在第1、3、5和7天进行检测。检测前将培养基移除,加入20 μl MTT液(5 mg/ml),37℃避光孵育4 h,移除培养液后加入200 μl DMSO,摇晃震荡15 min后应用酶标仪检测490 nm的吸光度值(D490),每种浓度设置3个复孔,均重复5次。最后将所得数值绘制为生长曲线。
1.4 实验分组
将ADSCs以1×106细胞/皿接种到10 cm培养皿中6 h后,细胞分为4组:ADSCs、ADSCs+SnPP、Cur-ADSCs、Cur-ADSCs+SnPP。SnPP是HO-1抑制剂,浓度采用50 μmol/L[4],预处理ADSCs 24 h后,PBS漂洗3次,再用促生长的姜黄素最佳浓度贴壁培养24 h。
1.5 实时定量聚合酶链反应(qPCR)检测旁分泌因子的mRNA水平
PBS洗涤2遍,以细胞刮收集ADSCs,提取总RNA,反转录cDNA,每组至少3个样本,检测以下基因:β-actin(内参)、肝细胞生长因子(hepatocyte growth factor,HGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和HO-1。qPCR使用FastStart Universal SYBR Green Master和StepOnePLUS System检测。由3名独立的实验人员分析。所有引物由Primer 5.0软件设计,引物序列如表1。

表1 qPCR检测的引物序列
1.6 Elisa法检测ADSCs分泌的VEGF和HGF浓度
ADSCs在有或无姜黄素条件下贴壁培养24 h后,按照Elisa检测盒(VEGF,美国Sigma Aldrich公司;HGF,美国B-Bridge公司)的说明书要求,收集ADSCs上清液。根据不同浓度标准品的标准曲线,计算上清液中的样品浓度。
1.7 Western blot检测ADSCs的HO-1表达
将裂解收集的ADSCs样本,低温快速匀浆、离心,使用BCATM法测定蛋白浓度。将制备好的12%十二烷基磺酸钠凝胶,灌注于电泳板梳孔中,凝固后经洗涤、二抗孵育、弃封闭液、再次洗涤等步骤,检测PVDF膜上的蛋白条带。HO-1抗体源自美国Cell Signaling公司。通过蛋白条带的平均光密度来比较蛋白表达情况。
1.8 统计学方法

2 结果
2.1 ADSCs的形态及表型鉴定
原代(P0)和第3代(P3)ADSCs贴壁24 h后形态均为梭形、成纤维样(图1A)。此外,传代到P3后,大部分ADSCs的间充质免疫标志CD29和CD90表达为阳性,而造血细胞标志CD34和CD45均呈阴性。而且,血管内皮细胞标记CD31的表达也是阴性(图1B)。结果表明,分离的细胞符合ADSCs的表型特征。
2.2 姜黄素对ADSCs活性的影响
不同浓度(0、1、5、10和20 μmol/L)姜黄素对ADSCs的促增殖作用在处理第1、3、5和7天时呈时间依赖性增强(均为P<0.05)。但是,第5天开始,20 μmol/L姜黄素对ADSCs的促增殖作用开始弱于10 μmol/L姜黄素的作用(图2)。提示10 μmol/L姜黄素的促增殖效果最佳,增强ADSCs的活性最好。

A:原代(P0)和第三代(P3)ADSCs形态;B:第3代(P3)ADSCs表型的流式鉴定

图2 不同浓度姜黄素对ADSCs生长曲线的影响
2.3 姜黄素对HO-1信号的影响
qPCR结果表明,姜黄素能显著上调HO-1的mRNA,但这种增强作用能被SnPP明显抑制(P=0.001)。对于单纯ADSCs,mRNA表达水平在加入SnPP组和未加入SnPP组之间无明显差异(图3A)。在此基础上,我们检测了HO-1蛋白的表达水平。Western blot结果印证了上述qPCR结果,即姜黄素能显著提高HO-1的表达,而这种增强作用能被SnPP明显削弱(图3B)。上述结果提示姜黄素可能通过激活HO-1信号发挥作用。

A:姜黄素对HO-1 mRNA的影响;B:姜黄素对HO-1蛋白的影响。与ADSCs组相比,aP<0.05;与Cur-ADSCs组相比,bP<0.05
2.4 HO-1介导姜黄素对ADSCs的促增殖作用
MTT结果显示,姜黄素明显促进ADSCs的增殖,但这种促增殖作用被SnPP显著削弱(P=0.001),导致与未处理ADSCs组相比无明显差异(图4)。提示姜黄素对ADSCs的促增殖作用是通过HO-1介导的。

与ADSCs组相比,aP<0.05;与Cur-ADSCs组相比,bP<0.05
与ADSCs组相比,aP<0.05;与Cur-ADSCs组相比,bP<0.05
2.5 HO-1介导姜黄素对ADSCs的促旁分泌作用
qPCR结果显示,姜黄素显著增强ADSCs的VEGF mRNA和HGF mRNA表达水平。而SnPP的加入抑制了ADSCs的VEGF和HGF mRNA表达水平(图5)。为了更准确描述姜黄素的促旁分泌作用,Elisa结果显示,姜黄素能促进ADSCs分泌VEGF和HGF,而SnPP抑制ADSCs的VEGF和HGF分泌量(图6)。这些均表明,HO-1在姜黄素促进ADSCs旁分泌过程中发挥了重要作用。
与ADSCs组相比,aP<0.05;与Cur-ADSCs组相比,bP<0.05
3 讨论
ADSCs在组织再生研究中具有巨大应用前景。干细胞的增殖能力对于其活性至关重要,能明显影响干细胞移植后的存活。此外,近年研究报道,干细胞的旁分泌作用是干细胞移植治疗心肌梗死的重要机制。作为旁分泌因子,VEGF和HGF能诱导内皮细胞和血管平滑肌细胞迁移、增殖以及血管形成[5]。鉴于心肌缺血缺氧条件下,干细胞活性下降,旁分泌功能降低,因此促进干细胞存活、进而增强其旁分泌功能是提高干细胞移植疗效的重要策略。Hsiao等[6]证实,低氧预适应显著增强ADSCs的血管生成和旁分泌能力。Hou等[3]应用胶原蛋白复合HO-1处理MSCs,发现MSCs的旁分泌功能明显增加,显著促进糖尿病缺血性溃疡的治疗。而且,研究者本人2014年应用Exendin-4预处理ADSCs后发现,ADSCs经药物处理后的旁分泌因子显著增多,有效促进缺血心肌的修复[7]。姜黄素能影响多种细胞的增殖、分化和旁分泌功能。据报道,姜黄素对癌症细胞有抗增殖作用[8]。与之相反,另有研究表明,姜黄素能促进胚胎神经祖细胞的增殖[1]。但姜黄素对ADSCs的增殖及旁分泌影响均尚未见报道。
本研究发现,姜黄素对ADSCs的促增殖作用呈浓度依赖性,10 μmol/L姜黄素对ADSCs的促增殖效力最大,且能显著促进ADSCs分泌VEGF和HGF。因此,姜黄素是ADSCs移植治疗疾病的一种有效候选辅助方法。HO-1是血红素加氧酶的诱导型,能将血红素代谢为CO、铁离子和胆绿素、胆红素。据报道,作为一种抗氧化代谢关键酶,HO-1上调能保护干细胞免受氧化应激损伤、促进MSCs增殖及旁分泌并促进血管形成[3, 9]。HO-1下调降低干细胞和祖细胞对急性应激的反应[10]。与上述实验结果相似,本研究结果显示HO-1在姜黄素促进ADSCs的增殖和旁分泌过程中发挥重要作用,是一种关键调控信号。
综上所述,本研究证实姜黄素改善ADSCs活性的最佳浓度是10 μmol/L;姜黄素能显著促进ADSCs的增殖和旁分泌功能;在此过程中,HO-1发挥了至关重要作用。作为一种预处理策略,姜黄素能显著增强ADSCs的增殖和旁分泌作用,而HO-1介导了整个过程。
[1] Kim SJ, Son TG, Park HR, et al. Curcumin stimulates proliferation of embryonic neural progenitor cells and neurogenesis in the adult hippocampus[J]. J Biol Chem, 2008, 283: 14497-14505.
[2] Cremers NA, Lundvig DM, van Dalen SC, et al. Curcumin-induced heme oxygenase-1 expression prevents H2O2-induced cell death in wild type and heme oxygenase-2 knockout adipose-derived mesenchymal stem cells[J]. Int J Mol Sci, 2014, 15: 17974-17999.
[3] Hou C, Shen L, Huang Q, et al. The effect of heme oxygenase-1 complexed with collagen on MSC performance in the treatment of diabetic ischemic ulcer[J]. Biomaterials, 2013, 34: 112-120.
[4] Chabannes D, Hill M, Merieau E, et al. A role for heme oxygenase-1 in the immunosuppressive effect of adult rat and human mesenchymal stem cells[J]. Blood, 2007, 110: 3691-3694.
[5] Gnecchi M, Zhang Z, Ni A, et al. Paracrine mechanisms in adult stem cell signaling and therapy[J]. Circ Res, 2008, 103: 1204-1219.
[6] Hsiao ST, Lokmic Z, Peshavariya H, et al. Hypoxic conditioning enhances the angiogenic paracrine activity of human adipose-derived stem cells[J]. Stem Cells Dev, 2013, 22: 1614-1623.
[7] Liu J, Wang H, Wang Y, et al. The stem cell adjuvant with Exendin-4 repairs the heart after myocardial infarction via STAT3 activation[J]. J Cell Mol Med, 2014, 18: 1381-1391.
[8] Lim TG, Lee SY, Huang Z, et al. Curcumin suppresses proliferation of colon cancer cells by targeting CDK2[J]. Cancer Prev Res (Phila), 2014, 7: 466-474.
[9] Zeng B, Lin G, Ren X, et al. Over-expression of HO-1 on mesenchymal stem cells promotes angiogenesis and improves myocardial function in infarcted myocardium[J]. J Biomed Sci, 2010, 17: 80.
[10] Cao YA, Wagers AJ, Karsunky H, et al. Heme oxygenase-1 deficiency leads to disrupted response to acute stress in stem cells and progenitors[J]. Blood, 2008, 112: 4494-4502.
(本文编辑:谭潇)
Curcumin promotes the proliferation and paracrine of ADSCs via HO-1 Pathway
LiuJianfeng1,ZhuPing1,MaShouyuan1,ChenHaixu2,WangShuxia1,LiShan1.
1DepartmentofGeriatricCardiology,ChinesePLAGeneralHospital,Beijing100853; 2InstituteofGeriatrics
ZhuPing,Email:shenlangliu@163.com
Objective To explore the effects and mechanism of curcumin on the proliferation and paracrine of adipose-derived stem cells (ADSCs). Methods ADSCs were isolated through enzymes from SD rats inguina. The phenotypes of ADSCs were analyzed by flow cytometry. The effects of different concentrations of curcumin on cell growth curve were determined through MTT. Following by pretreatment of curcumin on ADSCs for 24 h, the SnPP, an inhibitor of heme oxygenase-1 (HO-1), was added to suppress HO-1 activity. PCR and western blotting was used to assess the changes of HO-1 expression during the curcumin treatment. The effects of HO-1 expression on the curcumin promoting proliferation by MTT. qPCR and Elisa were applied to investigate the influences of curcumin on the secretion of VEGF and HGF. ResultsAfter three passages, most of adherent ADSCs expressed CD29 and CD90. But they were negative for CD31, CD34 and CD45. The promoting proliferation of curcumin on ADSCs depended on time. The optimal treatment concentration of curcumin was 10 μmol/L. After added SnPP, the increased proliferation of ADSCs by curcumn pretreatment decreased significantly (P=0.001). And the enhancing VEGF and HGF secreted by curcumin pretreated ADSCs (P=0.001 andP=0.007, respectively) were reduced by treatment of SnPP [Cur-ADSCsvs. Cur-ADSCs+SnPP: VEGF: (712.2±43.1) ng/Lvs. (442.3±33.2) ng/L,P=0.001;HGF: (58.3±3.7) ng/Lvs. (33.7±3.1) ng/L,P=0.001]. Importantly, the change trend of HO-1 was parallel with the promoting proliferation and paracrine of ADSCs by pretreatment of curcumin. Conclusions Curcumin promotes the proliferation and paracrine of ADSCs partly via HO-1 signaling pathway. Curcumin is a promising candidate drug for enhancing the therapeutic effects of stem cells.
Curcumin; Heme oxygenase-1; Adipose-derived stem cells; Cell proliferation; Paracrine
10.3969/j.issn.1007-5410.2015.03.010
国家自然科学基金主任基金(8135002);解放军总医院临床扶持基金(2013FC-TSYS-2015)
100853 北京,解放军总医院南楼心内科(刘剑锋、朱平、马守原、王曙霞、李珊),老年医学研究所(陈海旭)
朱平,电子信箱:shenlangliu@163.com
2015-03-31)
ThisworkwassupportedbythegrantsfromNationalNaturalScienceFoundationofChina(No. 8135002)andClinicalSupportFoundationofChinesePLAGeneralHospital(No. 2013FC-TSYS-2015).

