内毒素对大鼠小肠黏膜组织的影响及多价阳离子A的保护效应
严玉霖,高 洪,卢 琴,王修庚,赵 汝,陈 玲
(云南农业大学动物科学技术学院,云南昆明 650201)
内毒素对大鼠小肠黏膜组织的影响及多价阳离子A的保护效应
严玉霖,高 洪*,卢 琴,王修庚,赵 汝,陈 玲
(云南农业大学动物科学技术学院,云南昆明 650201)
旨在揭示大肠埃希菌内毒素(ET)对大鼠小肠黏膜的结构、绒毛长度、上皮内淋巴细胞(IEL)的数量和分布的影响,并探讨多价阳离子A(CA)对上述指标的保护效应。选用72只140 g~150 g SPF级SD大鼠随机分为3组,即对照组、ET组和CA保护组,经相应处理后分别在3、4、8、12 h采集十二指肠、空肠组织作为检测样本,制备病理组织切片,HE染色并利用图像分析系统进行分析。ET组十二指肠和空肠绒毛长度在3、4、8、12 h均显著低于对照组和CA保护组(P<0.01),ET组十二指肠、空肠IEL数量在3、4、8、12 h均显著低于对照组(P<0.01);CA保护组十二指肠和空肠IEL数量在4、8、12 h均显著高于ET组(P<0.01)。结果显示,ET在不同程度上能够破坏小肠黏膜的正常组织结构,降低小肠绒毛长度,减少IEL的数量,从而影响小肠正常的吸收和免疫功能,而CA则能明显降低ET所导致的毒性作用,发挥其保护效应。
内毒素;阳离子A;小肠绒毛长度;上皮内淋巴细胞;大鼠
内毒素(endotoxin, ET)是革兰阴性细菌细胞壁的组成成分,其化学本质为脂多糖(lipopolysaccharide, LPS),为细菌死亡或活跃繁殖时所释放,广泛存在于自然界,常造成人、畜内毒素血症和内毒素休克(或称感染性休克),并对食物、药物、试剂和溶液造成污染,是严重威胁人、畜健康的致病因子[1]。内毒素(ET)分子中含有大量带负电荷的磷酸基团,而维持这种负电荷的存在是ET发挥生物活性的必要条件之一,在Rietschel的“干扰ET结构或干扰含有ET结构的膜的药物都可以帮助杀死细菌”的理论指导下[2],本试验根据David S A等[3]在对内毒素拮抗剂的研究中发现带有正电荷的药物是通过其所带正电荷基团与内毒素脂质A上的PO4-结合,从而破坏内毒素结构,并拮抗内毒素的生物活性,多价阳离子A(polycation ion A,CA)带有大量的正电荷基团,可使机体的抗氧化能力增强,并可直接与携带阴离子的脂质A部分特异性结合,从而使脂质A不能介导其相应的生物学活性。
肠绒毛(intestinal villus)是由肠上皮和固有层共同向肠腔突出形成的细小突起,长度约0.35 mm~1 mm,使肠腔表面积进一步扩大10倍。形状不一,以十二指肠和空肠最发达,是营养物质主要的吸收场所。本研究通过建立成年大鼠内毒素血症模型,对不同试验组的大鼠肠道黏膜绒毛结构、肠绒毛长度、上皮内淋巴细胞(intrepithelial lymphocytes, IEL)的数量和分布的变化情况进行研究,探讨ET对小肠黏膜组织结构的影响及CA拮抗ET的保护效应,从而进一步阐述内毒素血症的病理过程和发病机制及CA对该病的预防和治疗机制,为该病的预防、诊断、治疗及新型药物和疫苗的开发提供试验依据。
1 材料与方法
1.1 材料
大肠埃希菌O111,B4内毒素L2630为美国Sigma公司产品;阳离子A为美国AMRESCO公司产品;无水乙醇、二甲苯、甲醛为上海试剂一厂产品;72只SD大鼠由昆明医科大学提供,体重140 g/只~150 g/只,雌(无孕)雄不拘。
1.2 方法
1.2.1 动物分组与处理 临床检查确认健康后,颗粒饲料预饲养3 d,自由饮水,随机分为3组:对照组(n=24),静脉注射等量无热源生理盐水;ET致病组(n=24),尾静脉注射ET 5 mg/kg;CA保护组(n=24),先静脉注射CA溶液 1 g/kg,然后在2 min内接着尾静脉注射ET 5 mg/kg。
1.2.2 样品采集 3组大鼠分别第3、4、8、12 h每组各处死6只,采集小肠十二指肠、空肠组织放入100 g/L中性福尔马林固定液,用于肠绒毛长度、上皮内淋巴细胞检测。
1.2.3 小肠组织切片的制备及HE染色 取固定后的十二指肠、空肠组织,用手术刀修成约1 cm×1 cm×0.2 cm大小的组织块,进行脱水、透明、浸蜡、包埋处理后,用切片机切成厚度为5 μm左右的切片于载玻片上,进行脱水再水化,HE染色后于光学显微镜下观察,根据组织细胞形态学,进行鉴别。每个样品取5个视野,在光学显微镜下观察并用图像分析系统进行计数和定量分析。
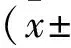
2 结果
2.1 各试验组大鼠十二指肠绒毛长度的动态变化
表1结果表明,CA保护组十二指肠绒毛长度在3、4、8、12 h均显著高于ET致病组(P<0.01),对照组十二指肠在绒毛长度3、4 、8、12 h均显著高于ET致病组(P<0.01)。
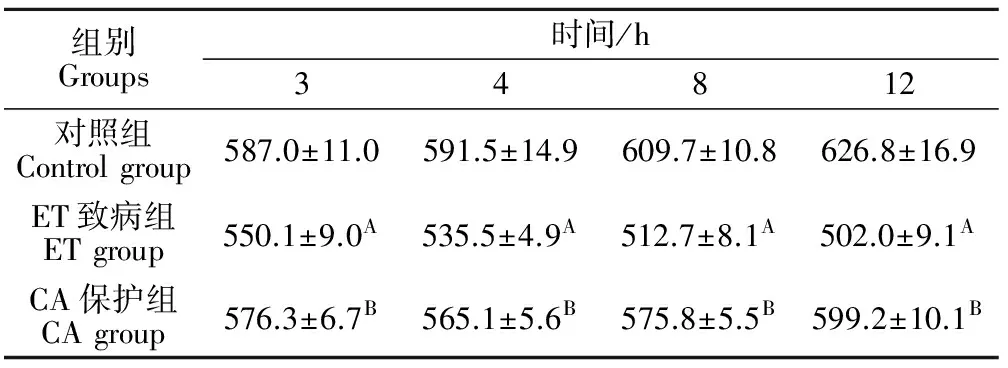
表1 各试验组大鼠十二指肠绒毛长度的动态变化Table 1 The changes of the length of the intestinal villi of the duodenum in each group
2.2 各试验组大鼠空肠绒毛长度的动态变化
表2结果表明,CA保护组空肠绒毛长度在3、4、8、12 h均显著高于ET致病组(P<0.01),对照组空肠绒毛长度在3、4、8、12 h均显著高于ET致病组(P<0.01)。
2.3 各试验组大鼠十二指肠黏膜IEL数量的动态变化
表3结果表明,CA保护组十二指肠IEL数量在4、8、12 h均显著高于ET致病组(P<0.01),对照组十二指肠IEL数量在3、4、8、12 h均显著高于ET致病组(P<0.01)。
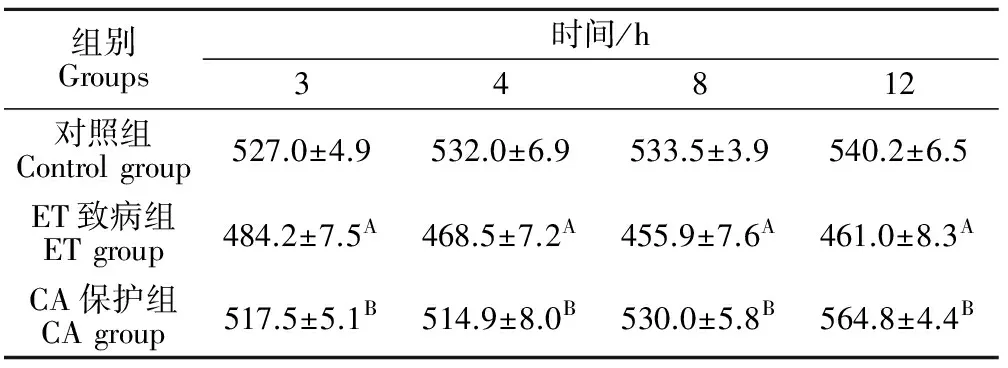
表2 各试验组大鼠空肠绒毛长度的动态变化Table 2 The changes of the length of the intestinal villi of the jejunum in each group

表3 各试验组大鼠十二指肠黏膜IEL数量的动态变化Table 3 The changes of the quantity of IEL of the duodenum in each group
2.4 各试验组大鼠空肠黏膜IEL数量的动态变化
表4结果表明,CA保护组空肠IEL数量在4、8、12 h均显著高于ET致病组(P<0.05),对照组空肠IEL数量在3、4、8、12h均显著高于ET致病组(P<0.01)。
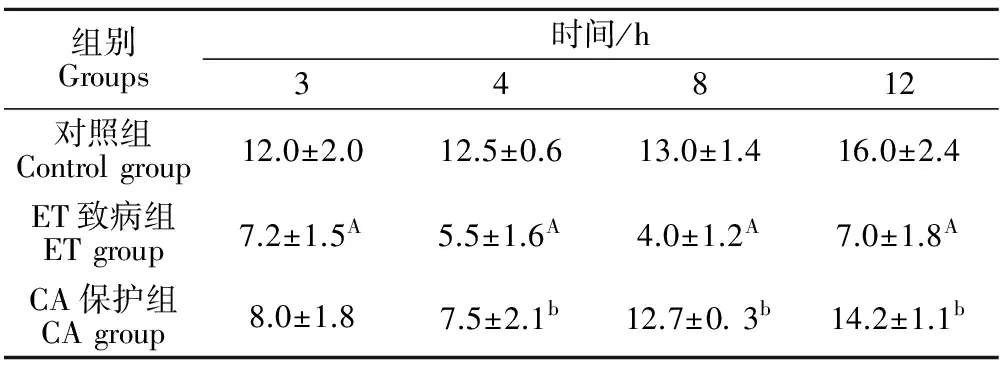
表4 各试验组大鼠空肠黏膜IEL数量的动态变化Table 4 The changes of the quantity of IEL of the jejunum in each group
2.5 各组大鼠小肠黏膜结构变化
由图1可见,对照组十二指肠绒毛结构完整且绒毛较长。ET组十二指肠绒毛结构有明显损伤,十二指肠绒毛中上部上皮细胞坏死、脱落、固有层裸露,且绒毛长度明显较短。CA保护组十二指肠绒毛结构损伤较轻,十二指肠绒毛只有顶端上皮细胞坏死、脱落、部分固有层裸露,且绒毛长度明显较长。
由图2~图3可见,对照组十二指肠、空肠 IEL数量明显较多。ET组十二指肠、空肠IEL数量明显较少,ET+CA组十二指肠、空肠IEL较ET组数量较多。
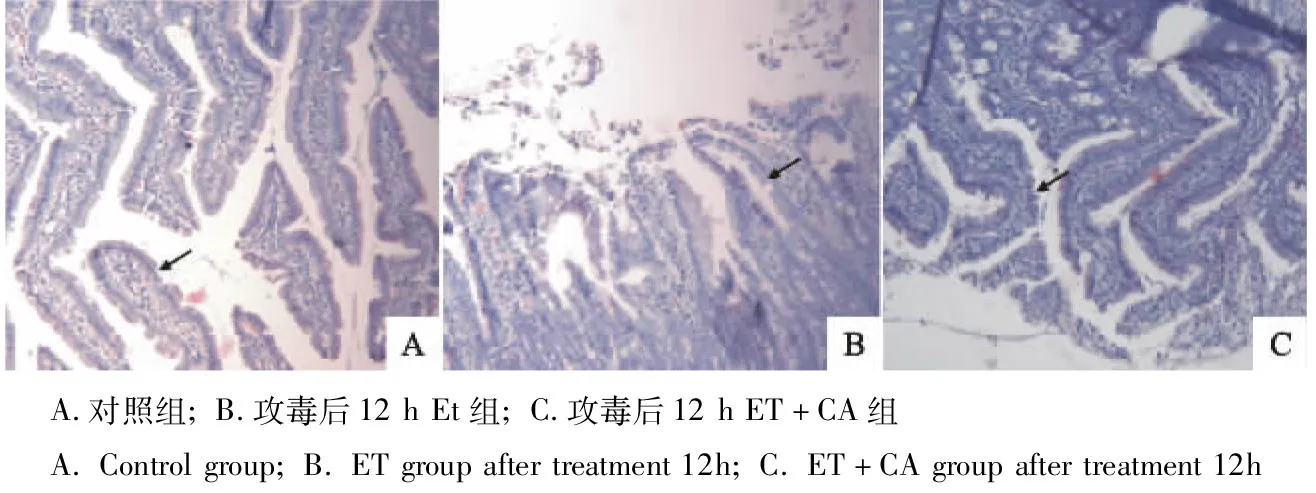
图1 十二指肠绒毛形态(100×)Fig.1 The morphology of the intestinal villi of the duodenum(100×)
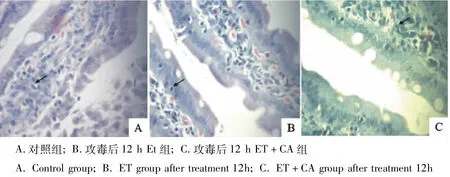
图2 十二指肠IEL的数量(400×)Fig.2 The quantity of IEL of the duodenum(400×)

图3 空肠IEL的数量(400×)Fig.3 The quantity of IEL of the jejunum(400×)
3 讨论
小肠绒毛长度是小肠消化吸收功能的重要指标。绒毛长度增加可使小肠吸收面积扩大,有利于营养物质的吸收。在指状肠绒毛中,其长度与上皮细胞数量呈显著相关。有研究表明营养缺乏可加速细胞凋亡及导致细胞坏死,且不利于组织再生,从而破坏小肠绒毛正常的组织结构,在小肠则会导致肠绒毛表面柱状细胞凋亡[4],坏死,脱落。从而破坏肠黏膜机械免疫屏障。本研究结果显示,ET致病组大鼠小肠黏膜发生一系列变化,表现为肠绒毛出现坏死、脱落,严重者可见大片黏膜的出血、坏死、脱落,相应固有层裸露;对照组十二指肠和空肠绒毛长度在3、4、8、12 h均显著高于ET致病组(P<0.01),表明ET能明显减小十二指肠和空肠的绒毛长度,从而导致机体营养不足,进而加速细胞坏死和凋亡,从而破坏十二指肠和空肠黏膜正常的上皮屏障。 CA保护组十二指肠绒毛长度在3、4、8、12 h均显著高于ET致病组(P<0.01);CA保护组空肠绒毛长度在3、4、8、12 h均显著高于ET致病组(P<0.01),则说明CA在体内能有效拮抗ET,保持小肠组织结构形态,增加十二指肠和空肠的绒毛长度,减少ET对小肠绒毛上皮的屏障损伤。
小肠之所以能选择性地吸收食物的营养成分,而阻止细菌毒素等抗原的进入,除了小肠绒毛和肠道黏膜上皮屏障的保护外,还与肠道免疫细胞的监视与识别有关[5]。目前发现,肠道有两种不同表型的淋巴细胞存在,即分散在上皮细胞层中的肠上皮内层淋巴细胞(intrepithelial lymphocytes, IEL)和位于疏松结缔组织的固有层淋巴细胞(propria lymphocytes, PL)[6]。IEL是一种黏膜免疫细胞,能抑制肠黏膜超敏反应,识别上皮细胞是否受细菌、病毒和毒素的破坏,并分泌细胞因子以发挥抗细菌、抗感染和抗局部癌变的作用。有文献报道,在上皮中,15%的细胞为淋巴细胞,是黏膜免疫系统中最先接触抗原的免疫活性细胞,它不但参与免疫反应,而且通过伪足与上皮细胞接触加速上皮细胞再生,所以IEL在肠道黏膜中起重要的免疫屏障作用[7-10]。本研究中ET致病组十二指肠和空肠黏膜IEL数量在8 h出现上升趋势,这可能是机体对ET等生物毒素免疫应答的结果,这与何亚男等[11]、李鹏等[12]的研究结果一致。但ET致病组十二指肠和空肠黏膜IEL数量在3、4、8、12 h均显著低于对照组(P<0.01),结果表明ET对十二指肠和空肠IEL的损害均十分明显,抑制小肠黏膜的超敏反应,使得IEL对抗细菌,抗感染的作用降低,从而达到破坏肠黏膜免疫屏障的目的。CA保护组十二指肠和空肠黏膜IEL数量在4、8、12 h均显著高于ET致病组(P<0.01),表明CA能够明显减少ET对十二指肠和空肠黏膜IEL的损害,从而提高十二指肠和空肠黏膜的免疫屏障功能。因此,ET对小肠绒毛长度和小肠绒毛上皮屏障正常结构的破坏,降低IEL的数量是ET对小肠黏膜损伤的重要机制之一,而CA在体内能够有效拮抗ET,对小肠黏膜组织的正常结构及功能起到一定的保护效应。
[1] 张顺财.内毒素基础与临床[M].北京:科学出版社,2003:1-15.
[2] Rietschel E T, Brade H. Bacteria endotoxins[J].Science,1992,267(2):26-33.
[3] David S A, Bechtel B, Annaiah C, et al. Interaction of cationic amphiphilic drugs with lipid A: implications for development of endotoxin antagonists[J].Biochim Biophys Acta,2008,12(2):167-170.
[4] 吴伟康.细胞凋亡与疾病.病理生理学[M].5版.北京:人民卫生出版社,2000:178-190.
[5] Goodyear A W, Kumar A, Dow S, et al. Optimization of murine small intestine leukocyte isolation for global immune phenotype analysis[J].J Immunol Meth,2014,405:97-108.
[6] Aust D E. Histopathology of microscopic colitis[J].Pathology,2012,33(2):221-224.
[7] Kojima S, Kawana K, Fujii T, et al. Characterization of gut-derived intraepithelial lymphocyte (IEL) residing in human papillomavirus (HPV)-infected intraepithelial neoplastic lesions[J].Am J Reprod Immunol,2011,66(5):435-443.
[8] Sun Q, Shang Y, She R, et al. Detection of intestinal intraepithelial lymphocytes, goblet cells and secretory IgA in the intestinal mucosa during Newcastle disease virus infection[J].Avian Pathol,2013,42(6):541-545.
[9] Torrallardona D I, Andres Elias N, Lopez Soria S, et al. Effect of feeding piglets with different extruded and nonextruded cereals on the gut mucosa and microbiota during the first postweaning week[J].J Anim Sci,2012,90(S4):7-9.
[10] 殷彦君,陈强普.肠道屏障的组成与结构[J].消化病诊断和治疗,2002,2(2):53-55.
[11] 何亚男.两种寡糖对大鼠肠黏膜结构及黏膜免疫相关细胞影响的研究[D].北京:中国农业大学,2006:6-10.
[12] 李 鹏,佘锐萍,吴 襟,等. GMOS对兔小肠黏膜结构及免疫相关细胞数量的影响[J].中国兽医杂志,2007,43(4):19-20.
Influence of Endotoxin on Small Intestinal Mucosa and Protective Effects of CA in Rats
YAN Yu-lin,GAO Hong,LU Qin,WANG Xiu-geng,ZHAO Ru,CHEN Ling
(CollegeofAnimalScienceandTechnology,YunnanAgriculturalUniversity,Kunming,Yunnan,650201,China)
This study was to explore the influence of endotoxin (ET) on small intestinal mucosa tissue and the protective effects of CA in rats. 72 SD rats were randomly divided into three groups:the control group, ET group and CA group, after appropriate treatment the duodenum, jejunum tissue were collected and tested at 3, 4, 8, 12 h. The pathological slices of above tissues were prepared and stained by H.E., then were analyzed by graphical analysis system. The length of the intestinal villi of the duodenum and jejunum in ET group were shorter than in control and CA group at 3, 4, 8, 12 h (P<0.01). The quantity of IEL in the duodenum and jejunum in ET group were less than that of control and CA group at 3, 4, 8, 12 h (P<0.01). The quantities of IEL in the duodenum and jejunum in CA group were more than that of ET group at 4, 8, 12 h (P<0.01). The results indicated that ET could destroy the normal structures of small intestine, reduce the length of the intestinal villi, and consequently affect the normal absorptive and immune function. However, CA has protective effects by significantly relieving the toxic effects of ET.
endotoxin;cation A;length of intestinal villus;intrepithelial lymphocyte;rat
2014-06-17
国家自然科学基金项目(30560113);云南省现代农业生猪产业技术体系建设项目(云财农[2010]119号);云南省高校科技创新团队支持计划资助项目(云教科[2011]14号)
严玉霖(1979-),男,四川攀枝花人,副教授,博士,主要从事畜禽传染病病理学研究。*
S852.3
:A
:1007-5038(2015)01-0053-04

