固相微萃取/气相色谱-质谱联用技术在有机磷酸三酯阻燃剂土壤吸附分析中的应用
郑春莉,冯珊珊,杜苗苗,齐月,Elke FRIES
(1.西安交通大学环境工程系,710049,西安;2.Federal Institute for Geosciences and Natural Resources, im Geozentrum Hannover, Hannover 30655, Germany)
固相微萃取/气相色谱-质谱联用技术在有机磷酸三酯阻燃剂土壤吸附分析中的应用
郑春莉1,冯珊珊1,杜苗苗1,齐月1,Elke FRIES2
(1.西安交通大学环境工程系,710049,西安;2.Federal Institute for Geosciences and Natural Resources, im Geozentrum Hannover, Hannover 30655, Germany)
以3种常用且极性相差较大的有机磷酸三酯阻燃剂(OPFRs)作为研究对象,采用固相微萃取/气相色谱-质谱(SPME/GC-MS)联用技术建立了一种适用于研究OPFRs土壤吸附的分析方法:优化固相微萃取的萃取条件——取样体积为7 mL,萃取时间为30 min,解吸温度和时间分别为270 ℃和5 min;分析测定过程中导致空白值升高的干扰因素;针对不同类型的土壤分别绘制标准曲线。利用已建立的SPME/GC-MS法对3种OPFRs在不同类型土壤中的吸附程度进行了初步评估,结果表明:3种OPFRs在试验土壤中的吸附率为27%~69%,吸附程度随着OPFRs极性的减弱以及土壤有机质含量的增加而增加。该方法具有操作简单,分析速度快,准确度、灵敏度和精密度均能满足定量测试要求,空白干扰小以及易于普及等特点。
固相微萃取;有机磷酸三酯阻燃剂;土壤;吸附
有机磷酸三酯阻燃剂(OPFRs)广泛用于塑料、纺织品、电子设备、家具和建筑材料等的生产中[1-2]。由于OPFRs主要以物理添加方式而非化学键合方式加入到材料里,因此在产品的制造和使用过程中易于散逸出来进入大气和水体,再通过降雪、降雨和灌溉等作用进入土壤[3-4]。Fries等人监测了OPFRs在土壤中的浓度分布[3],然而关于OPFRs的土壤吸附目前鲜有报道。由于有机污染物在土壤中的滞留程度将直接影响其在环境各圈层中的迁移、衰减、转化以及微生物降解等[5-6],因此研究OPFRs的土壤吸附是十分必要的,而首要任务是建立一套准确性高、重现性好、快速灵敏的分析方法。
通常样品前处理所需时间约占全部分析时间的60%~70%,前处理过程引入的误差约占整个误差的70%~80%[7-8],因此,样品前处理手段的好坏将直接影响整个分析方法的成败。液液萃取(LLE)、固相萃取(SPE)和固相微萃取(SPME)是目前较为常用的OPFRs提取与富集方法[1-2]。Andresen等人就7种OPFRs的分析比较了液液萃取和固相萃取,发现液液萃取回收率低、相对标准偏差高,且存在溶剂耗量大、处理时间长、样品易损失等缺点[1-2]。Rodriguez等人就8种OPFRs的分析对比了固相微萃取和固相萃取,发现相对标准偏差分别为3%~13%和1.9%~16.7%,方法检出限分别为10~25 ng·L-1和5~10 ng·L-1,表明固相微萃取和固相萃取的精密度和灵敏度较为接近,而与固相萃取相比,固相微萃取的突出优势在于避免了基质效应[2,9]。目前,通过固相微萃取与气相色谱-质谱(GC-MS)、气相色谱-氮磷检测器(GC-NPD)等技术联用,已监测了OPFRs在超纯水、河水、污水处理厂出水[9]以及雨水、雪水[4]和土壤提取液[3]中的浓度分布。
基于上述研究背景,本文采用固相微萃取/气相色谱-质谱(SPME/GC-MS)联用技术建立了一套适用于研究OPFRs土壤吸附的监测分析方法:选用3种使用较为普遍、极性相差较大的OPFRs——磷酸三丁酯(TnBP)、磷酸三(2-氯乙基)酯(TCEP)和磷酸三(丁氧基乙基)酯(TBEP)作为模式化合物;优化了固相微萃取的萃取条件;分析了OPFRs空白升高的主要因素;针对不同供试土壤分别绘制了OPFRs的标准曲线。该方法具有操作简单,分析速度快,准确度、灵敏度和精密度均能满足定量要求,空白干扰小以及易于普及等特点。
1 实验部分
1.1 试剂与仪器
试剂:磷酸三丁酯(TnBP,质量分数97%),磷酸三(2-氯乙基)酯(TCEP,质量分数97%),磷酸三(丁氧基乙基)酯(TBEP,质量分数94%),三异丙基磷酸酯(TiPP,质量分数97%,内标物),氯化钙(质量分数96%),均购自美国的Sigma-Aldrich公司;甲醇(质量分数99.90%),购自美国的Fisher Chemical公司;超纯水,由成都产CD-UPW-II型超纯水机制取。3种无菌标准土壤,分别命名为2.1、2.2和5M,均购自德国的LUFA Speyer公司,其物理化学属性见文献[10]。
仪器:Trace GC Ultra气相色谱-ISQ四极杆质谱联用仪(Thermo Fisher公司,美国);CombiPAL自动进样器(CTC Analytics公司,瑞士);二乙烯苯/碳分子筛/聚二甲基硅氧烷(DVB/CAR/PDMS)萃取头(50/30 μm,1 cm,Supelco公司,美国);10 mL顶空瓶(尤尼克普公司,北京);磁性螺旋盖(联合层析公司,台北);聚四氟乙烯硅胶垫片(安谱公司,上海)。
1.2 标准溶液配制
为研究有机污染物的土壤吸附,需先将有机污染物溶解在0.01 mol·L-1的CaCl2水溶液中,然后再与供试土壤充分混合[11]。因此,本文采用CaCl2(0.01 mol·L-1)水溶液进行OPFRs标准溶液的配制。
标准溶液1:将100 mL容量瓶置于电子天平上,加入10 mL甲醇,再加入10 μL TiPP,称量后用甲醇定容。内标物TiPP的质量浓度为116 mg·L-1。
标准溶液2:称取2.220 0 g CaCl2置于2 L容量瓶中,用超纯水定容,CaCl2溶液的浓度为0.01 mol·L-1。
标准溶液3:采用标准溶液2配制TnBP、TCEP和TBEP溶液,质量浓度分别为300、370和260 μg·L-1。
标准溶液4:采用标准溶液2配制质量浓度分别为10~150 μg·L-1和100~1 100 μg·L-1的TnBP、TCEP和TBEP溶液。
1.3 气相色谱-质谱条件
采用HP-5 ms超高惰性毛细管柱(30 m×0.25 mm×0.25 μm,美国Agilent Technologies公司);不分流进样模式;程序升温(初始温度50 ℃,停留2 min,以10 ℃·min-1升温至250 ℃,停留1 min,再以5 ℃·min-1升温至280 ℃,停留1 min);载气为He气,体积分数为99.99%,流速为1.0 L·min-1;质谱传输线温度为300 ℃;电离离子源为正电模式,离子源温度为300 ℃。
2 结果与讨论
2.1 质谱测定条件的优化
先于全扫描模式下得到内标物TiPP和3种OPFRs的总离子流色谱图,再通过MS谱库进行匹配度和图谱比较,在此基础上确定TiPP、TnBP、TCEP和TBEP的停留时间、定性离子和定量离子(见表1),最后进行选择离子模式(SIM)监测。

表1 4种OPFRs的定性离子和定量离子
与总离子流图(图1a)相比,SIM模式下获得的气相色谱图(图1b)杂质峰干扰明显减少,基线平稳,呈现出较高的灵敏度,适用于定量分析。
2.2 SPME萃取条件优化
2.2.1 萃取涂层和萃取模式 表2列出了TnBP、TCEP、TBEP和TiPP的物理化学性质。可以看出,这4种物质极性相差较大,沸点较高,难以挥发。因此,本文选用对极性和非极性化合物均具有较好吸附能力、材质为DVB/CAR/PDMS的萃取头[9],萃取模式为直接浸入式:将TnBP、TCEP、TBEP和TiPP溶液置于10 mL顶空瓶中,用磁性螺旋盖和聚四氟乙烯硅胶垫片密封,萃取头刺破垫片浸入溶液中,伸入长度为38 mm。在恒温振荡器中萃取:温度设定为40 ℃,这是该装置的最低设定值,因为温度越低,OPFRs在水溶液中的溶解度就越低,越有利于萃取;转速设为250 r/min,以加快传质[8]。萃取完毕后将萃取头送入气相色谱进样口进行热解吸,在SIM模式下采集数据。

(a)总离子流

(b)选择离子模式图1 内标物和3种OPFRs的气相色谱图

OPFRs分子式25℃溶解度*/g·L-1lgK*ow沸点*/℃TnBPC12H27O4P0.2804.00289TCEPC6H12Cl3O4P7.0001.44194TBEPC18H39O7P1.1003.75228TiPPC9H21O4P0.5002.12224
*:数据来源于http:∥www.srcinc.com/what-we-do/databaseforms.aspx?id=386。
2.2.2 样品体积 分别将不同体积的标准溶液3置于10 mL顶空瓶中,再加入10 μL标准溶液1,萃取时间为30 min。图2显示了内标物TiPP和3种OPFRs在不同样品体积时的色谱峰面积响应值,其中n为每个样品重复测定的次数。色谱峰面积响应值越大,表明固相微萃取效率越高。从图2中可以看出:对于TiPP、TnBP和TCEP,样品体积在7 mL时萃取量最大;对于TBEP,6 mL时的萃取量略高于7 mL时的萃取量。
图3给出了上述4种物质在不同样品体积时色谱峰面积的相对标准偏差(Drs),从中可以看出,对应于7 mL的样品体积,分析结果的相对标准偏差在1%~5%之间。综合考虑萃取效率和数据精度,本文以7 mL作为取样体积。

图2 样品体积对内标物和3种OPFRs萃取效率的影响(n=6)

图3 不同样品体积时色谱峰面积的相对标准偏差(n=6)
2.2.3 萃取时间 将7 mL标准溶液3置于10 mL顶空瓶中,加入10 μL标准溶液1,考察了萃取时间为20~60 min时的萃取量。图4显示:对于TiPP,30 min时萃取量最大;对于TnBP,60 min时萃取量最大,其次是30 min时;对于TCEP,60 min时萃取量最大,其次为50 min和30 min时;对于TBEP,萃取量随着萃取时间的延长而逐渐增大。由此可见,上述4种物质达到最大萃取量时所对应的萃取时间并不一致。为了统一确定最佳萃取时间,采用标准曲线法,即令TnBP、TCEP和TBEP的质量浓度在2个范围内变化,于不同萃取时间下建立3种OPFRs和内标物TiPP的峰面积比(y)与相应质量浓度(x)的线性关系式,结果分别见表3和表4。由表3和表4可以看出,当萃取时间为30 min时,所对应的标准曲线均具有最高的R2值。表5和表6分别给出了萃取时间为30 min、2个浓度范围内对应于每条标准曲线(见表3和表4)不同质量浓度点的相对标准偏差(n=6),数据结果具有较高的精度。结合R2和相对标准偏差,最佳萃取时间选为30 min。

图4 萃取时间对内标物和3种OPFRs 萃取效率的影响(n=6)
表3 OPFRs质量浓度为>150~1 100 μg·L-1不同萃取时间下OPFRs的线性关系式(n=6)

OPFRst/min线性关系式R220y=18.948x-0.6030.942530y=24.46x-3.4330.9855TnBP40y=19.59x+0.1750.965150y=46.038x-7.1120.953960y=55.418x-10.5960.901320y=0.9173x-0.2430.933730y=0.8519x-0.2040.9908TCEP40y=0.7944x-0.0870.951650y=2.8507x-0.6630.918560y=4.3113x-1.2500.868020y=5.8206x-1.5270.858630y=9.7959x-1.4500.9910TBEP40y=11.115x-1.0610.969550y=12.033x-3.7330.969660y=17.423x-6.2750.8982
2.2.4 解吸条件 通常固相微萃取采取不分流进样[2,9],因此应选用较高温度以缩短解吸时间,但为了延长涂层使用寿命,萃取温度不宜超过涂层最高允许温度[8],故本文选用SPME萃取头涂层材料的最高耐受温度280 ℃。将7 mL标准溶液3置于10 mL顶空瓶中,再加入10 μL标准溶液1,30 min后送入气相色谱进样口进行热解吸。图5显示了不同解吸条件下的萃取效率,可以看出在270 ℃-5 min时萃取量最大,相对标准偏差在1%到6%之间(见图6)。
表4 OPFRs质量浓度为10~150 μg·L-1不同 萃取时间下OPFRs的线性关系式(n=6)

OPFRst/min线性关系式R220y=0.0257x-0.0950.961430y=0.0259x-0.3640.9961TnBP40y=0.0247x+0.0700.977550y=0.038x-0.2090.922560y=0.0361x-0.1190.931420y=0.0004x+0.0050.867730y=0.0004x+0.0020.9956TCEP40y=0.0004x+0.0100.996750y=0.001x+0.0100.896960y=0.002x+0.0090.907620y=0.0013x-0.0220.888830y=0.002x-0.0250.9689TBEP*40y=0.0027x-0.0290.964150y=0.006x-0.1040.873160y=0.004x-0.0130.8929
表5 OPFRs质量浓度为10~150 μg·L-1萃取 30 min时线性关系式的相对标准偏差

TnBP TCEP TBEP ρ/μg·L-1Drs/%ρ/μg·L-1Drs/%ρ/μg·L-1Drs/%21.431.426.426.418.577.142.846.352.8422.837.141.564.2910.879.269.855.7111.285.726.5105.708.374.283.9107.155.8132.109.592.856.8
表6 OPFRs质量浓度为>150~1 100 μg·L-1萃取30 min时线性关系式的相对标准偏差

TnBP TCEP TBEP ρ/μg·L-1Drs/%ρ/μg·L-1Drs/%ρ/μg·L-1Drs/%214.318.9264.38.5185.710.3428.63.8528.68.0371.41.4642.90.6792.91.9557.14.9857.25.01057.05.4742.84.81071.54.21321.02.1928.53.4
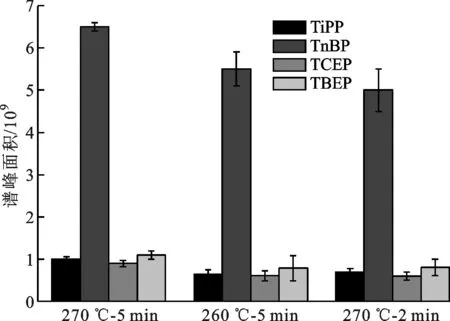
图5 解吸时间和温度对萃取效率的影响(n=6)

图6 270 ℃-5 min解吸时的谱峰面积相对标准偏差(n=6)
2.3 空白干扰消除
2.3.1 萃取头吹扫 萃取头热解吸后会有少量样品残留,影响下一次分析,因此在每一次热解吸后,萃取头需进入老化工作站进行氮气(体积分数为99.99%)吹扫以去除残留,然后再继续萃取下一个样品。本文考察了250 ℃-20 min和200 ℃-10 min两种吹扫条件下的清洗效果:将吹扫后的萃取头送入空置的10 mL顶空瓶中模拟萃取过程,30 min后在气相色谱进样口解吸,结果如图7所示。从图7可以看出,TiPP、TCEP和TnBP均未检出,而TBEP有微弱残留,这是由于密封SPME顶空瓶的聚四氟乙烯硅胶垫片中含有TBEP[9],在萃取头刺破垫片时引入了TBEP。为了降低空白干扰,所有实验均采用铝箔纸代替聚四氟乙烯硅胶垫片。为了延长萃取头的使用寿命,本文以200 ℃-10 min作为吹扫条件。
2.3.2 OPFRs标准溶液配制 准确称取2.220 0 g的CaCl2至2 L容量瓶中,分别采用超纯水和自来水定容,命名为空白A和空白B。分别将7 mL空白A和空白B置于10 mL顶空瓶中,再加入10 μL标准溶液1,萃取30 min。由表7可以看出,自来水中的TnBP含量远低于超纯水中,原因可能是超纯水制备机中的塑料组件含有TnBP,在制备过程中释放出来进入到超纯水中。因此,本文采用CaCl2/自来水代替CaCl2/超纯水进行TnBP、TCEP和TBEP标准溶液的配制。此外,连续一个月的监测显示,自来水的电导率稳定,所以采用自来水不会对分析结果造成影响。表7所示空白A和空白B中3种OPFRs的含量是通过其与内标物谱峰面积比的平均值表示的。

(a)200 ℃-10 min

(b)250 ℃-20 min图7 不同时间和温度下氮气吹扫对内标物和 3种OPFRs残留的影响

OPFRsy空白A空白BDrs/%空白A空白BTnBP11.8×10-34×10-411.08.8TCEP3.0×10-42×10-412.39.0TBEP1.0×10-53×10-510.25.6
2.4 检出限
以0.01 mol·L-1的CaCl2/自来水溶液配制低浓度的OPFRs标准溶液,用经过优化的分析条件进行萃取和测定,建立线性关系式并获得斜率。根据DIN32645标准计算检出限[3]
式中:Ds为空白B中TnBP、TCEP和TBEP与内标物TiPP峰面积比的标准偏差;m为线性关系式的斜率;t为T检验(自由度为5)的临界值;N′为每次测定的重复进样次数,在本文中为1;N为空白样品数目。当t为2.571时,TnBP、TCEP和TBEP的检出限分别为0.85、22.32和11.10 ng·L-1。
2.5 标准曲线
OPFRs在地下水、地表水及城市污水处理厂出水中的质量浓度基本在ng·L-1至μg·L-1水平之间[1-2]。曾祥英等人对中国太湖表层水中OPFRs的含量进行了研究,发现春季和夏季分别为216.5~6 016.0 ng·L-1和74.2~1 411.2 ng·L-1[12]。Meyer等人对德国某城市污水处理厂出水监测的OPFRs质量浓度为100 ng·L-1左右[13]。Fries等对德国部分地区的地下水进行监测,发现OPFRs质量浓度为17~1 510 ng·L-1[14]。因此,研究TnBP、TCEP和TBEP的土壤吸附时,其在水溶液中的初始浓度需与实际环境浓度接近。此外,在吸附实验过程中,供试土壤本身以及各操作步骤均有可能对分析结果造成干扰。基于上述考虑,本文采用以下方法进行标准曲线的绘制:将10 mL CaCl2/自来水溶液(0.01 mol·L-1)先与1.500 0 g供试土壤混合,在300 r/min、20 ℃下避光振荡24 h,再经5 000 r/min离心处理、0.45 μm滤膜过滤后,取7 mL滤液放入10 mL顶空瓶中,分别加入不同体积(1~7 μL)的标准溶液4配制成质量浓度范围为200到2 000 ng·L-1的OPFRs溶液(见表8),然后加入10 μL标准溶液1,用经过优化的分析条件进行萃取和测定。
由表8可以看出,3种供试土壤的标准曲线均具有较高的R2值和较低的相对标准偏差。由于每一种供试土壤都具有各自不同的物理化学属性,为了提高标准曲线的准确度和精密度,本文采用针对每一种土壤建立一条标准曲线的方法。
表8 3种土壤吸附OPFRs的标准曲线和 相对标准偏差(n=6)

OPFRs土壤标准曲线R2Drs/%2.1y=7×10-4x-0.09260.98015~17TnBP2.2y=1×10-6x-0.00070.98612~85My=3×10-6x-0.00040.98287~142.1y=8×10-4x-0.08490.97663~10TCEP2.2y=1×10-6x-0.00060.96603~135My=4×10-6x-0.0010.97552~82.1y=6×10-4x-0.15190.98606~12TBEP2.2y=2×10-6x-0.00090.98334~115My=5×10-6x-0.00090.98153~9
2.6 吸附
图8显示了24 h(平衡时间)后3种OPFRs在不同土壤中的吸附,其中TnBP的吸附率最高,其次为TBEP和TCEP,这正好与其lgKow的排序一致(见表2)。此外,由文献[10]可知,土壤2.2有机质含量最高,其次为5M和2.1。由于3种OPFRs在水溶液中的存在形态为中性分子,所以吸附率与土壤有机质含量正相关。当有机污染物在土壤中的吸附率不低于25%时,需进行吸附动力学、吸附等温和吸附热力学等方面的研究,如果吸附率低于25%,则认为该有机污染物在土壤中易于渗滤进入地下水或随径流排入地表水[12]。从图8可以看出,TnBP、TCEP和TBEP在3种供试土壤中的吸附率均高于25%,其中TnBP在土壤2.2中的吸附率高达69%,因此,后续有必要深入研究其土壤吸附行为。

图8 不同OPFRs在3种供试土壤中的吸附率(n=6)
3 结 论
(1)本文优化了固相微萃取的萃取条件:取样体积为7 mL,萃取时间为30 min,解吸温度和时间分别为270 ℃和5 min。
(2)通过3种手段可降低测定过程中OPFRs的空白干扰:①解吸后的纤维头于200 ℃下用氮气吹扫10 min;②用铝箔纸代替聚四氟乙烯硅胶垫片密封固相微萃取顶空瓶;③用自来水代替超纯水配制OPFRs标准溶液。
(3)针对不同类型的供试土壤分别建立了OPFRs的标准曲线,具有较高的准确度和精度。结果显示,TnBP、TBEP和TCEP在3种供试土壤中的吸附率为27%~69%,吸附程度随着3种OPFRs极性的减弱以及土壤有机质含量的增加而提高。
[1] QUINTANA I B, RODIL R, REEMTSMA T, et al. Organophosphorus flame retardants and plasticizers in water and air: Ⅱ Analytical methodology [J].Trends Anal Chem, 2008, 27(10): 904-915.
[2] VEEN I, BOER J. Phosphorus flame retardants: properties, production, environmental occurrence, toxicity and analysis [J]. Chemosphere, 2012, 88(20): 1119-1153.
[3] FRIES E, MIHAJLOVIC I, MILORADOV M V. Application of twisselmann extraction, SPME, and GC-MS to assess input sources for organophosphate esters into soil [J]. Environ Sci Technol, 2011, 45(6): 2264-2269.
[4] FRIES E, MIHAJLOVIC I. Atmospheric deposition of chlorinated organophosphorus flame retardants(OFR) onto soil [J]. Atmos Environ, 2012, 56(1): 177-183.
[5] STOOB K, SINGER H, MUELLER S R, et al. Dissipation and transport of veterinary sulfonamide antibiotics after manure application to grassland in a small catchment [J]. Environ Sci Technol, 2007, 41(21): 7349-7355.
[6] HEUER H, FOCKS A, LAMSHÖFT M, et al. Fate of sulfadiazine administered to pigs and its quantitative effect on the dynamics of bacterial resistance genes in manure and manured soil [J]. Soil Biol Biochem, 2008, 40(6): 1892-1990.
[7] VAS G, VÉKEY K. Solid-phase microextraction: a powerful sample preparation tool prior to mass spectrometric analysis [J]. J Mass Spectrom, 2004, 39(3): 233-254.
[8] 吴采樱. 固相微萃取 [M]. 北京: 化学工业出版社, 2012.
[9] RODRIGUEZ I, CALVO F, QUINTANA J B, et al. Suitability of solid-phase microextraction for the determination of organophosphate flame retardants and plasticizers in water samples [J]. J Chromatogr: A, 2006, 1108(1): 158-165.
[10]ZHENG C L, FOCKS A, ELLEBRAKE K, et al. Sorption of ortho-phenylphenol to soils [J]. Clean-Soil, Air, Water, 2011, 39(2): 116-120.
[11]OECD. Guidelines for testing of chemicals [M]. Paris, France: Organization for Economic Co-operation and Development, 2000: 1-45.
[12]曾祥英, 何丽熊, 宋寒, 等. 太湖表层水中有机磷酸酯阻燃剂/增塑剂含量与分布 [C]∥2013中国环境科学学术年会论文集. 北京: 中国环境科学学会, 2013: 12-14.
[13]MEYER J, BESTER K J. Organophosphate flame retardants and plasticisers in wastewater treatment plants [J]. J Environ Monit, 2004, 6(7): 599-605.
[14]FRIES E, WILHELM P. Occurrence of organophosphate esters in surface water and groundwater in Germany [J]. J Environ Monit, 2001, 3(6): 621-626.
(编辑 葛赵青)
SPME/GC-MS for Studying Adsorption of Organophosphate Flame Retardants on Soils
ZHENG Chunli1,FENG Shanshan1,DU Miaomiao1,QI Yue1,Elke FRIES2
(1. Department of Environmental Science and Engineering, Xi’ an Jiaotong University, Xi’an 710049, China;2. Federal Institute for Geosciences and Natural Resources, im Geozentrum Hannover, Hannover 30655, Germany)
Three kinds of commonly used organophosphate flame retardants (OPFRs) with different polarities were selected as the research object in this study. Solid phase microextraction coupled with gas chromatography-mass spectrometry (SPME/GC-MS) was adopted to develop an analytical method to study the adsorption performance of OPFRs in soils. The SPME conditions, such as extraction time, sampling volume, desorption time and desorption temperature, were optimized. The interference factors leading to the increase of blank values were determined. Different calibration curves of OPFRs were established for each tested soil sample. Based on the SPME/GC-MS method, the adsorption performance of three OPFRs in different soils was preliminarily investigated. The results showed that the adsorption rate of three OPFRs in the tested soils ranged from 27%-69%, and the adsorption rate increased with the decrease in OPFRs’ polarity and the increase in the organic matter content in the tested soils. The analytical method developed in this study is easy to operate with quick speed, high accuracy and sensitivity for quantitative test of OPFRs. In addition, this method has little blank interference, and is easy to be popularized.
solid phase microextraction; organophosphate flame retardant; soil; adsorption
2015-05-18。作者简介:郑春莉(1976—),女,博士,讲师。基金项目:国家自然科学基金资助项目(21307097);陕西省工业攻关资助项目(2014K10-02);中央高校基本科研业务费专项资金资助项目(2012jdhz39)。
时间:2015-08-26
10.7652/xjtuxb201511021
O641;O647
A
0253-987X(2015)11-0128-07
网络出版地址:http:∥www.cnki.net/kcms/detail/61.1069.T.20150826.1117.008.html

