碳点的制备与应用研究进展
王林鹏,马玉洁,周学华,刘 云,武瑞东
(1山东大学 环境研究院,济南250100;2中国科学院 理化技术研究所,北京100190)
碳点的制备与应用研究进展
王林鹏1,马玉洁1,周学华1,刘 云2,武瑞东1
(1山东大学 环境研究院,济南250100;2中国科学院 理化技术研究所,北京100190)
综述了碳点的制备、发光原理以及应用的研究进展,重点介绍了碳点制备方法,讨论了自上而下法中电弧放电、激光消融和电化学氧化法以及自下而上法中燃烧法、模板法、水热法及热解法等制备碳点的优缺点、荧光量子产率以及研究趋势;指出未来研究中, 需进一步优化碳点合成及修饰方法,深入探究碳点发光机理,提高碳点荧光量子产率;而制备能精确、灵敏、快速且易于检测荧光信号的碳点是其在应用中为各种化学检测及分析提供新技术和新方法的关键。
碳点;制备;应用
碳点是一种尺寸小于10nm的分散的类球形荧光碳纳米颗粒。2004年,Scrivens组的研究人员利用电泳纯化由电弧放电法制备单壁碳纳米管时,首次得到发光碳点[1]。碳点作为一种新型发光材料,一经发现,就引起了人们极大的研究兴趣[2]。目前,碳点因发光范围可调、双光子吸收截面大、光稳定性好、易于功能化、无毒和生物相容性好等优点,在生物成像和标记、分析检测、光电转换以及催化等领域表现出良好的应用前景。这也使碳点成为传统半导体量子点的理想替代者。本文主要总结了近年来碳点的合成方法,并对碳点及其复合材料在灵敏检测、化学分析、光催化及生物医学等方面的应用进行了综述。
1 碳点的制备
近年来,随着人们对碳点优异性能的逐步认识,提出了一系列制备性能优良碳点的方法。这些方法可以概括为两大类:自上而下法和自下而上法[3]。
1.1 自上而下合成法
自上而下法是通过各种途径将大的碳材料剥离成小的碳颗粒,然后对颗粒表面进一步修饰来提高其发光效率的方法,主要包括电弧放电[1]、激光消融[4-7]、电化学氧化法[8-13]等(见表1)。所得碳点主要是石墨类型,荧光量子产率通常低于10%。
1.1.1 电弧放电法
电弧放电法是最初发现荧光碳点的方法。2004年,Xu等[1]在用凝胶电泳法分离电弧放电制备的碳纳米管时发现了碳点。实验中,他们首先对电弧放电烟灰进行浓硝酸氧化和氢氧化钠水溶液萃取,得到单壁碳纳米管悬浮液。对悬浮液通过凝胶电泳法分离后,获得的产物除了单壁碳纳米管和短的碳纳米管,还意外得到具有荧光的混合物。对该混合物进一步分离,得到在366nm激发光下分别发蓝绿色、黄色和橘红色三种荧光的纳米颗粒。傅里叶红外光谱表明碳点表面存在大量羧基。元素分析证明碳点主要含碳和氧,各元素的质量分数分别为C 53.93%,H 2.56%,N 1.20% 和 O 40.33%。后来,Bottini等[17]发现,在用硝酸氧化处理电弧制备的单壁碳纳米管悬浮液时,可获得发射从蓝色到黄绿色荧光的碳纳米颗粒,其荧光峰随碳颗粒分子量的增加逐渐红移。电弧放电法制备碳点过程中,颗粒来源于成分复杂、杂质较多的电弧放电灰,难于纯化提取,碳点产率很低,荧光量子产率也较低;但制备的碳点粒径小,含氧量大,无须进行表面修饰就能发出荧光。

表1 自上而下合成碳点的方法
1.1.2 激光消融法
2006年,Sun等[4]将氩气和水蒸气作为载气,用Nd:YAG固体激光器轰击石墨靶,得到无荧光的碳纳米颗粒;浓硝酸氧化后,仍无荧光;再用氨基化的聚乙二醇(Poly-(ethylene glycol),PEG1500N)进一步钝化颗粒表面,得到粒径为5nm、发光效率为4%~10%的具有强荧光的碳纳米颗粒,并首次命名为碳点。该碳点发射的荧光随激发光波长增加从蓝色移动到红色,后来的研究发现,很多碳点均具有该特征[9,10,18-22]。另外,Yang等[7]采用同一方法,用13C 粉末做碳源,通过优化实验参数使量子产率达到20%。Hu 等[6]对Sun的合成步骤进行简化,将激光消融和钝化结合成一步,只改变有机溶剂(聚乙二醇(PEG200N)、水合肼或二乙醇胺)就制备出不同表面包覆情况、具有不同荧光发射波长的碳点(图1)。2011年,Li等[15]将激光消融法进一歩简化,用激光直接照射分散于常见溶剂(例如乙醇或丙酮)中的商业化的纳米级碳粉,无需钝化剂直接制备出一种外壳为无定形、内部类似石墨层的核-壳结构的荧光碳点。用激光消融法制备碳点通常需要激光辐射、氧化以及钝化过程,后两个步骤在后来的制备中逐渐简化。利用该方法制得的碳点产率较低;另外,所得碳点的粒径也不均匀,纯度较低。

图1 在聚乙二醇溶液中一步法合成碳点的示意图[6]Fig.1 Schematic map of the one-step synthesis of C-dots in PEG200N solvent[6]
1.1.3 电化学合成法
电化学合成法是通过电解碳材料,如碳纳米管、石墨等来获得水溶性碳点的一种方法。由表1可知,在该方法中,无需进行表面修饰,就能获得荧光碳点。2007年,Zhou等[10]首次利用多壁碳纳米管作工作电极,银/高氯酸银作参比电极,以含有0.1mol/L四丁基高氯酸铵(Tetrabutylammonium Perchlorate,TBAP)的乙腈溶液作为支持电解质,通过循环伏安法处理工作电极,得到粒径约为2.8nm、量子产率为6.4%的碳点。拉曼光谱显示该碳点既有sp2碳,又有不规则碳,晶格结构同石墨类似。研究显示,实验中碳点是在电压循环过程中四丁基铵离子插入到多壁碳纳米管的缺陷处剥离下产生的。2011年,Bao等[16]在相似的实验中发现,通过提高反应电势,制备的碳点粒径逐渐减小,表面氧化程度逐渐增加,荧光发射峰位逐渐红移。遗憾的是,这些电化学制备碳点的方法不能在水溶液体系中进行。2008年,Zhao等[11]用石墨棒作为工作电极,饱和甘汞作为参比电极,铂线作为对电极,0.1mol/L NaH2PO4作为电解质溶液,以3V的电压氧化工作电极石墨,得到粒径为1.9nm发蓝色荧光和3.2nm发黄色荧光的碳点,实现了水溶液中电化学方法制备碳点。高分辨透射电子显微镜(HRTEM)显示,所得碳点具有与石墨相同的结构特征。随后,Zheng等[12]、Li等[8]以及Ming等[9]均通过电化学方法在水溶液体系中获得荧光碳点。在研究过程中,人们发现碱性条件,即大量OH-的存在,是电化学氧化形成碳点的重要条件[8]。值得一提的是,Ming等[9]在纯水中通过电化学方法制备出具有高纯度、高结晶度和上转换性能的碳点[9],为大规模合成碳点提供了新途径。此外,近年来,一些研究者将离子液体(如,[bmim][BF4])作为电解液,通过调节离子液体与水的比例,制备出发射峰可从紫外到可见光区调控(400~600nm)的碳点,但其荧光量子产率仍较低(2.8%~5.2%)[13]。电化学法制备碳点的优势在于通过调整电极电势与电流密度来精确控制纳米颗粒的合成;另外,制备过程中成本低、易操作、产量高。
1.2 自下而上合成法
与自上而下法通常将大颗粒减小不同,自下而上制备碳点的方法倾向于由小变大,大多为化学合成法,主要包括燃烧法[18, 23-25]、模板法[26-28]、水热法[19-21,29,30]、有机物热分解[31,32]及其他一些方法(见表2)。这些方法相对简单,所得碳点一般为无定形结构,大部分量子效率较低,但有些碳点的发光效率可与传统的半导体量子点相当或相媲美。
1.2.1 燃烧法
燃烧法是制备碳点较常用的一种方法。该法原料简单,主要包括蜡烛灰、天然气灰、石蜡油灰等。2007年,Liu等[23]首次报道利用燃烧蜡烛灰法制备碳点。实验中,他们用铝箔收集不完全燃烧产生的蜡烛灰,将其放入5mol/L 的硝酸溶液中回流,经过离心、调至中性、透析等最终获得分散性较好的发光碳点。将这些碳点在聚丙烯酰胺凝胶内进行电泳分离,根据在电泳中移动的快慢,得到粒径约为1nm、在315nm激发光下发射波长逐渐红移的九种碳点。这一特征为碳点对多种标记物的同时检测带来了希望。值得注意的是,该方法制备的碳点量子产率仅为0.8%~1.9%。2009年,Ray等[24]在合成中采用丙酮和水的混合溶剂来分离纯化碳点这一更简单的方法,获得在水与乙醇中分散性较好、但在氯仿中分散性较差的石墨结构的碳点。此后,Tian等[25]、Vinci等[18]以及Li等[33]分别收集天然气、石蜡油以及秸秆等燃烧产生的灰,经过硝酸氧化后获得荧光碳点。采用燃烧法制备碳点通常需要经过氧化性酸处理,这一过程有三个作用:一是打破碳点的聚集使其成为小的纳米颗粒,二是使碳纳米颗粒可溶于水,三是影响碳颗粒的荧光性质[23]。制得的碳点无需表面钝化就能发射荧光,但碳点的荧光量子产率较低(<3%)。
1.2.2 模板法
通过高温处理有机物制备碳点时,经常遇到的问题是碳纳米颗粒的团聚。模板法能有效阻止颗粒团聚并控制碳点的尺寸。2009年,Liu等[26]提出模板合成碳点的方法。他们利用两性聚合物F127(EO106PO70EO106,Mw=12600; EO=环氧乙烷,PO=环氧丙烷)对硅胶球体功能化,以可溶性酚醛树脂 (Resols,苯酚/甲醛树脂,Mw<500) 为碳源,制备出球形聚合物/F127/二氧化硅复合物,经高温处理并用氢氧化钠溶液除去硅载体后,再经过酸处理和表面钝化,得到粒径为1.5~2.5nm、量子产率为14.7%的无定形水溶性碳点。此外, Bourlinos等[27]通过热氧化2,4-二氨基苯酚交换过的NaY沸石以及刻蚀除去沸石模板;Zong等[28]将二氧化硅球浸入柠檬酸和NaCl/LiCl/KNO3溶液中,经过超声、煅烧、NaOH刻蚀并透析后均获得荧光碳点。模板法合成碳点的基本步骤如下: 首先在模板上合成碳点,然后用酸(或碱)刻蚀等手段除去模板。其优势在于,模板在合成中起固定作用,可控制碳点大小、减少碳点团聚;所得碳点粒径均匀,纯度较高,便于后期的表面修饰;碳点的荧光量子产率也较高。其缺点为:模板与碳点分离较难,模板除去时可能影响碳点的纯度、粒径和发光性能;碳点产率较低,不适合碳点的大规模制备。
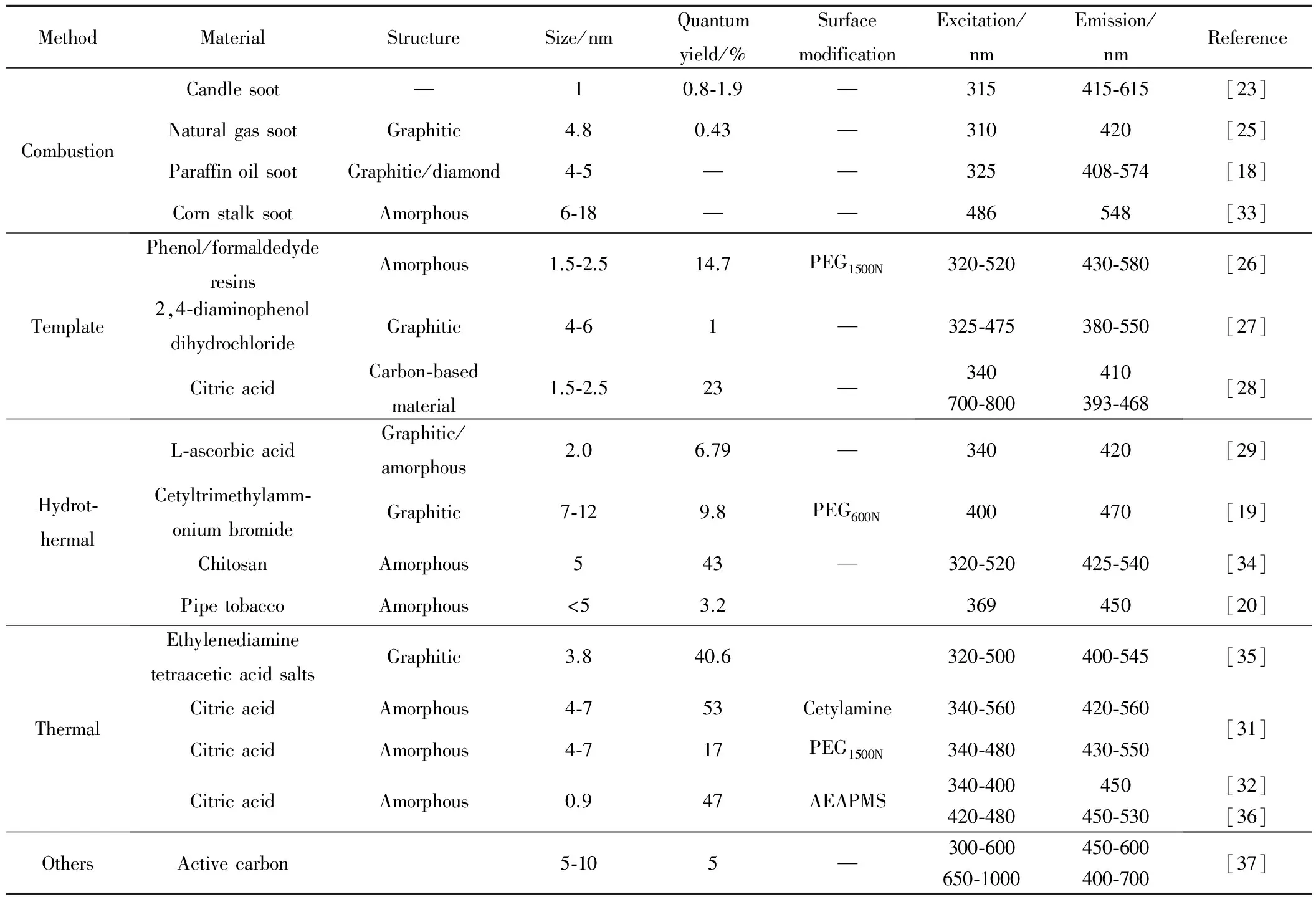
表2 自下而上合成碳点的方法
1.2.3 水热法
水热法是本实验室首先提出的一种便捷的将碳源与水在高压釜中混合加热来制备水溶性碳点的方法。2010年,本实验室的Zhang等[29]首次报道通过一步水热法获得碳点。实验中,将抗坏血酸溶于去离子水中,然后加入乙醇溶液,在180℃高压釜中反应4h,用二氯甲烷萃取后,经过纤维素脂透析膜透析得到错乱的石墨和无定形结构相结合的直径约为2nm的碳点。该碳点的荧光量子产率为6.79%。用水或其他溶剂取代乙醇,制得的碳点荧光量子产率低(2%)表明,溶剂乙醇在荧光碳点的形成中发挥了重要作用。在此基础上,Li等[30]制备出荧光强度随SiO2层厚度增加而增强的Ag/SiO2/碳点的纳米复合材料。另外, Liu等[19]改变碳源,采用十六烷基三甲基溴化铵(CTAB)与Na2S2O8和HCl的水溶液通过水热法获得粒径7~12nm 的表面被羧基和羟基修饰的石墨化碳点。该碳点被PEG600N进一步修饰后,荧光量子产率可达9.8%。此外,其他研究者,如,Yang等[34]、Sha等[20]以及Liu等[21]分别将壳聚糖、烟丝以及禾本植物作为碳源,在高压釜中制备出荧光碳点。通过水热法所得碳点的粒径随反应温度的提高而减小,量子产率则随温度的提高而增加[21]。该法制备碳点的优势在于通过选择不同碳源,制备过程中无需对碳点进一步氧化和钝化就能在反应釜中一步获得具有高荧光量子产率的碳点,制备方法相对简单且易于控制,适合工业生产;另外,密闭的反应釜可用于对空气敏感的前驱体,并可防止实验中有毒物质的挥发。
1.2.4 热解法
热解法主要以有机物为碳源,利用有机物在高温下热解炭化形成碳点。2010年,本实验室的Wang等[31]以十八烯为溶剂,十六胺为表面钝化剂,在300℃热解柠檬酸,一步获得粒径为4~7nm、可溶于油的无定形碳点,其荧光量子产率为53%。另外,他们以PEG1500N为钝化剂,甘油为溶剂,在270℃热解柠檬酸得到粒径同样为4~7nm、荧光量子产率为17%的可溶于水的球形碳点。此外,Wang等[32]和Xie等[36]利用有机硅烷为偶联剂和功能化试剂,热解有机硅烷和有机酸混合物,一步获得硅烷功能化的无定形碳点,其大小约为0.9nm,荧光量子产率为47%。除了以柠檬酸等有机酸为碳源,2012年,Liu等[22]在浓硫酸中140℃热解乙二醇,一步获得粒径为1~4nm、荧光量子产率为25%的石墨化的碳点(GCDs)。将热解温度从140℃降至80℃后,荧光量子产率提升到高达62.9%[38]。该法制备的碳点在可见光区域具有较宽的吸收带,另外,它还具有大的摩尔消光系数,是较好的太阳光吸收材料。除了上述的研究,Pan等[35]通过热解二乙胺四乙酸盐获得尺寸在3.8nm左右的石墨结构的碳点,其量子产率可达40.6%。
热解法制备碳点碳源广泛,可通过控制分解程度得到具有不同性质的碳点,制备方法简单、实用且可重复性强;所得碳点荧光量子产率高。目前对该方法的研究重点是对不同碳源的尝试和选择,寻找廉价且能合成性质优良碳点的碳前驱体。
1.2.5 其他方法
除了上述方法,碳点的制备方法还包括微波法和超声法等。2009年,Zhu等[39]采用微波法,通过改变微波处理时间,得到不同尺寸和不同发光性能的无定形产物。Wang等[40]将抗坏血酸溶于超纯水中,加入聚乙二醇-200后搅拌30min,然后微波反应几分钟得到荧光碳点。这一方法简单环保,但制备的碳点量子产率较低(1%~1.25%)。2011年,Wang等[41]将氧化石墨加入到硝酸溶液中,使用微波水热的方法制备出粒径为4nm的碳点,虽然量子效率比单独用浓硝酸氧化法、微波辅助的浓硝酸氧化法要高一些,但也只有2.72%。Li等[37]用超声活性炭和过氧化氢的混合溶液制备出单分散的水溶性碳点,获得的碳点能发出覆盖可见及红外区范围的荧光,并具有上转换性能。
2 碳点的发光机理
实验中,由于原料不同,实验方案不同,合成碳点的光学性能也有较大差别。通常,碳点主要在270~280nm[10,21,22,29,30,33,39],300~320nm[34,35,38,41,42]和350~360nm[31,32,43]紫外区有吸收,吸收峰会拖尾至可见光区。还有一些碳点没有明显的吸收峰,吸收图谱只是一条坡状曲线[4,24-26]。
碳点与量子点类似,带隙也在可见光范围[44],因而具有光致发光现象(见图2)。碳点的光致发光是其最有优势的性质之一。然而,由于碳点结构复杂,表面态并不清楚,目前,其发光机理并没有定论,可能的解释有三种:一是由Bourlinos等[43]提出的,碳点发光是由于出现多种芳香化合物造成的[45],这一理论主要针对热分解有机物得到的碳点。Bourlinos等认为有机物热分解过程中出现碳原子重新组合,形成与石墨氧化物或具有碳氧结构的褐煤、煤炭和腐殖质物质结构类似的多环芳香化合物,引起发光。这一推论的主要依据是,固体核磁检测碳水化合物热分解产物时发现,60%的碳具有呋喃类型结构[46]。另一种解释是,碳点能够发出不同波长的光是由其不同粒径引起的。其依据是,Zhao等[11]用透析袋分离电化学氧化石墨制得的碳点,获得两种粒径颗粒,两种粒径碳点的不同的发射峰位置均不随激发波长移动而移动。Li等[8]通过碱辅助电化学方法制备出粒径为1.2~3.8nm的碳点,也具有尺寸依赖的发光性能。第三种是Sun等[47]提出的,碳点发光是由于碳点表面存在能量陷阱,表面修饰后即可发光。这与修饰后的碳纳米管发光相类似[48]。这些发光能量陷阱具有量子限域作用,即与尺寸有关,这种理论在解释Si纳米颗粒发光时得到了人们的普遍认可[49]。虽然目前已有不同理论解释碳点的光致发光,但由于没有得到实质性数据,各种理论还存在争议,尚需更深入的研究和更核心的理论的提出。

图2 碳纳米晶体的光致发光和电化学发光机理[12]Fig.2 Schematic illustration of the PL and ECL mechanisms in CNCs [12]
碳点的荧光量子产率与传统的半导体量子点相比较低(大部分都小于15%),这与碳点的制备方法和表面化学性质有关。表面钝化后的碳点的荧光量子产率通常会明显提高,研究显示,钝化前无荧光,PEG1500N钝化后荧光达到4%~10%[4]。当前,典型的钝化剂是末端为氨基的试剂,如乙醇胺,PEG1500N等[4,7,16]。此外,不同的钝化剂修饰同一碳点,获得的结果也不同。如以激光消融法制得的碳点,以PPEI-EI为钝化剂,碳点的荧光量子产率明显低于用 PEG1500N钝化[4]。以糖类脱水炭化方法制备碳点,在不同的钝化剂中,TTDDA表面钝化后的碳点量子产率最高(13%)[50]。
除了光致发光,与半导体纳米晶相似,碳点也有较好的电致发光性质[12,39]。碳点的电致发光的发射不受粒子尺寸和修饰试剂的影响而更多取决于其表面态[39],其机理如图2所示:在循环电压下,碳点形成带有正电荷的氧化态(R·+)和带有负电荷的还原态(R·-),这两种带有相反电荷的碳点发生电子转移湮灭,形成激发态碳点(R*),激发态碳点通过发射一个光子回到基态,形成电致发光。碳点的电致发光为其在显示器方面的应用带来了希望。
3 碳点及碳点复合材料的应用
相对于传统的半导体量子点和有机染料,碳点不仅保持了碳材料无毒、生物相容性好等优点,而且拥有发光范围可调、双光子吸收截面大、光稳定性好、无光闪烁、易于功能化、价廉、容易大规模合成等优势,因而具有重要的应用价值。
3.1 灵敏检测与化学分析
碳点的发光性质与表面结构有关,碳点与待测物相互作用时,表面电子空穴对的复合效率改变,因而导致碳点荧光增强或猝灭,从而实现对待测物的定性和定量分析。
3.1.1 pH检测
2008年,Zhao等指出,利用电化学氧化多壁碳纳米管制备碳点的荧光强度与溶液的pH值密切相关[11]。Pan等发现热分解乙二胺四乙酸二钠盐得到的碳点的吸收强度和荧光强度对pH值非常敏感[35]。当pH值从13降至1时,荧光峰的位置和相应的吸收峰位置会逐渐红移;当pH值从1恢复到13时,荧光峰和吸收峰也会随着恢复。
3.1.2 阳离子检测
碳点作为一种新型的阳离子荧光探针,在溶液中易被电子受体高效猝灭,据此能够有效地检测溶液中阳离子。另外,表面修饰后的碳点能在复杂环境中对特定离子进行特异性检测, 从而能在一定范围内确定待测离子的浓度,然后进行痕量分析[51]。
2010年,Goncalves 等[52]通过激光消融目标碳,经过PEG200N和N-乙酰半胱氨酸修饰后得到的荧光碳点,由于N-乙酰半胱氨酸可以与汞离子相互作用,因此修饰后的碳点可以检测汞离子。随后他们又将包覆后的碳点用溶胶-凝胶法制成薄膜材料,对汞离子也有很好的响应[53]。本实验室用浓硫酸在140℃炭化乙二醇制备的水溶性石墨化碳点也可以高选择性和灵敏性地检测Hg2+[15]。
Liu等[21]用水热法制备出N掺杂的聚合物碳点(PPNDs),相比其他离子,PPNDs 中的氮和氧与铜离子有更高的亲和力及更快的螯合速度,导致碳点荧光猝灭,因而可用于水样中铜离子的检测。Zhu等[54]将对Cu2+敏感的AE-TPEA(N-(2-aminoethyl)-N,N,N′tris(pyridin-2-ylmethyl)ethane-1,2-diamine)加入含有碳点及CdSe/ZnS量子点的混合体系,制备出同时发射蓝色荧光和红色荧光的双发射CdSe@C-TPEA荧光探针。在该体系中, AE-TPEA功能化碳点的蓝色荧光能被Cu2+猝灭,体系中CdSe@SiO2的红色荧光不受影响,通过两种荧光在不同Cu2+浓度下的不同强度比值,成功用于细胞内铜离子的检测及成像。Shao等[55]和Liu等[56]分别通过碳点表面的TPEA和BSA-赖氨酸与Cu2+的相互作用,使用制备的C-Dot-TPEA杂化纳米复合材料电极和CD-BSA-赖氨酸荧光探针分别检测正常大鼠脑组织中的Cu2+以及头发和自来水样品中的Cu2+。另外,Salinas-Castillo[57]小组在聚乙烯亚胺存在下,通过热分解柠檬酸得到的碳点可用于细胞内Cu2+的检测。
除了Hg2+和Cu2+, Qu等[58]利用水热法处理多巴胺(DA)得到对Fe3+有特异性识别功能的碳点。该碳点表面含有独特的邻苯二酚基团可特异性识别Fe3+,引起碳点荧光猝灭。DA与Fe3+的结合能力强于碳点,在碳点-Fe3+体系中加入DA后,碳点荧光恢复,形成用于检测DA的“off-on”型荧光探针。 Liu等[59]在碱性条件下,用蜡烛灰经水热反应制备出表面具有大量烃基、可检测Cr3+的碳点。除了过渡金属,Wei等[60]制备的乙二胺功能化的碳点,利用18-冠-6对一级胺的强键合力作用,与18-冠-6修饰的石墨烯之间发生荧光共振能量转移(Fluorescence Resonance Energy Transfer, FRET),导致碳点荧光猝灭。加入K+后,利用18-冠-6对K+的选择性,阻止FRET进行,使碳点荧光恢复,以此来检测K+。此外,Fang等[61]研究了Al3+与其合成的表面羟基化荧光碳点的相互作用:低浓度的Al3+能使此碳点荧光猝灭,随着浓度增大,被猝灭的碳点的荧光逐渐恢复。该作用对进一步研究碳点的光学性质与应用均有重要价值。
3.1.3 阴离子检测


图3 检测F-的荧光探针示意图[63]Fig.3 A schematic illustration of the designed fluorescent probe for F- detection[63]
3.1.4 生物分子的检测
除了对上述物种的检测,碳点对生物分子的检测为其在医药方面的应用迈出了关键一步。Bai等[64]首次通过加入DNA移走吸附在碳点上的亚甲基蓝,使由于亚甲基蓝吸附导致荧光猝灭的碳点又发出荧光,使碳点在DNA检测上的应用取得了很好效果。
Mao等以柠檬酸和N-(β-氨乙基)-γ-氨基丙基甲基二甲氧基硅烷为原料制得碳点,然后将其固定在能识别DA的分子印迹聚合物(MIP)上,得到具有高耐光性和模板选择性的复合材料CDs@MIP[65]。该探针已成功用于测定人尿样品中痕量DA。Wang等[66]将儿茶素与氧化石墨烯(GO)混合进行水热处理,得到高度稳定的碳点-氧化石墨烯(CDs@RGO),其荧光可被H2O2产生的活性氧自由基猝灭。乙酞胆碱酯酶(AChE)可以将乙酞胆碱(ACh)转化为胆碱,胆碱又能被胆碱氧化酶(ChOx)氧化产生甜菜碱和H2O2,从而引起CDs@RGO荧光猝灭。根据这一特性,他们利用CDs @RGO/ AChE / ChOx体系来检测ACh,检测限为30pmol/L。这一方法已成功用于检测血浆和血液样品中乙酞胆碱含量。
3.1.5 其他分子的检测

3.2 光催化应用
光催化氧化还原反应技术在新能源、绿色化学及环境领域有重要的应用前景。与其他纳米材料相比,碳点以其优异的物理化学性能(如光诱导电子转移[70]、氧化还原性、可见光吸收)、低制备成本、无毒害且环境友好等特点表现出较好的应用前景[8]。
2011年,Cao等[71]制备了金或铂碳点复合物,并将其用于二氧化碳转化为烃类有机物的研究(见图4)。对于光催化过程,Cao提出这样的假设,表面改性后的碳点在可见光激发下产生电子空穴对,一部分电子空穴对以辐射复合的形式消失,另一部分由碳点表面缺陷捕获分离,并转移到贵金属上。电荷转移一直到贵金属/碳点的费米能级与碳点的费米能级相等后,贵金属会释放储存的电子到溶液中,电子与溶解氧反应生成氧自由基,空穴与水反应生成羟基自由基,这些自由基随后将有机物降解。实验证实,该材料是一种有效的可见光(占太阳光能量的43%)转化二氧化碳和光解水制氢材料。

图4 金属-碳点复合材料可见光催化二氧化碳还原反应示意图[71]Fig.4 A schematic illustration of CDs coated with metal catalyzing CO2 under visible light[71]
此外,碳点复合材料还具有较好的光催化降解污染物的性能。与传统的光催化材料(如二氧化钛)和传统的半导体量子点等具有过宽的带隙仅仅只能吸收紫外光或者近紫外光相比,碳点具有上转换作用,能够吸收可见光,因而有可能成为极具发展前景的可见光催化材料。

上述各种碳点光催化材料均为无孔结构,由于该材料的特殊表面性质,Yu等[79]通过简单的水热法制备了介孔碳点/α-Fe2O3复合材料。该复合物在可见光照射下能降解亚甲基蓝。对于该催化反应的机理,Yu等认为在可见光照射下,介孔赤铁矿产生电子空穴对,其中电子会通过渗透机制,很快转移到碳点表面,与复合物表面吸收的氧反应产生氧自由基,介孔赤铁矿上的空穴则与水反应产生羟基自由基,随后降解有机物。在该方法中,碳纳米点被填充到多孔结构中,由于该结构具有大的表面积和多孔结构,可为光催化提供更多反应点,提高量子效率;同时大的表面积能增加光的吸收率,加快电子的转移速率,进而提高光催化效率。
3.3 生物医学上的应用
传统的量子点虽然可用于离体和在体光学成像实验,但其对人体健康和环境潜在的危害性限制了它的应用[80]。具有低毒性和生物相容性的碳点有望取代量子点,在生物成像上发挥重要作用。
3.3.1 细胞标记
2007年,Cao等[5]发现在800nm激发光下,用碳点标记的人体肿瘤MCF-7细胞呈现出明亮的荧光特性(图5)。2013年,Dong等[81]将碳点作为荧光探针,利用直接或间接方法对人血淋巴细胞荧光成像。此外,Liu等[26]、Liu等[82]以及Sahu等[83]先后用碳点标记了大肠杆菌和小鼠P19祖细胞、人肝癌细胞系HepG-2以及人骨肉瘤细胞(MG-63)。Bourlinos等[84]制备了具有双荧光/磁共振成像(Magnetic Resonance Imaging, MRI)性能的超细尺寸Gd3+掺杂的碳点,其MRI造影作用可与商业造影剂Gadovist媲美,而且细胞毒性低,可用于生物医学研究中的多模态成像。在碳点用作荧光探针广泛标记生物细胞的同时,一些研究者进行了碳点的细胞毒性研究,如Ray等[24]、Jaiswal等[85],他们研究发现,即使碳点浓度是荧光标记所需浓度的100~1000倍,细胞存活率仍可为75%[24],暗示碳点在细胞标记中毒性非常小,在该领域具有广阔的应用前景。

图5 用碳点标记的人体肿瘤MCF-7细胞在波长800nm光激发下呈现的荧光图[5]Fig.5 Representative two-photon luminescence image (800nm excitation) of human breast cancer MCF-7 cells with internalized CDs[5]
3.3.2 活体实验
除了对体外细胞荧光标记,Yang等[86]将掺杂了ZnS的碳点注射到老鼠体内,并对其在淋巴管的迁移过程示踪,实现了碳点对体内细胞的荧光标记。他们将碳点注入老鼠前肢,由于碳点尺寸较小,表面又有抗蛋白特性的PEG修饰,碳点与淋巴细胞的相互作用减小,碳点会顺着前肢缓慢迁移至腋下淋巴结(24h后做腋下淋巴结切片可观察到相应碳点的荧光)。将碳点溶液静脉注射到老鼠体内作整体循环观测发现,只有膀胱部位可观测到碳点的荧光,说明静脉注射的碳点主要通过尿液排泄,这与PEG修饰的其他纳米粒子的排泄路径一致[87,88]。在整个实验中,小鼠没有任何不良反应,说明碳点是一种无毒且具有较好生物相容性的荧光标记和成像试剂。另外,Huang等[89]通过改进硝酸氧化法得到碳点,用PEG2000N修饰后,与Ce6反应得到C-dots-Ce6。通过C-dots-Ce6细胞定位实验、生物体内荧光成像及荧光检测实验证明,其在生物体内能有效对胃癌肿瘤进行光敏剂荧光检测及光动力治疗。这些实验预示碳点在生物医学和光学成像领域有潜在的应用前景。而Yang等[7]和Huang等[90]进行活体中碳点毒性的研究表明,碳点对生物体没有明显毒性,可用于活体动物的荧光成像,其作为纳米探针具有临床应用潜力。
3.4 其他应用
此外,考虑到生物体对可见光区的强吸收,碳点在药物传递和靶向治疗方面有较广阔的应用前景,将荧光碳点应用于药物载体中有望解决传统的药物载体不具备的可观察性和可追踪性[91]。另外,碳点在发光材料,如LED器件[92]、宏观结构材料[93]和荧光油墨[94]等方面均具有潜在的发展前景。
4 结束语
碳点作为一种新兴碳材料,因其低毒、生物相容性好、耐光漂白、无光闪烁等优点,在分析检测、催化、生物标记等领域表现出巨大的应用潜力,并吸引了越来越多的关注。目前,尽管碳点的合成方法非常多,且趋于简便、高产率,但碳点的荧光量子产率与半导体量子点相比还有很大差距,这也是碳点应用受到限制的主要原因,因此进一步优化碳点合成及修饰方法,以提高其荧光量子产率是现阶段材料化学家的首要任务。另外,目前,碳点的发光机理仍存在很大争议,设计可行严谨的实验进一步深入探究碳点的发光机理可为提高碳点的荧光量子产率提供可靠的理论依据。
此外,碳点在分析检测、催化、生物标记等方面的应用均处于初级阶段。以生物标记为例,碳点虽然实现了从离体成像到在体成像,但还仅停留在小动物实验阶段,需要进一步开展其在活体动物体内的毒性、成像深度等方面的研究。制备能提供快速、灵敏、精确、更易于检测的荧光信号的碳点,结合先进的光学成像技术,实时动态监测细胞内和生物活体内的分子事件,有望为揭示生命活动规律及研究疾病的发生、诊断、治疗提供新技术新方法。随着对碳点的进一步探索和开发,以期在其发光机制的阐释及发光性能的改良上获得突破,从而更快地推动碳点在生物、化学和材料等多领域的应用。
[1] XU X, RAY R, GU Y, et al. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J]. Journal of the American Chemical Society, 2004, 126(40): 12736-12737.
[2] ZHAO H X, LIU L Q, LIU Z D, et al. Highly selective detection of phosphate in very complicated matrixes with an off-on fluorescent probe of europium-adjusted carbon dots[J]. Chemical Communications, 2011, 47(9): 2604-2606.
[3] BAKER S N, BAKER G A. Luminescent carbon nanodots: emergent nanolights[J]. Angewandte Chemie International Edition, 2010, 49(38): 6726-6744.
[4] SUN Y P, ZHOU B, LIN Y, et al. Quantum-sized carbon dots for bright and colorful photoluminescence[J]. Journal of the American Chemical Society, 2006, 128(24): 7756-7757.
[5] CAO L, WANG X, MEZIANI M J, et al. Carbon dots for multiphoton bioimaging[J]. Journal of the American Chemical Society, 2007, 129(37): 11318-11319.
[6] HU S L, NIU K Y, SUN J, et al. One-step synthesis of fluorescent carbon nanoparticles by laser irradiation[J]. Journal of Materials Chemistry, 2009, 19(4): 484-488.
[7] YANG S T, WANG X, WANG H, et al. Carbon dots as nontoxic and high-performance fluorescence imaging agents[J]. The Journal of Physical Chemistry C, 2009, 113(42): 18110-18114.
[8] LI H, HE X, KANG Z, et al. Water-soluble fluorescent carbon quantum dots and photocatalyst design[J]. Angewandte Chemie International Edition, 2010, 49(26): 4430-4434.
[9] MING H, MA Z, LIU Y, et al. Large scale electrochemical synthesis of high quality carbon nanodots and their photocatalytic property[J]. Dalton Transactions, 2012, 41(31): 9526-9531.
[10] ZHOU J, BOOKER C, LI R, et al. An electrochemical avenue to blue luminescent nanocrystals from multiwalled carbon nanotubes (MWCNTs)[J]. Journal of the American Chemical Society, 2007, 129(4): 744-745.
[11] ZHAO Q L, ZHANG Z L, HUANG B H, et al. Facile preparation of low cytotoxicity fluorescent carbon nanocrystals by electrooxidation of graphite[J]. Chemical Communications, 2008, 41: 5116-5118.
[12] ZHENG L, CHI Y, DONG Y, et al. Electrochemiluminescence of water-soluble carbon nanocrystals released electrochemically from graphite[J]. Journal of the American Chemical Society, 2009, 131(13): 4564-4565.
[13] LU J, YANG J X, WANG J Z, et al. One-pot synthesis of fluorescent carbon nanoribbons, nanoparticles, and graphene by the exfoliation of graphite in ionic liquids[J]. ACS Nano, 2009, 3(8): 2367-2375.
[14] SUN Y P, WANG X, LU F, et al. Doped carbon nanoparticles as a new platform for highly photoluminescent dots[J]. The Journal of Physical Chemistry C, 2008, 112(47): 18295-18298.
[15] LI X Y, WANG H Q, SHIMIZU Y, et al. Preparation of carbon quantum dots with tunable photoluminescence by rapid laser passivation in ordinary organic solvents[J]. Chemical Communications, 2011, 47(3): 932-934.
[16] BAO L, ZHANG Z L,TIAN Z Q, et al. Electrochemical tuning of luminescent carbon nanodots: from preparation to luminescence mechanism[J]. Advanced Materials, 2011, 23: 5801-5806.
[17] BOTTINI M, BALASUBRAMANIAN C, DAWSON M I, et al. Isolation and characterization of fluorescent nanoparticles from pristine and oxidized electric arc-produced single-walled carbon nanotubes[J]. The Journal of Physical Chemistry B, 2006, 110(2): 831-836.
[18] VINCI J C, COLON L A. Fractionation of carbon-based nanomaterials by anion exchange HPLC[J]. Analytical Chemistry, 2011, 84(2): 1178-1183.
[19] LIU Y, LIU C, ZHANG Z. Synthesis and surface photochemistry of graphitized carbon quantum dots[J]. Journal of Colloid and Interface Science, 2011, 356(2): 416-421.
[20] SHA Y F, LOU J Y, BAI S Z, et al. Hydrothermal synthesis of nitrogen-containing carbon nanodots as the high-efficient sensor for copper(II) ions[J]. Materials Research Bulletin, 2013, 48(4): 1728-1731.
[21] LIU S, TIAN J, WANG L, et al. Hydrothermal treatment of grass: a low-cost, green route to nitrogen-doped, carbon-rich, photoluminescent polymer nanodots as an effective fluorescent sensing platform for label-free detection of Cu (II) ions[J]. Advanced Materials, 2012, 24(15): 2037-2041.
[22] LIU Y, LIU C Y, ZHANG Z Y. Synthesis of highly luminescent graphitized carbon dots and the application in the Hg2+detection[J]. Applied Surface Science, 2012, 263:481-485.
[23] LIU H, YE T, MAO C. Fluorescent carbon nanoparticles derived from candle soot[J]. Angewandte Chemie International Edition, 2007, 46(34): 6473-6475.
[24] RAY S C, SAHA A, JANA N R, et al. Fluorescent carbon nanoparticles: synthesis, characterization, and bioimaging application[J]. The Journal of Physical Chemistry C, 2009, 113(43): 18546-18551.
[25] TIAN L, GHOSH D, CHEN W, et al. Nanosized carbon particles from natural gas soot[J]. Chemistry of Materials, 2009, 21(13): 2803-2809.
[26] LIU R L, WU D Q, LIU S H, et al. An aqueous route to multicolor photoluminescent carbon dots using silica spheres as carriers[J]. Angewandte Chemie International Edition, 2009, 121(25): 4668-4671.
[27] BOURLINOS A B, STASSINOPOILOS A, ANGLOS D, et al. Photoluminescent carbogenic dots[J]. Chemistry of Materials, 2008, 20(14): 4539-4541.
[28] ZONG J, ZHU Y, YANG X, et al. Synthesis of photoluminescent carbogenic dots using mesoporous silica spheres as nanoreactors[J]. Chemical Communications, 2011, 47(2): 764-766.
[29] ZHANG B, LIU C Y, LIU Y. A novel one-step approach to synthesize fluorescent carbon nanoparticles[J]. European Journal of Inorganic Chemistry, 2010, 2010(28): 4411-4414.
[30] LI J, ZHANG B, WANG F, et al. Silver/carbon-quantum-dot plasmonic luminescent nanoparticles[J]. New Journal of Chemistry, 2011, 35(3): 554-557.
[31] WANG F, PANG S P, WANG L, et al. One-step synthesis of highly luminescent carbon dots in noncoordinating solvents[J]. Chemistry of Materials, 2010, 22(16): 4528-4530.
[32] WANG F, XIE Z, ZHANG H, et al. Highly luminescent organosilane-functionalized carbon dots[J]. Advanced Functional Materials, 2011, 21(6): 1027-1031.
[33] LI Y Y, XU L, CHEN T, et al. Carbon nanoparticles from corn stalk soot and its novel application as stationary phase of hydrophilic interaction chromatography and per aqueous liquid chromatography[J]. Analytica Chimica Acta, 2012, 726: 102-108.
[34] YANG Y, CUI J, ZHENG M, et al. One-step synthesis of amino-functionalized fluorescent carbon nanoparticles by hydrothermal carbonization of chitosan[J]. Chemical Communications, 2012, 48(3): 380-382.
[35] PAN D, ZHANG J, LI Z, et al. Observation of pH-,solvent-, spin-, and excitation-dependent blue photoluminescence from carbon nanoparticles[J]. Chemical Communications, 2010, 46(21): 3681-3683.
[36] XIE Z, WANG F, LIU C. Organic-inorganic hybrid functional carbon dot gel glasses[J]. Advanced Materials, 2012, 24(13): 1716-1721.
[37] LI H T, HE X D, LIU Y, et al. Synthesis of fluorescent carbon nanoparticles directly from active carbon via a one-step ultrasonic treatment[J]. Materials Research Bulletin, 2011, 46(1): 147-151.
[38] LIU Y, LIU C Y, ZHANG Z Y. Graphitized carbon dots emitting strong green photoluminescence[J]. Journal of Materials Chemistry C, 2013, 1(32): 4902-4907.
[39] ZHU H, WANG X, LI Y L, et al. Microwave synthesis of fluorescent carbon nanoparticles with electrochemiluminescence properties[J]. Chemical Communications, 2009, 34: 5118-5120.
[40] 王珊珊, 米渭清, 朱红,等. 一步微波法合成碳点及其荧光性质研究[J]. 光谱学与光谱分析, 2012, 32(10): 2710-2713.
WANG Shan-shan, MI Wei-qing, ZHU Hong,et al. Study on the fluorescence properties of carbon dots prepared by one step microwave method[J]. Spectroscopy and Spectral Analysis, 2012, 32(10): 2710-2713.
[41] WANG Q, ZHENG H, LONG Y, et al. Microwave-hydrothermal synthesis of fluorescent carbon dots from graphite oxide[J]. Carbon, 2011, 49(9): 3134-3140.
[42] WANG F, KREITER M, HE B, et al. Synthesis of direct white-light emitting carbogenic quantum dots[J]. Chemical Communications, 2010, 46(19): 3309-3311.
[43] BOURLINOS A B, STASSINOPOULOS A, ANGLOS D, et al. Surface functionalized carbogenic quantum dots[J]. Small, 2008, 4(4): 455-458.
[44] ZHANG R Q, BERTRAN E, LEE S T. Size dependence of energy gaps in small carbon cluster: the origin of broadband luminescence[J]. Diamond and Related Materials, 1998, 7(11): 1663-1668.
[45] SZABO T, BERKESI O, FORGO P, et al. Evolution of surface functional groups in a series of progressively oxidized graphite oxides[J]. Chemistry of Materials, 2006, 18(11): 2740-2749.
[46] BACCILE N, LAURENT G, BABONNEAU F, et al. Structural characterization of hydrothermal carbon spheres by advanced solid-state MAS 13C NMR investigations[J]. The Journal of Physical Chemistry C, 2009, 113(22): 9644-9654.
[47] WANG X, CAO L, YANG S T, et al. Bandgap-like strong fluorescence in functionalized carbon nanoparticles[J]. Angewandte Chemie International Edition, 2010, 122(31): 5438-5442.
[48] RIGGS J E, GUO Z X, CARROLL D L, et al. Strong luminescence of solubilized carbon nanotubes[J]. Journal of the American Chemical Society, 2000, 122(24): 5879-5880.
[49] WILSON W L, SZAJOWSKI P F, BRUS L E. Quantum confinement in size-selected, surface-oxidized silicon nanocrystals[J]. Science, 1993, 262(5137): 1242-1244.
[50] PENG H, TRAVAS-SEJDIC J. Simple aqueous solution route to luminescent carbogenic dots from carbohydrates[J]. Chemistry of Materials, 2009, 21(23): 5563-5565.
[51] LI M, GOU H L, AL-QGAIDI I, et al. Nanostructured sensors for detection of heavy metals: a review[J]. ACS Sustainable Chemistry & Engineering, 2013, 1(7): 713-723.
[52] GONCALVES H M R, JORGE P A S, FERNANDES J R A, et al. Hg(II) sensing based on functionalized carbon dots obtained by direct laser ablation[J]. Sensors and Actuators B: Chemical, 2010, 145(2): 702-707.
[53] GONCALYES H M R, DUARTE A J, ESTEVES DA SILVA J C G. Optical fiber sensor for Hg(II) based on carbon dots[J]. Biosensors and Bioelectronics, 2010, 26(4): 1302-1306.
[54] ZHU A W, QU Q, SHAO X L, et al. Carbon-dot-based dual-emission nanohybrid produces a ratiometric fluorescent sensor for in vivo imaging of cellular copper ions[J]. Angewandte Chemie, 2012, 124(29): 7297-7301.
[55] SHAO X L, GU H, WANG Z, et al. Highly selective electrochemical strategy for monitoring of cerebral Cu2+based on a carbon dot-TPEA hybridized surface[J]. Analytical Chemistry, 2013, 85(1): 418-425.
[56] LIU J M, LIN L P, WANG X X, et al. Highly selective and sensitive detection of Cu2+with lysine enhancing bovine serum albumin modified-carbon dots fluorescent probe[J]. Analyst, 2012, 137(11): 2637-2642.
[57] SALINAS-CASTILLO A, ARIZA-AVIDAD M, PRITZ C, et al. Carbon dots for copper detection with down and upconversion fluorescent properties as excitation sources[J]. Chemical Communications, 2013, 49(11):1103-1105.
[58] QU K G, WANG J S, REN J S, et al. Carbon dots prepared by hydrothermal treatment of dopamine as an effective fluorescent sensing platform for the label-free detection of iron(III) ions and dopamine[J]. Chemistry-A European Journal, 2013, 19(22):7243-7249.
[59] LIU L Q, LI Y F, ZHAN L, et al. One-step synthesis of fluorescent hydroxyls-coated carbon dots with hydrothermal reaction and its application to optical sensing of metal ions[J]. Science China Chemistry, 2011, 54(8): 1342-1347.
[60] WEI W, XUA C, REN J, et al. Sensing metal ions with ion selectivity of a crown ether and fluorescence resonance energy transfer between carbon dots and grapheme[J]. Chemical Communications, 2012, 48(9):1284-1286.
[61] 方静美, 刘利芹, 赵希娟,等. 铝离子与羟基功能化荧光碳点的相互作用[J]. 应用化学, 2013, 30(10): 1144-1148.
FANG Jing-mei, LIU Li-qin, ZHAO Xi-juan, et al. Interaction between aluminium(Ⅲ) cation and hydroxyl functionalized fluorescent carbon dots[J]. Chinese Journal of Applied Chemistry, 2013, 30(10):1144-1148.
[62] LIN Z, XUE W, CHEN H, et al. Peroxynitrous-acid-induced chemiluminescence of fluorescent carbon dots for nitrite sensing[J]. Analytical Chemistry, 2011, 83(21): 8245-8251.
[63] LIU J M, LIN L, WANG X X, et al. Zr(H2O)2EDTA modulated luminescent carbon dots as fluorescent probes for fluoride detection[J]. Analyst, 2013, 138(1): 278-283.
[64] BAI W J, ZHENG H Z, LONG Y J, et al. Carbon dots-based fluorescence turn-on method for DNA determination[J]. Analytical Sciences, 2011, 27(3): 243-246.
[65] MAO Y, BAO Y, HAN D X, et al. Efficient one-pot synthesis of molecularly imprinted silica nanospheres embedded carbon dots for fluorescent dopamine optosensing[J]. Biosensors and Bioelectronics, 2012, 38(1): 55-60.
[66] WANG C I, PERIASAMY A P, CHANG H T. Photoluminescent C-dots@RGO probe for sensitive and selective detection of acetylcholine[J]. Analytical Chemistry, 2013, 85(6):3263-3270.
[67] YU C, LI X, ZENG F, et al. Carbon-dot-based ratiometric fluorescent sensor for detecting hydrogen sulfide in aqueous media and inside live cells[J]. Chemical Communications, 2013, 49(4): 403-405.
[68] BARMAN S, SADHUKHAN M. Facile bulk production of highly blue fluorescent graphitic carbon nitride quantum dots and their application as highly selective and sensitive sensors for the detection of mercuric and iodide ions in aqueous media[J]. Journal of Materials Chemistry, 2012, 22(41): 21832-21837.
[69] LI J, WANG N, CHEN L, et al. Electrogenerated chemiluminescence detection of trace level pentachlorophenol using carbon quantum dots[J]. Analyst, 2013, 138(7): 2038-2043.
[70] MA Z, ZHANG Y L, WANG L, et al. Bioinspired photoelectric conversion system based on carbon-quantum-dot-doped dye-semiconductor complex[J]. ACS Applied Materials & Interfaces, 2013, 5(11): 5080-5084.
[71] CAO L, SAHU S, ANILKUMAR P, et al. Carbon nanoparticles as visible-light photocatalysts for efficient CO2conversion and beyond[J]. Journal of the American Chemical Society, 2011, 133: 4754-4757.
[72] YU H, ZHANG H, HUANG H, et al. ZnO/carbon quantum dots nanocomposites: one-step fabrication and superior photocatalytic ability for toxic gas degradation under visible light at room temperature[J]. New Journal of Chemistry, 2012, 36(4): 1031-1035.
[73] ZHANG H C, MING H, LIAN S Y, et al. Fe2O3/carbon quantum dots complex photocatalysts and their enhanced photocatalytic activity under visible light[J]. Dalton Transactions, 2011, 40(41): 10822-10825.
[74] ZHANG H, HUANG H, MING H, et al. Carbon quantum dots/Ag3PO4complex photocatalysts with enhanced photocatalytic activity and stability under visible light[J]. Journal of Materials Chemistry, 2012, 22(21): 10501-10506.
[75] LI H T, LIU R H, LIU Y, et al. Carbon quantum dots/Cu2O composites with protruding nanostructures and their highly efficient (near) infrared photocatalytic behavior[J]. Journal of Materials Chemistry, 2012, 22(34):17470-17475.
[76] TANG D, ZHANG H C, HUANG H, et al. Carbon quantum dots enhance the photocatalytic performance of BiVO4with different exposed facets[J]. Dalton Transactions, 2013, 42(18): 6285-6289.
[77] LI H T, LIU R H, LIAN S Y, et al. Near-infrared light controlled photocatalytic activity of carbon quantum dots for highly selective oxidation reaction[J]. Nanoscale, 2013, 5(8): 3289-3297.
[78] LI H P, ZHU Y H, CAO H M, et al. Preparation and characterization of photocatalytic carbon dots-sensitized electrospun titania nanostructured fibers[J]. Materials Research Bulletin, 2013, 48(2): 232-237.
[79] YU B Y, KWAK S Y. Carbon quantum dots embedded with mesoporous hematite nanospheres as efficient visible light-active photocatalysts[J]. Journal of Materials Chemistry, 2012, 22(17): 8345-8353.
[80] HOTZER B, MEDINTZ I L, HILDEBRANDT N. Fluorescence in nanobiotechnology: sophisticated fluorophores for novel applications[J]. Small, 2012, 8(15): 2297-2326.
[81] 董微, 王莹, 宋有涛,等. 荧光碳点对人血淋巴细胞标记成像[J]. 光谱实验室, 2013, 30(3): 1035-1038.
DONG Wei, WANG Ying, SONG You-tao, et al. Labeling of human T-lymphocyte by fluorescent carbon dots[J]. Chinese Journal of Spectroscopy Laboratory, 2013, 30(3): 1035-1038.
[82] LIU C J, ZHANG P, TIAN F, et al. One-step synthesis of surface passivated carbon nanodots by microwave assisted pyrolysis for enhanced multicolor photoluminescence and bioimaging[J]. Journal of Materials Chemistry, 2011, 21(35): 13163-13167.
[83] SAHU S, BEHERA B, MAITI T K, et al. Simple one-step synthesis of highly luminescent carbon dots from orange juice: application as excellent bio-imaging agents[J]. Chemical Communications, 2012, 48(70): 8835-8837.
[84] BOURLINOS A B, BAKANDRITSOS A, KOULOUMPIS A, et al. Gd(III)-doped carbon dots as a dual fluorescent-MRI probe[J]. Journal of Materials Chemistry, 2012, 22(44): 23327-23330.
[85] JAISWAL A, GHOSH S S, CHATTOPADHYAY A. One step synthesis of C-dots by microwave mediated caramelization of poly (ethylene glycol)[J]. Chemical Communications, 2012, 48:407-409.
[86] YANG S T, CAO L, LUO P G, et al. Carbon dots for optical imaging in vivo[J]. Journal of the American Chemical Society, 2009, 131(32): 11308-11309.
[87] KIM S, LIM Y T, SOLTESZ E G, et al. Near-infrared fluorescent type II quantum dots for sentinel lymph node mapping[J]. Nature Biotechnology, 2004, 22(1): 93-97.
[88] CHOI H S, LIU W, MISRA P, et al. Renal clearance of quantum dots[J]. Nature Biotechnology, 2007, 25(10): 1165-1170.
[89] HUANG P, LIN J, WANG X, et al. Light-triggered theranostics based on photosensitizer-conjugated carbon dots for simultaneous enhanced-fluorescence imaging and photodynamic therapy[J]. Advanced Materials, 2012, 24(37): 5104-5110.
[90] HUANG X, ZHANG F, ZHU L, et al. Effect of injection routes on the biodistribution, clearance, and tumor uptake of carbon dots[J]. ACS Nano, 2013, 7(7): 5684-5693.
[91] LAI C W, HSIAO Y H, PENG Y K, et al. Facile synthesis of highly emissive carbon dots from pyrolysis of glycerol; gram scale production of carbon dots/mSiO2for cell imaging and drug[J]. Journal of Materials Chemistry, 2012, 22(29): 14403-14409.
[92] WANG F, CHEN Y H, LIU C Y, et al. White light-emitting devices based on carbon dots’ electroluminescence[J]. Chemical Communications, 2011, 47(12): 3502-3504.
[93] ZHANG P, LI W C, ZHAI X Y, et al. A facile and versatile approach to biocompatible “fluorescent polymers” from polymerizable carbon nanodots[J]. Chemical Communications, 2012, 48(84): 10431-10433.
[94] WANG J, WANG C F, CHEN S. Amphiphilic egg-derived carbon dots: rapid plasma fabrication, pyrolysis process, and multicolor printing patterns[J]. Angewandte Chemie International Edition, 2012, 124(37): 9431-9435.
Progress in Research on Preparation and Application of Carbon Dots
WANG Lin-peng1,MA Yu-jie1,ZHOU Xue-hua1,LIU Yun2,WU Rui-dong1
(1 Environment Research Institute,Shandong University, Jinan 250100,China; 2 Technical Institute of Physics and Chemistry,Chinese Academy of Sciences,Beijing 100190,China)
The preparation methods, luminescence mechanism and application research progress of carbon dots (CDs) were summarized. Approaches for synthesizing CDs were emphasized, and can be generally classified into two main ways: bottom-up and top-down methods. Top-down methods include arc discharge, laser ablation and electrochemical oxidation methods and others, and bottom-up approaches consist of combustion routes, template synthesis methods, hydrothermal methods, thermal methods and others. The advantages and disadvantages of these methods and fluorescent quantum yield were evaluated, and the research trend of these methods was prospected. It is pointed out that the synthetic/modified methods of CDs and the luminescence mechanism need to be further studied to improve the quantum yield in the future research, and it is crucial to synthetic CDs with the fluorescent which can be precisely, sensitively, rapidly and easily detected in the application of CDs as a new technique and a new method in all kinds of chemical detections and analysis.
carbon dots;preparation;application
10.11868/j.issn.1001-4381.2015.05.016
O613.71
A
1001-4381(2015)05-0101-12
山东省自然科学基金(ZR2010DQ022); 国家自然科学基金(21103209,21273256)
2014-06-20;
2015-02-26
周学华(1976-),女,博士,副教授,主要从事纳米材料的制备及其在环境中的应用,联系地址:山东省济南市山大南路27号山东大学环境研究院(250100),E-mail:xuehuazhou@sdu.edu.cn

