两性霉素B脂质体原位凝胶滴眼液的研究
杜晓俐,任伟芳,马 悦,付 洋,宋 娟,杨 丽*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
两性霉素B脂质体原位凝胶滴眼液的研究
杜晓俐,任伟芳,马 悦,付 洋,宋 娟,杨 丽*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的制备两性霉素B脂质体(AmB-L)温敏原位凝胶滴眼液,并对其体外性质进行研究。方法以泊洛沙姆407(P407)和泊洛沙姆188(P188)为基质制备两性霉素B脂质体温敏原位凝胶滴眼液,测定其胶凝温度、离体角膜黏附力和流变学性质,以确定最佳处方;并使用无膜溶出法考察凝胶的溶蚀及药物释放行为。结果最佳的凝胶基质组成为w(P407)∶w(P188)= 21∶2,其泪液稀释前后的胶凝温度分别为(25.6±0.2)℃和(34.3±0.3)℃,室温时黏度较低,35 ℃时黏度急剧变大,黏附力适宜。体外释放试验表明凝胶溶蚀与药物释放呈线性相关。结论制备的两性霉素B脂质体温敏原位凝胶滴眼液符合眼部用药应用要求,体外溶蚀与释放符合零级动力学特征。
药剂学;两性霉素B脂质体;温敏原位凝胶;胶凝温度;流变学;生物黏附力;体外释放
真菌性角膜炎是世界范围内的严重致盲性眼病,近年来发病率逐年上升[1-3]。两性霉素B作为一种治疗真菌性角膜炎的药物已有多年的临床应用历史,研究表明,局部应用时治愈率可高达87.5%,目前是治疗念珠菌性角膜炎的首选药物。然而目前没有商品化的眼用制剂供临床应用,只能用注射剂现配现用,但两性霉素B注射剂是一种用去氧胆酸钠增溶的胶束溶液,滴眼后刺激性较大,导致患者顺应性差,且局部吸收少、生物利用度低,需反复频繁的给药,增加了药物的毒性及不良反应[4-5]。
脂质体作为眼部给药系统具有毒性低、刺激性小、生物相容性好等优点。有研究报道,两性霉素B脂质体滴眼液能够显著降低药物的局部刺激性、毒性及不良反应,延长药物在眼内的半衰期[6-10]。但脂质体的稳定性较差,黏度较低,药物在作用位点滞留时间较短,致使药物的疗效降低。温敏原位凝胶在室温时为溶液,滴入眼后迅速发生相转变成为半固体凝胶,能延长药物的角膜前滞留时间,从而提高药物的生物利用度[11]。将脂质体分散其中,高浓度凝胶态对脂质体具有稳定作用,并延缓药物的释放,达到长效的目的。但目前,还未见关于两性霉素B脂质体原位凝胶型滴眼液的研究报道。作者首次将两性霉素B脂质体制成原位凝胶型滴眼液,对其处方组成进行优化,并考察体外药物释放行为,为两性霉素B滴眼液的研究与开发提供实验依据。
1 仪器与材料
JB-2型恒温磁力搅拌器(上海雷磁仪器厂新泾分厂),UV-2000 紫外-可见分光光度计(上海尤尼柯仪器有限公司),恒温水浴锅(上海衡平仪器仪表厂),恒温振荡器(天津欧诺仪器仪表厂),黏附力测定装置(自制),AR 2000ex流变仪(T.A. Instruments, Ltd., USA )。
两性霉素B脂质体(自制),泊洛沙姆407(P407,德国巴斯夫公司),泊洛沙姆188(P188,德国巴斯夫公司),模拟泪液(自制)。
2 方法
2.1 两性霉素B脂质体原位凝胶的制备
将处方量的泊洛沙姆407和泊洛沙姆188于高速搅拌下缓缓加入两性霉素B脂质体溶液中,继续搅拌使分散均匀,然后在4 ℃下搅拌,使之溶解,于4 ℃保存备用。
2.2 处方筛选
按表1处方组成,制备两性霉素B脂质体原位凝胶滴眼液,按“2.3”条方法测定胶凝温度,以胶凝温度为评价指标筛选适宜处方。
2.3 胶凝温度的测定
2.3.1 两性霉素B脂质体温敏原位凝胶的胶凝温度
取两性霉素B脂质体泊洛沙姆溶液1 mL加至西林瓶中,然后将其置于4 ℃恒温水浴中,实验开始时水浴温度以3 ℃的涨幅逐渐升高,在相变温度区(25~35)℃以1 ℃的涨幅逐渐升高,每个温度下制剂需平衡10 min,在接近胶凝时以0.1 ℃的涨幅升高,每个温度下制剂需平衡2 min。平衡后将西林瓶倾斜90°,观察内容物流动情况。西林瓶内液体不流动时的温度为胶凝温度。测定3次取平均值[12]。
2.3.2 两性霉素B脂质体温敏原位凝胶经模拟泪液稀释后的胶凝温度
滴眼液在滴入眼后,泪液会对其有一定的稀释作用。通常认为滴入的药液与泪液的体积比大约为40∶7[13],所以将AmB-L泊洛沙姆溶液与模拟泪液(每升模拟泪液中含碳酸氢钠2.189 g、氯化钠6.789 g、二水氯化钙84.9 mg和氯化钾1.389 g)按体积比40∶7进行稀释,按“2.3.1”条方法测定胶凝温度。
2.4 两性霉素B脂质体温敏原位凝胶流变性质的考察
使用TA Instruments AR 2000ex流变仪对凝胶的流变学性质进行考察,选择直径为40 mm的测头,流动模式下分别设定流变仪温度为20 ℃和35 ℃,剪切速率范围0~120 s-1,绘制原位凝胶的黏度-剪切速率曲线。
2.5 两性霉素B脂质体温敏原位凝胶生物黏附力的测定
黏附力测定装置如图1所示[14]。取新鲜兔角膜,用生理盐水冲洗干净后吸干表面水分,将上皮朝外固定于小柱(r = 0.5 cm)下端,调节装置平衡。将装置放入35 ℃恒温箱中,滴加AmB-L泊洛沙姆溶液40 μL于可调节高度的平台上,将平台高度调至角膜可恰好接触溶液后,静候5 min待溶液完全胶凝。将5.0 g砝码放于装置左侧破坏其平衡使角膜与凝胶接触,10 min后,除去砝码,打开输液器开关,以5 mL·min-1匀速滴水至已预先称好质量的小瓶中,直至角膜与凝胶恰好分离。计算单位面积黏附力。计算黏附力的公式为f= 0.98 m/πr2。其中:m为水的质量,r为半径。
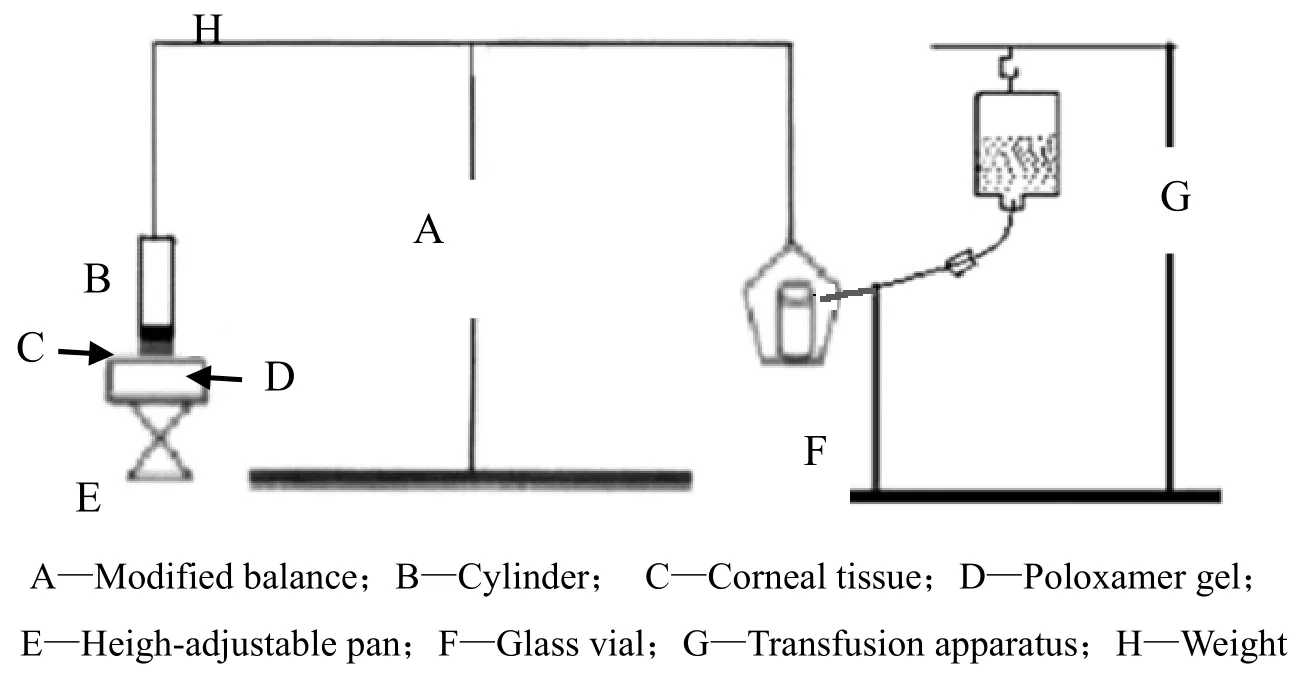
Fig. 1 Bioadhesive force-measuring device图1 黏附力测定装置
2.6 两性霉素B脂质体温敏原位凝胶的溶蚀行为与释放行为的考察
2.6.1 凝胶溶蚀行为考察
使用无膜溶出法研究AmB-L温度敏感原位凝胶的溶蚀行为。取AmB-L泊洛沙姆溶液1 mL置于已预先称好质量的5 mL西林瓶中,记录质量。然后将其放入35 ℃的恒温振荡器中平衡10 min,使制剂完全胶凝,在凝胶表面小心加入模拟泪液1 mL作为释放介质。100 r·min-1恒温振荡预先设置的时间后,倒出全部释放介质,擦干西林瓶表面,称质量,然后重新放回恒温振荡器重复以上操作,直至凝胶剩余质量不足20%为止[15]。以凝胶累积溶蚀量对时间作图,得凝胶溶蚀曲线。
2.6.2 凝胶中药物的释放
取溶蚀实验得到的释放介质样品适量,将脂质体稀释破坏后,用紫外分光光度法测定药物浓度。以累积药物释放量对时间作图,得药物释放曲线。
3 结果与讨论
3.1 胶凝温度的测定结果
眼用原位凝胶应在室温下为流动的液体,滴入眼后应迅速转变为凝胶,所以研究胶凝温度是处方研究的重要部分。P407是一种无毒、无刺激的药用辅料,常作为温敏原位凝胶的基质,但是其成胶温度较低(质量分数为20%的P407胶凝温度即为约25 ℃),存在实际使用时需冷藏的弊端,且经前期研究表明脂质体的加入会使胶凝温度进一步降低(质量分数为20%的P407溶液加入脂质体后胶凝温度从25 ℃降低至19.8 ℃),所以本实验将其与P188合用,提高胶凝温度,以期获得具有适宜胶凝温度(25~35 ℃)的凝胶基质。
不同处方凝胶基质的胶凝温度测定结果见表1。结果表明,随P407质量分数的升高,凝胶的胶凝温度降低;而随P188质量分数的升高,胶凝温度升高。经模拟泪液稀释后,凝胶的胶凝温度均有一定升高。模拟泪液稀释前与稀释后胶凝温度均符合眼用要求的处方为F2、F9、F15。
泊洛沙姆是由亲水性聚氧乙烯 (PEO)和疏水性聚氧丙烯(PPO)组成的三嵌段共聚物,当达到临界胶束浓度和临界胶束温度时,泊洛沙姆形成PEO链段为外壳、疏水性PPO链段为内核的胶束,温度继续升至胶凝温度时,胶束聚集相互缠结形成凝胶。P407中PEO和PPO的分子数量比为70∶30,P188中PEO和PPO的分子数量比为80∶20,临界胶束温度与PPO的分子数量呈反向相关,加入P188后PPO比例降低,所以胶凝温度升高。泪液稀释后,因单位面积内胶束的量减少,所以需要更高的温度促使胶束网络的堆砌和缠结以形成凝胶。
Table 1 Gelation temprature of various Poloxamer formulations beforeand after tear dilution (±s, n=3)表1 不用处方的胶凝温度

Table 1 Gelation temprature of various Poloxamer formulations beforeand after tear dilution (±s, n=3)表1 不用处方的胶凝温度
Formula w(P407 )/% w(P188 )/% θ(GT before dilution)/℃ θ(GT after dilution)/℃F1 18 1 26.5±0.2 >35 F2 19 1 25.8±0.3 34.6±0.3 F3 20 1 24.2±0.2 33.2±0.1 F4 21 1 22.4±0.1 31.7±0.2 F5 22 1 20.5±0.3 30.1±0.1 F6 18 2 >35 >35 F7 19 2 30.2±0.2 >35 F8 20 2 27.4±0.1 >35 F9 21 2 25.6±0.2 34.3±0.3 F10 22 2 21.6±0.3 30.6±0.2 F11 18 3 >35 >35 F12 19 3 34.3±0.4 >35 F13 20 3 31.0±0.2 >35 F14 21 3 28.8±0.1 >35 F15 22 3 26.0±0.2 34.7±0.2
3.2 流变性质的考察
根据胶凝温度的测定结果,对处方F2、F9、F15进行了流变性质的测定,结果如图2。由图2可知,20 ℃时各处方黏度不随剪切速率的变化而变化,是典型的牛顿流体。35 ℃时各处方黏度增大并出现随剪切速率的增大黏度急剧降低的现象,表现出了非牛顿流体的特征。在20 ℃和35 ℃下,均表现为浓度越大的各处方黏度越大。
对于泊洛沙姆胶型原位凝胶,在胶凝温度以下胶束和单体占主导,内摩擦力较小,黏度较低;当温度达到胶凝温度以上时,胶束之间相互聚集增强,凝胶形成,内摩擦力大。因此,黏度急剧增大,但随剪切速率的增大,胶束的聚集被破坏,所以黏度又急剧降低。
正常生理条件下,眼睑和眼球运动产生的剪切速率范围是很宽的,眨眼间隙产生的剪切速率为3×10-2~0.1 s-1;而眨眼时的剪切速率可达到4 500~4×104s-1[16],因此在生理条件下凝胶经剪切变稀的这一性质不会阻碍眨眼等正常生理运动,没有不适感,能使药物在眼球表面分布更加均匀,增加患者的顺应性。

Fig. 2 Viscosity curves of different formulations at 20 ℃ and 35 ℃图2 不同处方在20℃和35℃时的黏度曲线
3.3 离体角膜黏附力的测定结果
黏附力对于药物在眼前的滞留时间非常重要,黏附力越大,药物的滞留时间越长,存留在眼前的药物浓度越高;但如果黏附力过大,容易对角膜造成损害。本文的黏附力测定结果见图3。综合胶凝温度和黏度测定的结果,F9既符合胶凝温度的要求,又有适宜的黏度和较大的黏附力,确定其为最优处方。
聚合物通过与结膜和角膜表面的黏蛋白相互作用而产生黏附力。黏蛋白具有1个蛋白或多肽的核,核上的糖基侧链是与聚合物作用的主要位点,一般认为具有羧基、羟基等亲水性官能团的聚合物更易与黏蛋白产生静电作用和氢键吸附以及疏水作用。所以聚合物浓度越大,与黏蛋白产生的相互作用便越强,黏附力也越大。

Fig. 3 Bioadhesive force of F2, F9, F15图3 黏附力的测定结果
3.4 凝胶溶蚀与药物释放的测定结果
处方F9的凝胶溶蚀曲线与药物释放曲线见图4~6。由图4~6可见,凝胶的溶蚀和药物释放均以恒定的速率进行,直至剩余凝胶少于初始凝胶的20%。将凝胶溶蚀量和两性霉素B累积释放量分别对时间回归,均呈现出良好的线性关系,其回归方程分别为 y=30.664χ-6.542 9,r=0.999 3;y=22.238χ-1.716 7,r=0.999 4),符合零级动力学的特征。以药物累积释放量对凝胶溶蚀量作图,亦呈现出良好的线性关系,即y=0.750 6χ+1.216 2,r=0.999 4,证明了药物的释放依靠凝胶的溶蚀。

Fig. 4 Curve of gel erosion versus time图4 凝胶溶蚀-时间曲线

Fig. 5 Curve of cumulative drug release versus time图5 药物累积释放量-时间曲线
泊洛沙姆温敏原位凝胶有很好的水溶性,模拟泪液中的水分子从凝胶表面进入凝胶使其溶解,凝胶溶蚀从而药物得到释放,凝胶的溶蚀速率是药物释放的主要影响因素。通过溶蚀控制药物释放速率,能避免药物的突释,提高用药安全性。脂质体粒径较大,很难从凝胶中扩散出来,因此主要通过凝胶的溶蚀实现药物的释放。
眼部给药系统体外释药方法可分为有膜释药和无膜释药两种。有膜释药又分为透析袋法、改良《美国药典》溶出度测定第三法、立式扩散池法;无膜释药不使用半透膜,在振荡条件下模拟泪液对制剂能产生类似眨眼时的剪切作用,更能模拟泪液分泌溶蚀的情况。而眼用温敏凝胶剂易溶于水,通过泪液对其表面的溶蚀而消除,药物才得以释放,所以作者采用无膜溶出法,更符合眼用凝胶在体内的真实情况。

Fig. 6 Curve of cumulative drug release versus gel erosion图6 药物累积释放量-凝胶溶蚀曲线
4 结论
本研究通过胶凝温度的测定、流变学研究及离体角膜黏附力的测定筛选两性霉素B脂质体温敏原位凝胶的最佳处方,并对其体外释放行为进行研究。结果表明,P407与P188的质量分数比为21∶2时胶凝温度为(25.6±0.2) ℃,泪液稀释后的胶凝温度为(34.3±0.3) ℃;室温时黏度较低为牛顿流体,胶凝后为非牛顿流体;黏附力较大,可将其作为最优处方。其体外释放结果表明,药物释放与凝胶溶蚀呈线性相关,且都表现为零级动力学。
作者制备的两性霉素B脂质体温敏凝胶滴眼液符合眼部用药的应用要求,延长药物在眼内的滞留时间,从而提高疗效,降低了毒性及不良反应,提高患者使用顺应性,具有非常好的应用价值。
[1] ?LECK A K, THOMAS P A, HAGAN M, et al. Aetiology of suppurative corneal ulcers in Ghana and south India, and epidemiology of fungal keratitis.[J]. British Journal of Ophthalmology, 2002, 86(11): 1211-1215.
[2] ROSA R H, MILLER D, ALFONSO E C. The changing spectrum of fungal keratitis in South Florida[J]. Ophthalmology, 1994, 101(6): 1005-1013.
[3] 王小强, 马林. 真菌性角膜炎研究进展[J]. 国际眼科纵览, 2010, 34(2): 90-93.
[4] 瞿玲辉, 李良毛. 真菌性角膜炎的药物治疗进展[J]. 眼科研究, 2010, 28(2): 178-182.
[5] 郑丹. 两性霉素B滴眼液治疗真菌性角膜溃疡效果观察[J]. 中国实用眼科杂志, 2012, 30(5): 609-611.
[6] MORAND K, BARTOLETTI A C, BOCHOT A, et al. Liposomal amphotericin B eye drops to treat fungal keratitis: Physico-chemical and formulation stability[J]. International Journal of Pharmaceutics, 2007, 344: 150-153.
[7] BARZA M, BAUM J, TREMBLAY C, et al. Ocular toxicity of intravitreally injected liposomal amphotericin B in rhesus monkeys.[J]. American Journal of Ophthalmology, 1985, 100(2): 259-263.
[8] CANNON J P, FISCELLA R, PATTHARACHAYAKUL S, et al. Comparative toxicity and concentrations of intravitreal ?amphotericin B formulations in a rabbit model.[J]. Investigative Ophthalmology & Visual Science, 2003, 44(5):2112-2117.
[9] 陆肇曾. 兔眼局部应用两性霉素B缓释制剂的研究[J]. 眼科研究, 2006, 24(4): 378-38l.
[10] 陆肇曾. 两性霉素B脂质体滴眼液在兔房水中的药动学[J]. 中国新药与临床杂志, 2006, 25(11): 812-815.
[11] 高琳雁. 温度敏感原位凝胶在眼部给药系统中的研究进展[J]. 中国抗生素杂志, 2009, 34(3): 142-146.
[12] MANSOUR M, MANSOUR S N, ABD-ELHADY S. Ocular poloxamer-based ciprofloxacin hydrochloride in situ forming gels[J]. Drug Development & Industrial Pharmacy, 2008, 34(7): 744-752.
[13] WEI Gang, XU Hui, DING Ping-tian, et al. Thermosetting gels with modulated gelation temperature for ophthalmic use: the rheological and gamma scintigraphic studies[J]. Journal of Controlled Release, 2002, 83(1): 65-74.
[14] QI Hong-yi, CHEN Wen-wen, HUANG Chun-yan, et al. Development of a poloxamer analogs/carbopol-based in situ gelling and mucoadhesive ophthalmic delivery system for puerarin.[J]. Int J Pharm, 2007, 337(337): 178-187.
[15] 杨辛欣. 眼部给药系统体内外评价方法的研究进展[J]. 中国新药杂志, 2009, 34(3): 1101-1104.
[16] GRATIERI T, GELFUSO G M, ROCHA E M, et al. A poloxamer/chitosan in situ forming gel with prolonged retention time for ocular delivery[J]. European Journal of Pharmaceutics & Biopharmaceutics, 2010, 75(2): 186-193.
Study on oph thalmic amphotericin B lipos omal in situ thermosensitive gel
DU Xiao-li, REN Wei-fang, MA Yue, FU Yang, SONG Juan, YANG Li
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveTo prepare ophthalmic Amphotericin B liposomal (AmB-L) in situ thermosensitive gel and study its in vitro properties.MethodsAmB-L in situ gel with poloxamer 407 (P407) and poloxamer 188 (P188) was prepared and the gelation temperature, rheological behavior and bioadhesive force were determined to choose the best formulation. The drug release rate of the in situ gels was determined using a membraneless model.ResultsThe best composition of gel base is w(P407)∶w(P188)=21∶2 with gelation temperature before and after tear dilution of (25.6 ± 0.2) ℃ and (34.3±0.3) ℃, separately. The viscosity of this gel base was low under ambient temperature but rises rapidly at temperatureof 35 ℃. It also has appropriate bioadhesive force. Drug release was linearly correlevant with gel erosion.ConclusionThe ophthalmic AmB-L in situ thermosensitive gel meets the requirements of ophthalmic application and the in vitro release behavior follows zero-order kinetics.
pharmaceutics; Amphotericin B liposome; In situ thermosensitive gel; gelation temperature; rheology; bioadhesive force; In vitro release
R94
A
(本篇责任编辑:赵桂芝)
(2015)05-0181-08
10.14146/j.cnki.cjp.2015.05.004
2015-03-30
杜晓俐(1987-), 女(汉族), 河北沧州人, 硕士研究生, E-mail 287044620@qq.com; *
: 杨丽(1966-), 女(汉族), 吉林集安人, 教授, 博士, 博士生导师, 主要从事药物新型给药系统的研究, Tel. 024-23986349, E-mail pharm305@126.com。

