红酵母超高压突变体的类胡萝卜素提取及特性研究
王岁楼,王海翔,杨志萍,吴晓宗
(中国药科大学食品科学与安全系,南京 211198)
以β-胡萝卜素为代表的类胡萝卜素具有抗氧化、抗肿瘤等许多重要的生理功能,在食品、药品及保健食品等领域用途广泛。利用红酵母发酵生产天然类胡萝卜素具有营养要求简单、培养周期短、菌体可综合利用等许多优点,但目前菌种发酵产率相对较低[1]。超高压处理是一种非常有希望的食品工业高新技术,它不仅被用于食品杀菌保藏和品质改良,近年来也被用于食品发酵工业微生物的诱变育种[2]。本研究通过超高压技术诱变获得了类胡萝卜素产量大幅度提高的红酵母突变体[3,4],并对其类胡萝卜素的提取分离方法及光热稳定性和抗氧化活性等进行了初步的研究。
1 材料与方法
1.1 菌种和培养基
菌种:酵母突变体,本实验室保藏,系超高压诱变获得。
培养基(每1 000 mL):琼脂培养基:葡萄糖20 g、蛋白胨20 g、酵母膏10 g、琼脂20 g,pH 值6.0;种子培养基:葡萄糖20 g、蛋白胨10 g、酵母膏10 g,自然pH;发酵培养基:葡萄糖25 g、酵母膏3 g、硫酸铵5 g、番茄汁2.5 mL、花生油0.5 mL,pH 值6.0。
1.2 类胡萝卜素提取分离和分析
发酵液离心获得酵母菌体,用蒸馏水洗涤,在70℃干燥至恒重。根据前期研究经验筛选了酸-热法、甲苯法、酶解法、自溶法和机械法5 种细胞破壁方法[5],并以丙酮为有机溶剂从细胞碎片中浸提类胡萝卜素色素,直到菌体颜色消退。将提取液离心分离,上清液用滤膜过滤。
上述类胡萝卜素粗提液通过硅胶柱色谱做进一步分离纯化后,采用薄层层析法(TLC)、紫外光谱法和HPLC 法进行定量定性分析,具体方法参考文献[6,7],结合实际略有改动。
1.3 稳定性和抗氧化性评价
按照文献[8]和[9]介绍的方法进行,略有改动。色素提取物的光、热稳定性通过比色法测定;体外抗氧化活性通过化学发光法测定,比较清除几种自由基的IC50值,其IC50值越大,表明其清除氧自由基能力越弱。
2 结果与讨论
2.1 从红酵母突变体提取类胡萝卜素
类胡萝卜素是红酵母的胞内产物,必须先进行破壁处理。表1 是采用不同破壁方法提取类胡萝卜素的产率,可见酸-热法是其中最好的。其机制可能主要是由于盐酸对细胞壁中原本结合紧密的多糖和蛋白质等物质具有强大的疏松作用,并结合沸水浴和速冷处理,使细胞壁结构被破坏,细胞内物质溶出。

表1 不同破壁方法类胡萝卜素产率
进一步根据L9(34)正交试验设计,获得了酸-热法破壁的最佳组合条件为:盐酸浓度2 mol/L,盐酸用量12 mL/g 细胞,盐酸浸泡时间40 min,沸水浴处理4 min。另一项研究表明,类胡萝卜素最佳提取溶剂为丙酮,其最佳用量为20 mL/g 干细胞。在以上确定的最优条件组合下,平均类胡萝卜素提取率可达718.1 μg/g 干细胞(表2)。

表2 最适破壁和浸提条件下类胡萝卜素提取结果
粗提物经柱分离纯化后,用TLC、紫外光谱和HPLC 进行分析,结果表明,该突变体酵母类胡萝卜素发酵产物中可能含有β-胡萝卜素,还可能含有园酵母素、红酵母红素及其他不常见的类胡萝卜素类物质(表3、表4),而这些类胡萝卜素的抗氧化、抗肿瘤活性目前还很少见文献报道,因此值得进一步深入研究。
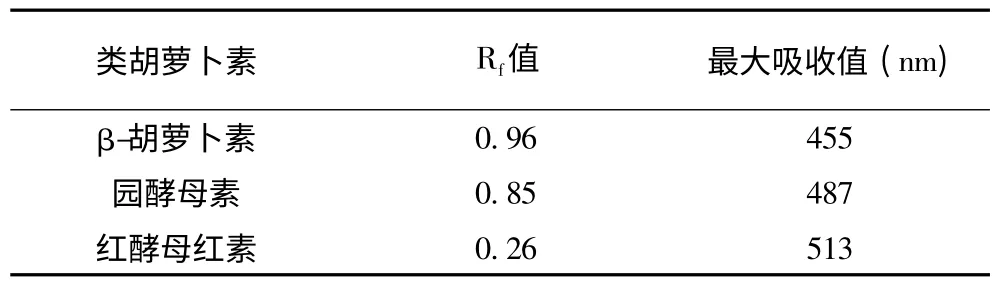
表3 薄层色谱和紫外光谱试验结果

表4 3 种类胡萝卜素标准混合物的HPLC 特性
2.2 类胡萝卜素提取物的光热稳定性及抗氧化活性
天然色素一般稳定性较差,严重制约了其实际应用。从表5、表6 可以看出,该类胡萝卜素提取物对光和热的稳定性好于以前报道的类似色素,这表明该酵母突变体的类胡萝卜素有很大的实用价值,但超高压处理后酵母色素光热稳定性改善的原因有待今后研究。
类胡萝卜素抗氧化活性是其最重要的功能特性,进行抗氧化作用研究是类胡萝卜素应用的基础。不同的类胡萝卜素其抗氧化活性不同,即使相同类胡萝卜素其来源不同,抗氧化活性也可能不同。从表7 可见,该色素提取物对3 种主要类型的氧自由基均有不同程度的清除作用,其中对·O-2 的清除能力最强,清除·OH 的能力次之,清除H2O2能力最弱。

表5 不同光源和照射时间对类胡萝卜素稳定性的影响(OD475)

表6 不同温度和加热时间对类胡萝卜素稳定性的影响(OD475)

表7 类胡萝卜素对3 种自由基的清除能力
3 结论
采用酸-热法破壁和丙酮为浸提溶剂,从红酵母超高压突变株提取类胡萝卜素是可行的。色素提取物经过初步分离纯化后,采用薄层色谱、紫外光谱和高效液相色谱进行分析,发现该色素提取物可能至少含有3 种类胡萝卜素成分,包括β-胡萝卜素、园酵母素及红酵母红素。稳定性实验结果表明,该色素光热稳定性良好,从体外自由基清除实验也可看出,色素提取物具有良好的抗氧化活性,因此值得进一步开发研究。
[1]王岁楼,步芬.红酵母发酵生产β-胡萝卜素[J].食品研究与开发,2010,31(12):250-254.
[2]王岁楼,王海翔.利用超高压选育食品与发酵微生物的研究进展[J].食品科学,2011,32(3):277-280.
[3]Wang SL,Sun JS,Han BZ.Optimization of β-carotene production by Rhodotorula glutinis using high hydrostatic pressure and response surface methodology [J].Journal of Food Science,2007,72(8):325-329.
[4]Wang SL,Chen DJ,Deng BW.Effects of high hydrostatic pressure on the growth and its β-carotene production of Rhodotorula glutinis [J].Yeast,2008,25(4):251-257.
[5]王岁楼,张鑫,张平之.红酵母类胡萝卜素的提取[J].食品与机械,2000,6:30-31.
[6]Bhosale PB,Gadre RV.Production of β-carotene by Rhodotorula glutinis mutant [J].Applied Microbiology andBiotechnology,2001,55:423-427.
[7]Bhosale PB.Studies on yeast Rhodotorula,its carotenoids and their applications [D].Pune:University OF Pune,2001.
[8]粟敏,谢达平,李帅.红酵母色素的稳定性和抗氧化性研究[J].中国食物与营养,2008,7:25-28.
[9]王伟霞,李福后.红酵母RY-8 菌株类胡萝卜素与SOD 的纯化及部分性质[J].食品科技,2009,34(8):19-22.

