杂交泡桐“毛白33”与其回交一代的光合特性比较1)
王楠 李芳东 莫文娟 王炜炜 叶金山
(国家林业局泡桐研究开发中心,郑州,450003)
杂交泡桐“毛白33”与其回交一代的光合特性比较1)
王楠 李芳东 莫文娟 王炜炜 叶金山
(国家林业局泡桐研究开发中心,郑州,450003)
为了比较自然条件下杂交泡桐“毛白33”(TF33)和其回交一代(BC1(194)、BC1(192))的光合生理差异,采用Li-6400 XT光合测定系统,分别测定了其生长季内6—10月份的净光合速率(Pn)、气孔导度(Gs)、胞间CO2摩尔分数、蒸腾速率(Tr)等光合参数的日变化,以揭示参试无性系的光合能力与主要生理生态因子的关系。结果显示:(1)6月份TF33的净光合速率日变化为双峰曲线,而BC1(194)和BC1(192)的为单峰型曲线,7—10月份参试无性系均为双峰型曲线且存在明显的“午休”现象。(2)6月份时BC1(192)叶片的最大净光合速率(Pmax)和光饱和点(PLS)显著高于BC1(194)和TF33,其超亲优势率分别为36.23%和34.49%,平均净光合速率(Pa)超亲杂种优势率为2.90%,光补偿点(PLC)和暗呼吸速率(Rd)差别不大。(3)7、8月份时,BC1(194)较TF33的光补偿点(PLC)和暗呼吸速率(Rd)有显著的负向优势。(4)10月份时BC1(194)和BC1(192)的表观量子效率和最大净光合速率显著高于TF33,光补偿点和暗呼吸速率显著低于TF33,Pa超亲杂种优势率分别为23.85%和5.52%。(5)除10月份TF33和BC1(194)的净光合速率与气孔导度相关不显著、BC1(192)的净光合速率与气孔导度呈极显著相关外,6—9月份净光合速率与气孔导度、蒸腾速率均呈极显著正相关(p≤0.01),午间净光合速率的降低可能是由气孔因素引起的。研究表明,整个生长季杂交泡桐回交一代只在生长初期和末期有显著的光合速率优势,其可能存在光合时间上的优势。
杂交泡桐;回交一代;光合参数日变化;光合生理;杂种优势
In order to compare photosynthetic physiological differences ofP.tomentosa(Thunb.) Steud ×P.fortunei(Seem.) Hemsl 33 and its backcrossed generation and reveal the relationship between photosynthetic capacity of trial clones and the main physiological and ecological factors under natural conditions, we measured photosynthetic and eco-physiological characteristics using a portable Li-6400XT Photosynthesis System made by LI-COR company in United States on sunny days from June to October in growing season. The photosynthetic parameters included net photosynthetic rate (Pn), stomatal conductance (GS), intercellular CO2concentration, and transpiration rate (Tr). The diurnal change of net photosynthetic rate of all tested materials had bimodal pattern and a clear midday depression from July to October except BC1(194)and BC(192)had unimodal type curve while TF33 had bimodal curve in June. The light saturation point and maximum net photosynthetic rate of BC1(192)were significantly higher than those of BC1(194)and TF33 in June, the transgressive heterosis rates were 36.23% and 34.49%, respectively. The transgressive heterosis rate of BC1(192)on average net photosynthetic rate was 2.90%, but there was no significant differences on light compensation point and dark respiration rate in June. The light compensation point and dark respiration rate of BC1(194)had prominent negative advantage than those of TF33 in July and August. The apparent quantum efficiency and maximum net photosynthetic rate of BC1(194)and BC1(192)were significantly higher than those of TF33, but the light compensation point and dark respiration rate were significantly lower than those of TF33 in October. At that time the transgressive heterosis rate of BC1(194)and BC1(192)on average net photosynthetic rate were 23.85% and 5.52%, respectively.Pnhad significantly positive correlation withGSandTrfrom June to September exceptPnof BC1(194)and TF33 were not significantly associated withGS,Pnof BC1(192)significantly correlated toGSin October (p≤0.01), and the reduction ofPnat noon might be caused by the stomatal factors. The backcross generation of hybridPaulowniahad significnt transgressive photosynthetic rate advantage only at the beginning and at the end of growing season. The backcrossed generation had photosynthetic time advantage.
光合作用是地球上最为重要的化学反应,对植物生长发育有着重要意义[1]。目前光合作用能力已经作为主要的评价指标,广泛应用于良种选育[2-4]。光合日变化特征是判断杂交种杂种优势强弱的依据之一,对进一步分析杂种优势光合性能的生态环境适应性十分重要[5]。
泡桐(Paulownia)是原产我国的重要用材速生树种之一。国内学者自1972年开展泡桐属的杂交育种工作,经过多年的培育和选择,育成的杂种苗在生长量、抗病性和适应性等方面明显优于亲本[6]。其中,毛白33(P.tomentosa(Thunb.) Steud×P.fortunei(Seem.) Hemsl 33,简称TF33)是以“毛泡桐×白花泡桐”杂交获得的优良无性系,其不但生长迅速而且抗病性强[7]。叶金山等在前人杂交育种的基础上,于2012年首次进行了以TF33为母本、白花泡桐(P.fortunei(Seem.) Hemsl)为父本的回交选育,并成功获得一批回交无性系。目前国内外对杂交泡桐的研究仅限于杂交策略、区域栽培试验、木材理化性质和分子生物学等方面,其光合等生理生态性能的相关研究较少[8-18]。本研究对杂交泡桐及其回交一代光合性能的日变化特征进行了分析,并探讨了光合能力与主要生理生态因子的关系,以期为深入探索泡桐杂种无性系的遗传改良提供科学依据。
1 材料与方法
试验材料为1年生杂交泡桐TF33(Paulowniatomentosa×P.fortunei33)及其回交一代BC1(194)和BC1(192)的根生苗。试验分别于2014年6—10月下旬在泡桐中心院内苗圃地进行,试验地为暖温带大陆性气候,年平均气温为14.3 ℃,年平均降水量为640 mm,全年日照时间约2 400 h,无霜期215 d。
1.1 测定指标及方法
Li-6400XT开路式光合测定系统(美国LI-COR公司生产),选择晴朗无云的天气进行光合日变化的测量。每个无性系分别选取4株长势一致的健康幼苗,选择向阳面的第3~4片完全展开叶,每株3次重复,每叶片记录3组稳定数据(共36次重复)。从08:00—18:00每2h按相同测量顺序测定1次叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2摩尔分数(Ci)、蒸腾速率(Tr)、光合有效辐射(RPA)、空气相对湿度(HR)、叶片温度(Tl)、空气温度(Ta)和大气CO2摩尔分数(Ca)等光合生理生态指标。数据处理时取平均值作为该时刻的实测值。随机选择2株进行光响应曲线测定,每株选取1个与测定日变化相同的叶片,取平均值。采用红蓝LED光源,光合有效辐射从高到低依次设定为2 000、1 800、1 500、1 200、1 000、800、600、400、200、100、50、20、0 μmol·m-2·s-1,CO2摩尔分数为400 μmol·mol-1。系统自动测定响应的净光合速率等光合指标,取值时间间隔大于180 s。用直角双曲线修正模型[19]拟合Pn-RPA响应曲线,其表达式为:
式中:α代表光响应曲线的初始斜率,β为修正系数,γ是与光强无关的系数,Rd为暗呼吸速率。由表达式可确定最大净光合速率(Pmax)、光饱和点(PLS)和光补偿点(PLC)等光合参数。
1.2 数据分析
光能利用效率(ELU),ELU=Pn/RPA;气孔限制值(Ls),Ls=1-Ci/Ca;由最优亲本(Pb)计算杂种优势率:RH=((F1-Pb)/Pb)×100%。利用Excel 2010和SPSS 17.0 统计软件进行光响应曲线的拟合及光合参数的计算。
2 结果与分析
2.1 杂交泡桐生长季的净光合速率日变化特征气孔导度
除BC1(194)和BC1(192)在6月份的净光合速率为单峰型、TF33为双峰型曲线外, 3个无性系在7—10月份的净光合速率均为双峰型曲线且存在明显的“午休”现象;3个无性系6—10月份均于08:00达到最大光能利用效率(ELU)(图1)。从净光合速率的变化看出,6、7月份的净光合速率变化较平缓;8月份的光合“午休”现象明显,但能在午后迅速恢复达到第2个峰值;虽然9月份和10月份的净光合速率较8月份有所下降,但仍能维持较高的光合生产能力。整个生长季,BC1(192)的平均净光合速率(Pa)在6月和10月的超亲杂种优势率分别为2.90%和23.85%,BC1(194)的Pa在10月的超亲杂种优势率为5.52%,其他月份BC1(194)和BC1(192)的Pa均低于TF33,表现为杂种劣势。BC1(194)和BC1(192)在生长初期(6月)和生长末期(10月)的优良表现表明,其极有可能存在光合时间上的优势。
2.2 杂交泡桐生长季的光响应曲线及相关参数变化
表1反映了BC1(194)、BC1(192)和TF33在整个生长季内6—10月份净光合速率和光合有效辐射的变化关系。光饱和点(PLS)和光补偿点(PLC)的大小代表植物的需光特性,是判断植物是耐阴植物还是阳性植物的重要指标。阴生植物通常有较低的光补偿点和较高的表观量子效率(AQY),而阳生树种具有高补偿点、高饱和点和较强的固氮能力等特征[20-21]。整个生长季BC1(194)、BC1(192)和TF33均有较高的光饱和点(1 231.56~1 923.30 μmol·m-2·s-1)和光补偿点(36.73~63.16 μmol·m-2·s-1),可见泡桐是强阳性树种。
由表1 可知,6月份时BC1(192)叶片的最大净光合速率(Pmax)和光饱和点(PLS)显著高于BC1(194)和TF33,超亲优势率分别为36.23%和34.49%;光补偿点(PLC)和暗呼吸速率(Rd)差别不大;在7、8月份时,BC1(194)的光补偿点、暗呼吸速率显著高于TF33,表明BC1(194)较TF33的光补偿点和暗呼吸速率有负向优势;10月份时 BC1(194)和BC1(192)的表观量子效率和最大净光合速率显著高于TF33,光补偿点和暗呼吸速率显著低于TF33。
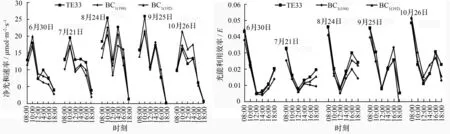
图1 生长季内3个无性系在6—10月份的净光合速率与光能利用效率日变化
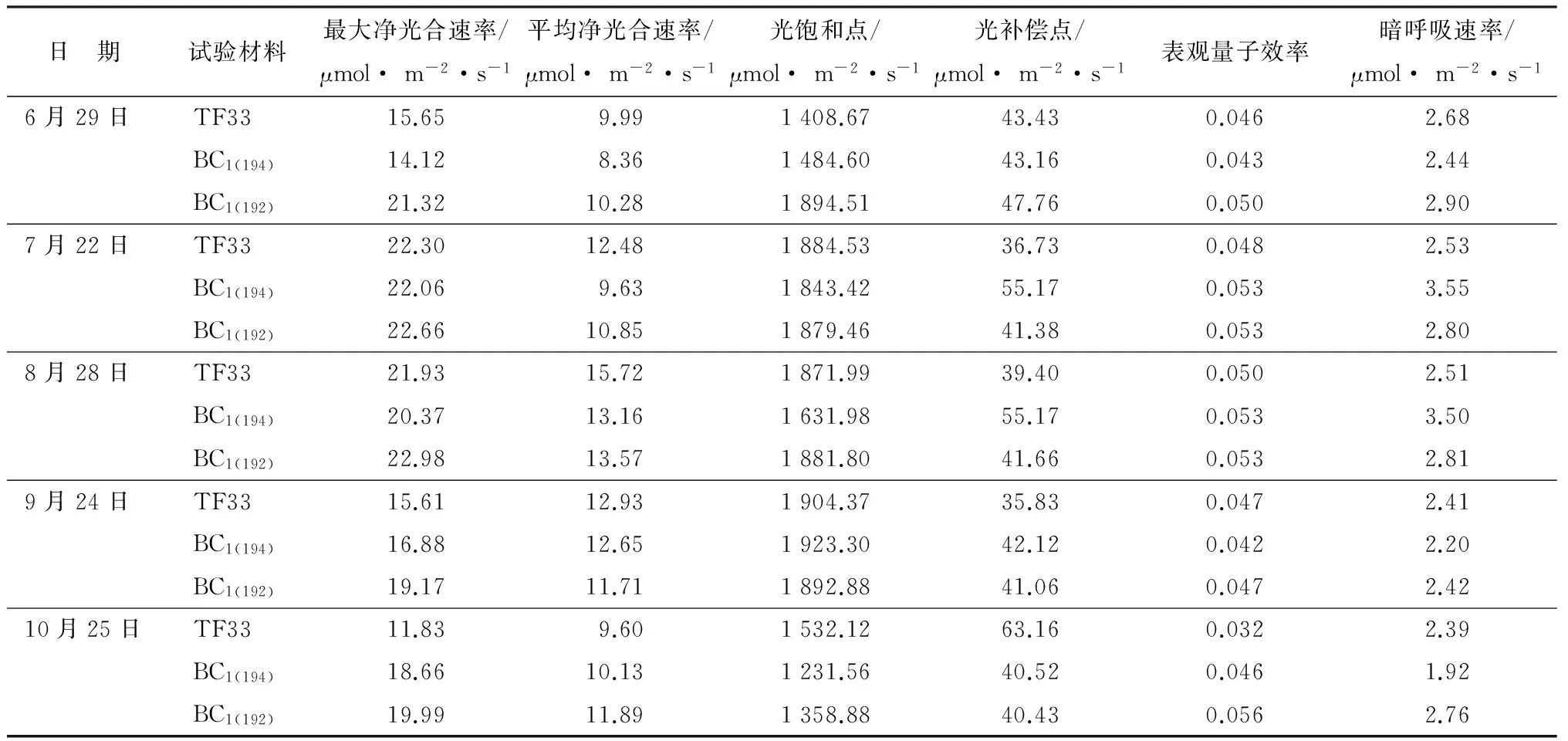
表1 光合—光响应曲线相关参数
2.3 净光合速率与主要生理生态因子的关系
2.3.1 净光合速率与主要生理生态因子的相关性
由表2知,6—9月份BC1(194)、BC1(192)和TF33的净光合速率与气孔导度、蒸腾速率均呈极显著正相关,可见气孔导度和蒸腾速率是影响净光合速率的重要生理因素。6月份 3个无性系的净光合速率均与胞间CO2摩尔分数、大气CO2摩尔分数(除BC1(192))呈极显著正相关,与光合有效辐射呈不显著的正相关;7月份后光合有效辐射与胞间CO2摩尔分数和空气中CO2摩尔分数的关系转为显著或不显著的负相关,与光合有效辐射的关系则呈显著或极显著正相关。6—7月份(除BC1(194))净光合速率与空气相对湿度呈正相关,与空气温度呈负相关,8—10月份则与空气相对湿度呈负相关,与空气温度呈正相关。
2.3.2 杂交泡桐生长季环境因子日变化特征
生长季光合有效辐射(RPA)、大气温度(Ta)和叶片温度(Tl)的变化趋势相似,均为单峰型日进程(图2)。7月份的最大光合有效辐射最高,为1 466.83 μmol·m-2·s-1,8月份次之(1 353.26 μmol·m-2·s-1),10月份最低,为1 044.72 μmol·m-2·s-1。空气相对湿度(HR)与光合有效辐射、温度的变化相反,随着太阳辐射的增强和温度的逐渐上升而下降,午后有所回升。4个月份内的大气中CO2摩尔分数日变化幅度差异较小,均呈现先下降后上升的趋势。10月份的大气CO2摩尔分数最高,9月份次之,7月份最低。大气中CO2摩尔分数在早上08:00最高,之后降低,此期间达到最低值的时间略有不同,傍晚又逐渐升高。
2.3.3 影响净光合速率的光合生理参数日变化特征
蒸腾速率(Tr)的日变化规律与光合有效辐射、空气相对湿度、空气温度和气孔导度等因素有关。由图3知,7月份蒸腾速率最高,尤其是BC1(192),在10:00—14:00一直维持较高的蒸腾速率,8月份后蒸腾速率又低于BC1(194)和TF33,10月份 BC1(194)和BC1(192)的蒸腾速率整体高于TF33。由蒸腾速率和净光合速率的日变化趋势可知,光合速率和蒸腾速率存在一定的协同变化关系。
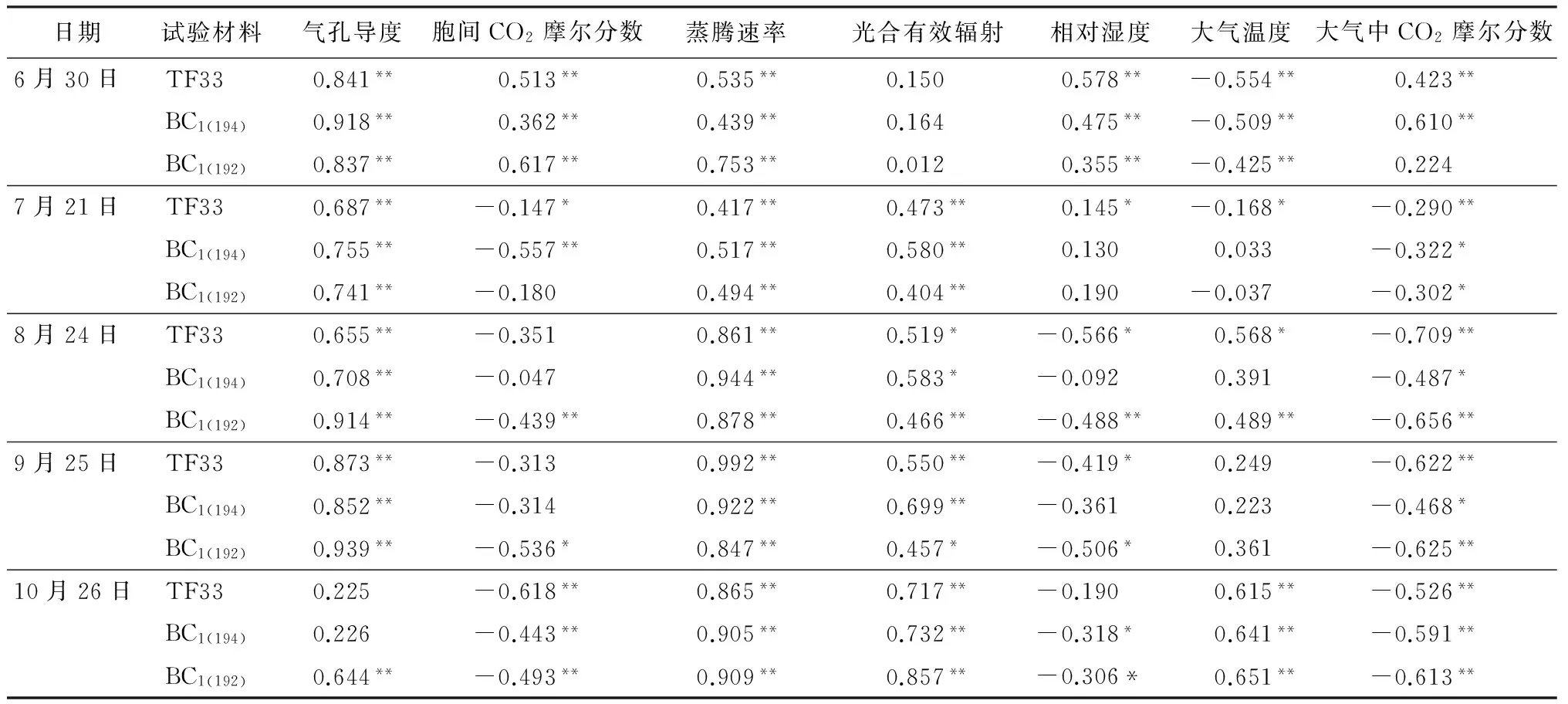
表2 净光合速率与主要生理生态因子的相关系数
注:*和** 分别表示相关性在0.05和0.01水平显著。
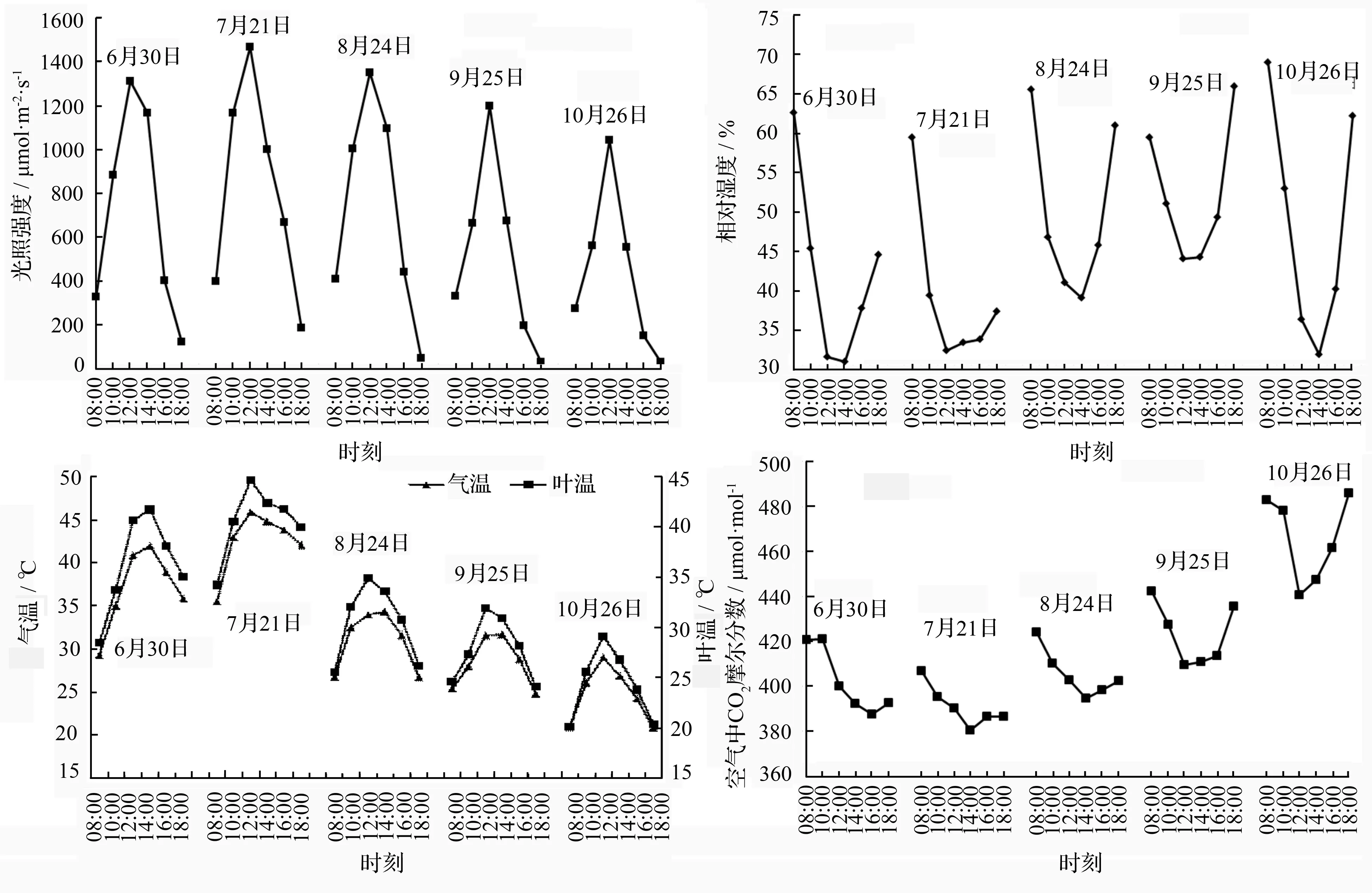
图2 生长季内各月份3个无性系的光合参数日变化
胞间CO2摩尔分数与大气中CO2摩尔分数日变化趋势相似,均呈现中间低两头高的趋势。7月份的胞间CO2摩尔分数变化最为平缓,在268.99~344.28 μmol·mol-1之间波动,9月份以后,傍晚的胞间CO2摩尔分数值升高,可能是因为进入秋季以后,昼越来越短,光合辐射强度开始变低,到傍晚时植物的光合作用变得十分微弱,呼吸作用增强,使得胞间CO2摩尔分数值逐渐变高。由此胞间CO2摩尔分数值与光合作用关系密切。
泡桐的气孔导度(Gs)较高,8月份TF33最高达到1.57 mmol·m-2·s-1,而此时BC1(194)和BC1(192)的气孔导度值分别是0.60和0.45 mmol·m-2·s-1(图4)。除8月份气孔导度日变化出现第一个峰值的时间与净光合速率达到最大值的时间不同、10月份的净光合速率与气孔导度的关系不显著外,其他月份的气孔导度日变化趋势与净光合速率日变化基本一致。表明气孔导度日变化是净光合速率日变化的重要调节因素之一。
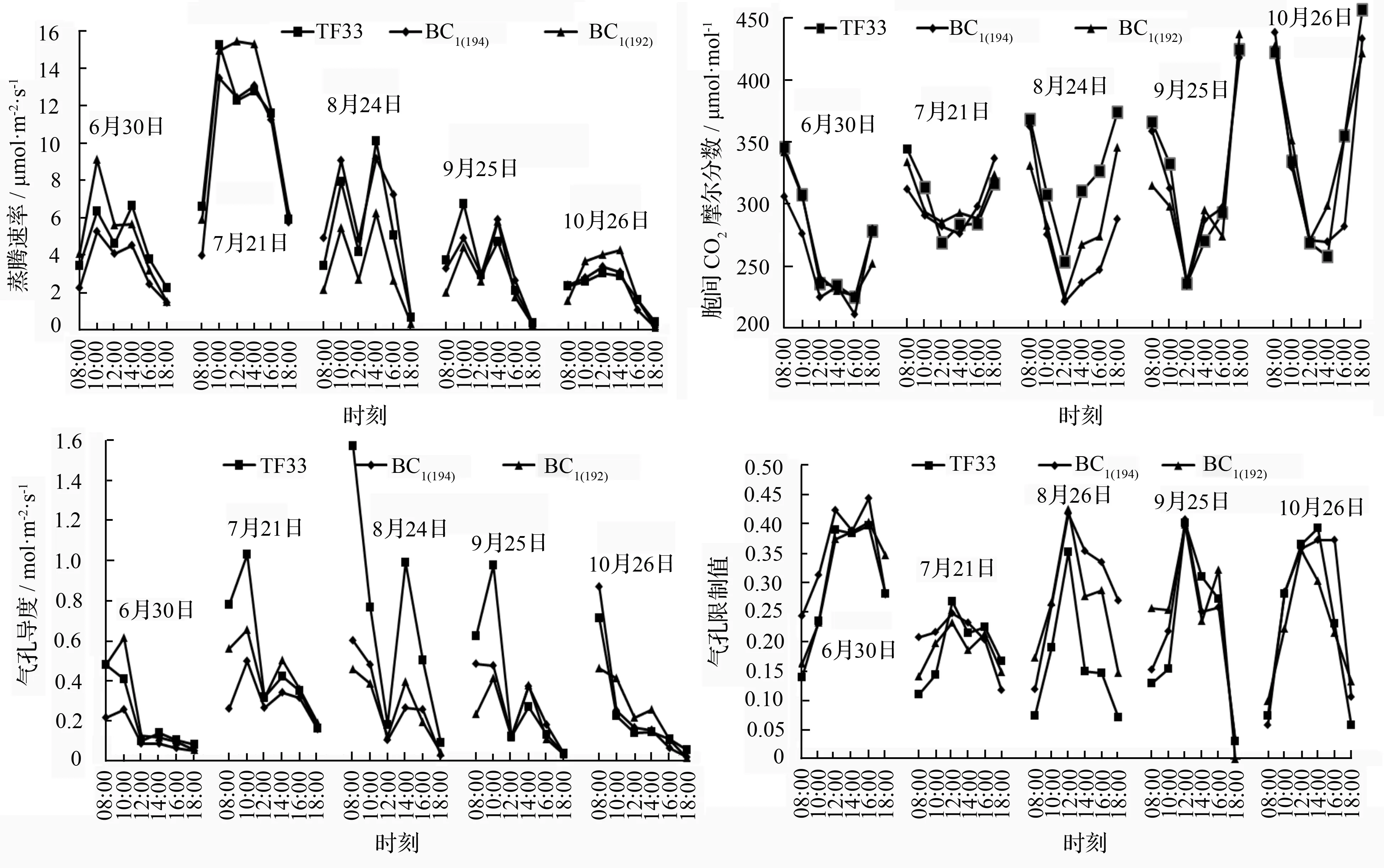
图3 生长季内各月份3个无性系的光合参数日变化
3 结论与讨论
3.1 生长季内杂交泡桐光合能力优势的探讨
杂交泡桐上午的光合速率要高于下午的光合速率,这是因为整个生长季下午的温度要远高于上午的温度,较高的温度在减小气孔导度的同时也减少了蒸腾散热,从而使叶片温度过高,最终导致净光合速率值的下降。此外,还有可能在一定程度上受内部生物钟的控制,植物经过一晚上呼吸消耗使得早上空气中的CO2摩尔分数最高,白天随着光合有效辐射和温度的升高,大气相对湿度的降低,光合作用不断进行,大气中的CO2摩尔分数逐渐降低,傍晚虽有所回升,但是显著低于早晨的CO2摩尔分数,从而使早上净光合速率显著高于下午的净光合速率。兰小中等[22]对西藏巨柏、刁松锋等[23]对无患子的研究也得到同样的结论。
植物生理学已经阐明生物产量是植物一生中所生产的总光合产量减去植物一生中主要通过呼吸作用所消耗的有机物,而光合产量决定于光合面积、光合强度和光合时间3个因素。从整个生长季看,正常管理环境下,除6月份和10月份外,其他月份回交种较亲本没有显著的光合速率优势,从理论上推测回交种幼苗在生长季很有可能具有光合时间和光合面积优势。这与叶金山等[24]的研究结果一致。此外,本研究没有进行与父本纯种的比较,所以不排除回交种具有中亲光合杂种优势的可能。光合作用是一个至少包括几十个步骤的复杂过程,杂交泡桐不可能因回交提高所有的光合速率指标,也体现了植物光合性状改良的复杂性。
本研究中回交一代BC1(194)和BC1(192)的光合效率虽然在7—9月份没有表现出显著的超亲优势,但在林地极端干旱的环境下观察到其有显著的生长性状超亲优势,这与叶金山等[24]在解释林木杂种优势成因的“光合优势假说”的观点相吻合。该假说认为胁迫环境下杂种树木在物质代谢、能量转化、信息传递和形态建成等方面存在有利用改善或提高光合作用的因素,这些有利因素的复合优势导致光合能力优势并最终促使杂种表现出生长、产量、抗性和适应性的优势。而这些存在于杂种树木的有利因素在非胁迫环境下可能不起作用或者作用不大。该假说已在后续试验中被进一步证明。
3.2 影响杂交泡桐净光合速率的生理生态因子
影响光合有效辐射的生理生态因子主要有气孔导度、胞间CO2摩尔分数、蒸腾速率、光合有效辐射、空气相对湿度、空气温度和空气中CO2摩尔分数等,这些因子之间相互作用,构成对净光合速率的综合性影响。除6月份的净光合速率值与光合有效辐射呈不显著的正相关外,其他月份净光合速率与光合有效辐射均呈显著或极显著正相关,表明光合有效辐射可能是光合作用的有效驱动力。净光合速率与空气相对湿度、空气温度在不同月份之间相关性的变化,表明温度和相对湿度是影响泡桐光合速率的重要因素。从净光合速率与生理因子的相关分析发现,6—9月份净光合速率与气孔导度、蒸腾速率均呈极显著相关。说明在整个光合作用中,杂交泡桐的气孔对气体交换发挥着重要的调控作用。
Farquhar等[25]认为,导致净光合速率下降的原因有气孔限制和非气孔限制两方面因素,一般用胞间CO2摩尔分数和气孔限制值的变化趋势来判别。当净光合速率和气孔导度同时下降时,若伴随胞间CO2摩尔分数降低和气孔限制值的增大,则为气孔限制,若胞间CO2摩尔分数增大或不变而气孔限制值减小时,则为非气孔限制。由净光合速率与气孔导度、胞间CO2摩尔分数、气孔限制值的关系可知杂交泡桐午间净光合速率的降低可能主要是由气孔因素引起的。许大全等在研究大豆光合速率日变化发现,中午光合速率的下降,可能是午间光合辐射过强造成的光抑制[26];在研究毛竹时认为低的空气湿度和轻微水分胁迫下,气孔导度的下降是净光合速率降低的主要原因[27]。Salvucci等[28]认为可能是在午间高光强高温低湿等不利环境导致了气孔关闭,从而引发的“午休”现象。本研究认为杂交泡桐中午净光合速率下降是受外部因素和内部因素综合影响所致,中午的高光强高温低湿环境造成了大气—叶片蒸汽压梯度增加,使得部分气孔关闭,引起气孔导度和胞间CO2摩尔分数的下降以及气孔限制值的增大,最终导致净光合速率的下降。
[1] 许大全.光合作用学[M].北京:科学出版社,2013.
[2] 许晨璐,孙晓梅,张守攻.日本落叶松与长白落叶松及其杂种光合特性比较[J].北京林业大学学报,2012,34(4):62-66.
[3] 张斌斌,姜卫兵,韩键,等.桃光合性能杂种优势的秋季日变化特征[J].中国生态农业学报,2011,19(1):82-86.
[4] Gao D, Gao Q, Xu H Y, et al. Physiological responses to gradual drought stress in the diploid hybrid Pinus densata and its two parental species[J]. Trees Structure and Function,2009,23(4):717-728.
[5] 李霞,丁在松,李连禄,等.玉米光合性能的杂种优势[J].应用生态学报,2007,18(5):1049-1054.
[6] 熊耀国,赵丹宁.泡桐遗传改良[M].北京:中国科学技术出版社,1995.
[7] 蒋建平.泡桐栽培学[M].北京:中国林业出版社,1990.
[8] 河南省泡桐杂种优势利用协作组.泡桐杂种优势利用[J].中国林业科学,1977(3):24-28.
[9] 河南省豫林一号泡桐选育协作组.豫林一号泡桐的杂种优势[J].林业科学,1989,25(5):467-471.
[10] 谭伯禹,蒋建平,竺肇华.泡桐文集[M].北京:中国林业出版社,1982.
[11] 中国林业科学研究院泡桐组河南省商丘地区林业局.泡桐研究[M].北京:中国林业出版社,1982.
[12] Silvestre J D, Evtuguin V, Mendes P, et al. Lignans from a hybridPaulowniawood[J]. Biochemical Systematics and Ecology,2005,33(12):1298-1302.
[13] Goncalves V M F, Evtuguin D V, Domingues M R M. Structural characterization of the acetylated heteroxylan from the natural hybridPaulowniaelongata/Paulowniafortunei[J]. Carbohydrate research,2008,343(2):256-266.
[14] 邱乾栋,莫文娟,王楠,等.白花泡桐材色优良单株的选择[J].林业科学研究,2014,27(2):277-283.
[15] Wang W Y, Pai R C, Lai C C, et al. Molecular evidence for the hybrid origin ofPaulowniaTaiwanianabased on RAPD markers and RFLP of chloroplast DNA[J]. Theoretical Applied Genetics,1994,89(2/3):271-275.
[16] Kumar P P, Rao C D, Rajaseger G, et al. Seed surface architecture and random amplified polymorphic DNA profiles ofPaulowniafortunei,P.tomentosaand their hybrid[J]. Annals of Botany,1999,83(2):103-107.
[17] 崔令军.泡桐无性系苗期光合与生长特性研究[D].北京:北京林业大学,2007.
[18] 王艳梅,牛晓峰,刘震,等.泡桐生长停止和顶芽死亡过程中的光合特性研究[J].北京林业大学学报,2009,31(6):121-127.
[19] Ye Z P. A new model for relationship between irradiance and the rate of photosynthesis inOryzasativa[J]. Photosynthetica,2007,45(4):637-640.
[20] Scholes J D, Press M C, Zipperlen S W. Differences in light energy utilisation and dissipation between dipterocarp rain forest tree seedlings[J]. Oecologia,1996,109(1):41-48.
[21] Senevirathna A, Stirling C M, Rodrigo V H L. Growth, photosynthetic performance and shade adaptation of rubber (Heveabrasiliensis) grown in natural shade[J]. Tree Physiology,2003,23(10):705-712.
[22] 兰小中,廖志华,王景升.西藏高原濒危植物西藏巨柏光合作用日进程[J].生态学报,2005,25(12):3172-3175.
[23] 刁松锋,邵文豪,董汝湘,等.无患子光合生理日变化及其与生理生态因子的关系[J].西北植物学报,2014,34(4):828-834.
[24] 叶金山,王章荣.杂种马褂木杂种优势的遗传分析[J].林业科学,2002,38(4):67-71.
[25] Farquar G D, Sharkey T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology,1982,33(1):317-345.
[26] 许大全,徐宝基,沈允钢.C3植物光合效率的日变化[J].植物生理学报,1990,16(1):1-5.
[27] 许大全,李德耀,邱国雄,等.毛竹(Phyllostachyspubescens)叶光合作用的气孔限制研究[J].植物生理学报,1987,13(2):154-160.
[28] Salvucci E, Crafts J. Inhibition of photosynthesis by heat stress: the activation state of rubisco as a limiting factor in photosynthesis[J]. Physiologia Plantarum,2004,120(2):179-186.
Comparison in Photosynthetic Characteristics of “Paulowniatomentosa(Thunb.) Steud×P.fortunei(Seem.) Hemsl 33” and Its Backcrossed Generation
Wang Nan, Li Fangdong, Mo Wenjuan, Wang Weiwei, Ye Jinshan(Paulownia Research and Development Center of State Forestry Administration, Chinese Academy of Forestry, Zhengzhou 450003, P. R. China)//Journal of Northeast Forestry University,2015,43(6):51-56.
HybridPaulownia; Backcrossed generation; Diurnal variation of photosynthetic pararneters; Photosynthetic characteristics; Heterosis
王楠,女,1988年6月生,国家林业局泡桐研究开发中心,硕士研究生。E-mail:wwangnan@163.com。
叶金山,国家林业局泡桐研究开发中心,研究员。E-mail:yejinshan371@163.com。
2014年10月31日。
S792.43
1)“十二五”科技支撑项目(2012BAD01B0602)。
责任编辑:潘 华。

