α-蒎烯对黄粉虫体内3种保护酶活性的影响
王 慧,马 玲,孟庆坤,崔荣林
(1.东北林业大学林学院,林木遗传育种与生物技术教育部重点实验室,黑龙江哈尔滨150040;
2.黑龙江省七台河市林业局,黑龙江七台河154600)
α-蒎烯是多种植物精油活性成分的重要组成部分,具有很强的抑菌性、杀虫活性,是植物挥发性有机化合物[1-3]。α-蒎烯以及含有α-蒎烯的植物精油对储藏物害虫、大田害虫、森林害虫和某些病菌均具有较强的生物活性。在综合防治有害生物的领域中,α-萜品醇有着重要的研究价值和广阔的综合利用空间,其对有害生物的作用机理可为有害生物综合治理提供新的方法和理论依据。
外源物对生态系统的影响最初是从个体分子开始,然后在细胞、器官、个体、种群、群落、生态系统等各个层面上逐步表现出来,是现代毒理学的观点[4]。目前,利用农药对昆虫体内SOD、POD、CAT等产生的影响,已在农药评价中得到广泛的应用和良好的验证。因此,研究α-蒎烯对黄粉虫体内生物化学标志物(SOD、POD、CAT)的影响,明确该种外源物浓度与主要酶活性的关系,对于研究其对昆虫的致毒机理具有重要意义。为此,笔者采用熏蒸法测定了α-蒎烯对黄粉虫幼虫的急性毒性,并测定了对其体内SOD、POD、CAT 3种酶活性的影响,旨在为研究α-蒎烯的杀虫活性与作用机理提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试药剂。α-蒎烯购自美国Sigma公司。
1.1.2 供试昆虫。黄粉虫(Tenebrio molitor)和麦麸均购自黑龙江哈尔滨市大发花鸟鱼市场,将黄粉虫置于(23±2)℃、相对湿度70%的生化培养箱中以麦麸喂养,驯化15 d后挑选大小一致、健康的黄粉虫幼虫供试验用。
1.1.3 试剂。购自Amresco公司的包括苯甲基磺酰氟(PMSF)、牛血清白蛋白、考马斯亮蓝G-250、乙二胺四乙酸、二硫苏糖醇、核黄素、还原型谷胱甘肽、对硝基苯酚和对硝基苯酚磷酸二钠等;购自Sigma公司的包括毒扁豆碱、固蓝B盐,1-氯-2,4-二硝基苯(CDNB)等;购自天津市光复精细化工研究所的有愈创木酚;购自国药集团化学试剂有限公司的有过氧化氢、α-乙酸萘酯、硝基氮蓝四唑、L-甲硫氨酸、苯酚等。1.1.4 仪器。玻璃匀浆器(黑龙江省誉航科学器材有限公司)、HPG-400BX 400HX光照培养箱(黑龙江哈尔滨东联电子技术开发有限公司)、电热恒温水浴锅(上海森信实验仪器有限公司)、TH-500BQ超声波清洗仪(山东济宁天华超声波电子仪器有限公司)、Cary 100/300双光束紫外可见分光光度计(美国瓦里安中国有限公司)。
1.2 方法
1.2.1 急性毒力测定。采用广口瓶密闭熏蒸法[5]。
1.2.2 致毒处理设置。以 α-蒎烯对黄粉虫幼虫48 h的LC50为基准[6],用蒸馏水配制 LC20,设置不施药的 12、24、36、48 h黄粉虫幼虫为空白对照,选取健康、大小、颜色一致的黄粉虫幼虫,每组100头,每浓度处理3次重复。处理后12、24、36、48 h分别从每个浓度处理中随机挑选10头幼虫作为样本,存放于-80℃冰箱中,供酶活性测定。
1.2.3 酶液制备。随机选取经过药剂处理的黄粉虫幼虫10头,加预冷的提取液5 ml,并置于玻璃匀浆器内冰浴,再充分匀浆,然后采用4℃高速离心,上清液即酶液。SOD、POD、CAT所用匀浆液和离心参数如下:匀浆液为0.05 mol/L PBS,离心力为 15079 ×g,离心 30 min[7]。
1.2.4 蛋白质含量测定。参照Bradford(1976)的考马斯亮蓝 G-250 法[8]。
1.2.5 昆虫体内酶活性测定。
1.2.5.1 SOD 活性测定。参照 Beauchamp 等的方法[9],略有改进。3.0 ml反应液[含 50.0 mmol/L PBS(pH7.8),13.0 mmol/L Met,0.1 mmol/L EDTA,75 μmol/L NBT],加入25 μl粗酶液,最后加入0.6 ml 0.5 mmol/L核黄素,以不加酶液管作为最大光还原管,在25℃光照培养箱中三级光照下(4 000 lx)处理15 min后立即避光测定OD560值。
1.2.5.2 POD 活性测定。参照 Simon 等的方法[10],略有改进。3.0 ml反应体系中含100.0 mmol/L磷酸缓冲液(pH 6.0)、30.0 mmol/L 愈创木酚、26.0 mmol/L 过氧化氢和150.0 mmol/L酶液,反应5 min,在470 mm波长处测定OD值。
1.2.5.3 CAT 活性测定。参照Cohen 方法[11]。取0.5 ~0.6 ml 30% 过氧化氢,加水至 50 ml,从中取出 4.0 ml,加入 26.0 ml 0.05 mol/L PBS(pH 7.0),测定240 nm 波长处的 OD 值,如其OD值在0.50~0.55,即作为CAT的底物溶液,再取3.0 ml配制的底物溶液,并在25℃下加入20μl粗酶液,然后立即用紫外分光光度计在240 nm波长下每隔30 s读一次,记录3 min。
1.2.6 数据处理。用Excel绘图。运用SPSS16.0软件中的Duncan’s方法进行差异显著性分析。
2 结果与分析
2.1 α-蒎烯对黄粉虫幼虫的毒力 由表1可知,α-蒎烯对黄粉虫幼虫 12、24、36 和 48 h 的 LC50分别为 101.434、67.518、57.810 和44.120 μg/L,随作用时间的延长 LC50逐渐降低,表明α-蒎烯对黄粉虫的毒性作用随时间的增加而逐渐加强。选择α-蒎烯48 h的LC50和LC20作为处理浓度,测定α-蒎烯对黄粉虫幼虫7种酶的影响。为反应迟钝,用探针轻触后不能正常反应,从症状来看应该是麻醉后又苏醒的幼虫。
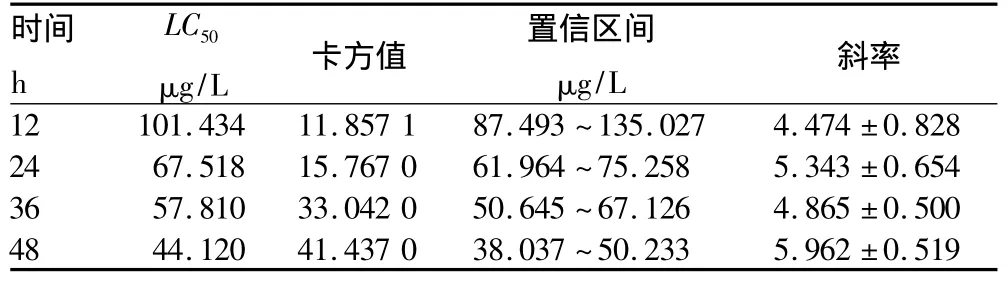
表1 α-蒎烯对黄粉虫幼虫的毒力
2.3 α-蒎烯对黄粉虫体内SOD活性的影响 由图1可知,黄粉虫幼虫经 LC20、LC50浓度的 α-蒎烯处理 12、24、36、48 h后,体内SOD酶活性均显著低于对照。LC20、LC50浓度的α-蒎烯最大抑制率分别出现在36和48 h,最大抑制率分别为对照的50.96%和49.48%。
2.2 中毒症状 在熏杀试验中观察到,在接入广口瓶初期幼虫均表现出不同程度的兴奋症状,如翻滚、跳跃、快速爬行等;随着作用时间的延长,幼虫行动都渐趋缓慢,直至静止不动(也有被麻醉的可能性)。经过12、24、36、48 h后分别观察记录,处理组的部分幼虫出现虫体变黑,抽搐、痉挛的现象,并且偶有吐水的现象,虫体失水变软、萎缩,最后直至死亡;处理组的少部分幼虫被麻醉但没有完全死亡,活动缓慢且行
2.4 α-蒎烯对黄粉虫体内POD活性的影响 由图2可知,黄粉虫幼虫经 LC20、LC50浓度的 α-蒎烯处理 12、24、36、48 h后,除LC20、LC50浓度的α-蒎烯12 h酶活性高于对照外,体内POD酶活性均低于对照。LC20、LC50浓度的α-蒎烯最大抑制率分别出现在36和48 h,最大抑制率分别为对照的40.74%和14.75%。随着处理时间的延长,用LC20浓度的α-蒎烯处理后的幼虫体内POD酶活性表现为先降低后升高的趋势,而LC50浓度的α-蒎烯处理后幼虫体内POD酶活性表现为下降趋势。
2.5 α-蒎烯对黄粉虫体内CAT活性的影响 由图3可知,黄粉虫幼虫经 LC20、LC50浓度的 α-蒎烯处理 12、24、36、48 h后,体内CAT酶活性均显著低于对照。LC20、LC50浓度的α-蒎烯最大抑制率分别出现在36和48 h,其最大抑制率分别为对照的34.62%和35.64%。
3 结论与讨论
试验表明,α-蒎烯的LC20、LC50浓度对黄粉虫体内超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)12、24、36、48 h的影响虽然存在差异性,但均表现出具有抑制功能。综合时间-剂量效应及酶受到抑制的程度,3种酶对α-蒎烯胁迫的敏感性从大到小依次为SOD、POD、CAT。关系尚需进一步研究。
α-蒎烯能够影响黄粉虫幼虫体内SOD、POD和CAT的活性,并且随着处理时间的延长和浓度的增加呈现出一定的时间-浓度效应,幼虫体内的SOD、POD和CAT均表现为抑制作用,导致幼虫体内平衡受到破坏,自身生理机能下降,最终导致幼虫的死亡。该3种保护酶均参与了黄粉虫幼虫对α-蒎烯的应答机制,而关于α-蒎烯与该3种酶系基因水平的
[1]凌育赵,曾满枝,陈祖佑,等.沙姜挥发油化学成分的GC/MS分析[J].河南工业大学学报:自然科学版,2006,27(1):75-76.
[2]YANG X W,ZHANG P,TAOH Y,et al.GC-MS analysis of essential oil constituents from rhizome and root of notopterygium for besii[J].Journal of Chinese Pharmaceutical Sciences,2006,15(4):200 -205.
[3]何益良,王黎明.α-蒎烯大气化学反应的研究进展[J].化学研究,2008,19(2):97-101.
[4]徐立红,张甬元,陈宜瑜.分子生态毒理学研究进展及其在水环境保护中的意义[J].水生生物学报,1995,19(2):171 -184.
[5]张海燕,邓勇学,王进军,等.植物精油对谷蠹成虫熏蒸活性的研究[J].西南农业大学学报:自然科学版,2004,26(2):423 -425.
[6]王慧.3种蒿属植物杀虫成分提取及制剂配制[D].哈尔滨:东北林业大学,2012:44,97.
[7]葛士林.取代苯对红裸须摇蚊生物标志物系统的影响[D].哈尔滨:东北林业大学,2011:24.
[8]BRADFORDM M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding[J].Analytical Biochemistry,1976,72(2):248 -254.
[9]BEAUCHAMPCO,FRIDOVICH I.Superoxide dismutase:improved assays and an assay applicable to acrylamidae gels[J].Analytical Biochemistry,1971,44:276 -287.
[10]高鹏.二化螟对几种杀虫剂的抗药性研究[D].雅安:四川农业大学,2010:24.
[11]COHEN G P,DEMBIECK D,MARCUS J,et al.Measurement of catalase activity in tissue extracts[J].Analytical Biochemistry,1970,34:30-38.

