莱菔硫烷对重症急性胰腺炎大鼠肺组织内血红素加氧酶-1及环氧合酶表达的影响
孔文基
(齐齐哈尔医学院附属第三医院药剂科,黑龙江齐齐哈尔 161002)
·论 著·
莱菔硫烷对重症急性胰腺炎大鼠肺组织内血红素加氧酶-1及环氧合酶表达的影响
孔文基
(齐齐哈尔医学院附属第三医院药剂科,黑龙江齐齐哈尔 161002)
目的 探讨莱菔硫烷对重症急性胰腺炎(SAP)肺组织血红素加氧酶-1(HO-1)及环氧合酶(COX)表达的影响。方法 将72只大鼠随机分为对照组(N组)、SAP模型组(SAP组)和莱菔硫烷组,每组各24只,分别于术后3、6、12 h对各组进行肺损伤评分、检测肺组织湿干比(W/D)、肿瘤坏死因子(TNF-α)、白细胞介素-1β(IL-1β)、HO-1 mRNA、COX mRNA的表达量。结果 SAP组的各指标均明显高于N组(P<0.05);莱菔硫烷组的病理评分、肺W/D值、TNF-α、IL-1β、COX-2 mRNA表达量较SAP组明显降低(P<0.05),HO-1 mRNA表达量较SAP组明显升高(P<0.05);相关性分析示HO-1 mRNA表达量与COX-2 mRNA、TNF-α、IL-1β的表达水平呈明显负相关(P<0.05)。结论 莱菔硫烷增加了SAP肺组织中HO-1的表达量从而减轻急性肺损伤,这可能与通过抑制COX表达有关。
重型胰腺炎; 莱菔硫烷; 血红素加氧酶-1; 环氧合酶
早期的急性胰腺炎约15%~30%发展为重症急性胰腺炎,由于病情发展迅速,不仅表现为胰腺组织局部的缺血坏死,而且常常伴有其他多脏器功能的损害,导致全身炎症反应综合征。其中尤以急性肺损伤或急性呼吸窘迫综合征发病率最高也最严重。炎性反应在重症急性胰腺炎所致的急性肺损伤中发挥了关键的作用,尤其是大量炎症介质的产生,包括肿瘤坏死因子α(TNF-α)和白细胞介素-1β(IL-1β)[1]。环氧合酶2(COX-2)是前列腺合成的一种重要前炎性介质,相关研究证实了COX-2介导了急性胰腺炎及相关肺损伤的炎性反应过程[2-3],但是具体机制尚未完全阐明。血红素加氧酶1(HO-1)具有抗氧化、抗感染等一系列生物学效应,参与机体的多种病理生理过程,在调控多种急性肺损伤(ALI)炎性介质的基因表达起重要作用[4],莱菔硫烷对多种疾病的损伤具有保护作用,成为各个领域研究的热点和难点。本研究旨在探讨莱菔硫烷HO-1重症急性胰腺炎大鼠肺组织内HO-1及环氧合酶(COX)的表达及意义。
1 材料与方法
1.1 材料来源 取健康雄性Sprague-Dawley大鼠共72只,体质量220~260 g,由本院动物房提供。术前禁食12 h,自由饮水。
1.2 试剂 牛黄胆酸钠(Sigma公司),RT-PCR试剂盒(深圳晶美生物公司),牛血晶素(B&D公司),莱菔硫烷(Sulforaphane)购于美国LKT公司。
1.3 方法
1.3.1 动物分组和模型制作 将72只SD大鼠分为对照组(N组)、SAP模型组(SAP组)、HO-1莱菔硫烷组(莱菔硫烷组),每组各24只。SAP模型制作,采用传统的5%牛黄胆酸钠法建立SD大鼠SAP模型。实验前12 h内禁食,自由饮水。用10%水合氯醛腹腔注射麻醉后逐层开腹,暴露胰腺和十二指肠。用微量泵逆行胆胰管内匀速内注射5%牛黄胆酸钠(1 mL/kg),约5 min后当观察到大鼠胰腺组织出现弥漫性出血点时,拔出针头,去除血管夹,连续缝合管壁腹腔。N组开腹后仅用棉签轻轻反动胰腺和小肠后关腹,不注射牛黄胆酸钠。莱菔硫烷组于造模后30 min腹腔注射莱菔硫烷10 mg/kg。
1.3.2 检测指标及方法 各组大鼠分别于术后3、6、12 h 3个时间点各取6只大鼠,用10%的水合氯醛腹腔麻醉,并取组织样本进行检测。
1.3.2.1 肺组织病理 开胸取右肺上叶,10%甲醛溶液固定,常规石蜡包埋、切片及HE染色,光镜下观察肺组织病理学变化并进行评分。
1.3.2.2 肺湿干重比测定 取右下肺纱布拭干后称重记为肺湿重(W),随后放于80 ℃烤箱中,每天称重1次,待重量稳定后记为肺干重(D),两者的比值为(W/D)。
1.3.2.3 肺组织炎症因子的检测 取左肺液氮速冻组织用于炎症因子(TNF-α和IL-1β)、HO-1和COX-2的检测。运用酶联免疫吸附试验(ELISA)检测肺组织中TNF-α和IL-1β的表达,操作严格按照试剂盒说明进行,HO-1和COX-2的检测采用实时定量荧光聚合酶链反应(RT-qPCR)方法:采用TRIzol法提取组织总RNA,取等量RNA进行反转录,HO-1上游引物为5′-ATC ATG GCT TGG CCT ACA TTG-3′,下游引物为5′-CAC GGA TGT GCA CCT CCT T-3′,扩增产物长度为107 bp;COX-2上游引物为5′-TCA AAA GAA GTG CTG-GAA AAG GTT-3′,下游引物为5′-TCT ACCT-GAG TGT CTT TGA CTG TG-3′(296 bp);β-actin上游引物为5′-TGA CAG GAT GCA GAA GGA GA-3′,下游引物为5′-TAG AGC CAC CAA TCC ACA CA-3′,扩增产物长度为300 bp。反转录反应体系 20 μL,其中5×M-MLV Buffer 4 μL,dNTP Mixture(各10 mmol/L)1 μL,Oligo dT Primer(50 μmol/L)1 μL,M-MLV RTase(200 U/μL)0.5 μL,RNase Inhibitor (40 U/μL)0.5 μL,RNase free dH2O 9 μL,总RNA 4 μL;反应条件为25 ℃×10 min,42 ℃×30 min,95 ℃×2 min。qPCR反应体系20 μL,其中SYBR super-Mix荧光10 μL,模板混合液(上游、下游引物)1 μL,超纯水5 μL,稀释2倍cDNA 4 μL;反应步骤为第1步:95 ℃×8.5 min;第2步:95 ℃×15 s,58 ℃×1 min,循环45次。

2 结 果
2.1 各组大鼠肺组织损伤病理学评分 与N组比较,SAP组肺组织结构破坏,肺泡腔内大量渗出液,间质充血、水肿,炎性细胞明显增多,莱菔硫烷组出血、炎性细胞浸润较SAP组明显减轻,各个时间点的肺病理评分结果显示(表1):SAP组的病理评分明显高于N组,两组比较差异有统计学意义(P<0.05);莱菔硫烷组的病理评分明显低于SAP组,两组比较差异有统计学意义(P<0.05)。
2.2 各组大鼠肺组织湿干重比变化 研究结果发现SAP组与N组相比,肺W/D值明显升高,且在各时间点差异均有统计学意义(P<0.05);莱菔硫烷组的肺W/D在各个时间点均低于SAP组(P<0.05),见表2。
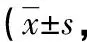
表1 不同时间处理组肺组织病理评分分)
注:与N组比较,*P<0.05;与SAP 组比较,#P<0.05。
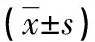
表2 不同时间处理组肺W/D值比较
注:与N组比较,*P<0.05;与SAP 组比较,#P<0.05。
2.3 各组大鼠炎症因子的表达水平比较 SAP组大鼠肺组织中的TNF-α、IL-1β表达量明显高于N组(P<0.05),在12 h内呈不断升高趋势。用莱菔硫烷干预处理后在各个时间点莱菔硫烷组的大鼠肺组织中TNF-α、IL-1β的水平较SAP组明显下降(P<0.05),见表3。
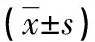
表3 不同处理组肺组织炎症因子水平比较
注:与N组比较,*P<0.05;与SAP 组比较,#P<0.05。
2.4 各组大鼠HO-1和COX-2 mRNA表达变化 造模后SAP组大鼠肺组织中的HO-1 mRNA表达量较对照组升高,差异有统计学意义(P<0.05),予以莱菔硫烷干预后,莱菔硫烷组的HO-1 mRNA表达量较SAP组明显升高(P<0.05)。SAP组的COX-2 mRNA表达水平较N组明显增高,差异有统计学意义(P<0.05),莱菔硫烷组COX-2 mRNA表达量较SAP组明显下降(P<0.05),见表4。
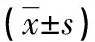
表4 不同处理组大鼠HO-1 和COX-2 mRNA表达量变化
注:与N组比较,*P<0.05;与SAP 组比较,#P<0.05。
2.5 SAP肺组织中HO-1 mRNA和COX mRNA、TNF-α、IL-1β的相关性分析 通过多元相关性分析发现随着COX-2 mRNA表达量的增高,TNF-α、IL-1β的水平也明显增高,呈正相关性(r分别为0.436、0.375,P<0.05);HO-1 mRNA表达量与COX-2 mRNA、TNF-α、IL-1β的表达水平呈明显负相关,差异有统计学意义(r分别为-0.758、-0.425、-0.389,P<0.05)。
3 讨 论
急性胰腺炎相关性肺损伤(APALI)发病机制复杂,大量研究证实了炎性介质和炎症细胞的激活在介导APALI过程中发挥了关键的作用,尤其是TNF-α和IL-1β[5]。相关研究提示COX-2在炎性反应的过程中发挥了重要作用[6],一方面TNF-α、IL-1β等炎症因子可以上调COX-2的表达,另一方面COX-2可进一步加重炎性反应和过氧化反应的发生,在损伤的炎性反应过程中形成了一个恶性循环。目前大量研究表明COX-2参与了多种急性肺损伤的发病机制过程,抑制COX-2的表达对缺血再灌注肺损伤、机械通气肺损伤、脓毒症肺损伤等均具有一定的保护作用[7-9]。Ethridge等[10]研究证实了破坏COX-2相关基因的表达可以减轻急性胰腺炎及APALI。HO-1作为内源性的保护蛋白近年来成为研究的热点和难点,而莱菔硫烷相关报道指出其与HO-1、COX-2具有一定的相关性,但其在APALI 中的具体作用机制尚未完全阐明,本研究主要探讨了莱菔硫烷对APALI的HO-1与COX-2炎性反应的相关性。
本文研究结果显示,造模后SAP组大鼠肺组织的湿干比、肺病理损伤评分及炎症因子的表达水平均较对照组明显升高,表明了APALI过程伴随肺水肿、肺损伤程度的加重,且SAP诱导了TNF-α、IL-1β表达水平的明显升高。值得注意的是SAP组的HO-1 mRNA表达量较正常对照也明显增高,为了进一步证实莱菔硫烷在APALI中的作用,本研究予以莱菔硫烷干预,结果肺组织中HO-1 mRNA的表达量较SAP组明显升高,同时伴随COX-2 mRNA、TNF-α、IL-1β表达量的下降,呈负相关,肺水肿、肺组织病理莱菔硫烷干预组也较SAP组明显好转。因此,本研究证实了莱菔硫烷诱导的HO-1表达的升高对APALI起到一定的保护作用。应用莱菔硫烷上调HO-1的表达有可能成为治疗APALI的新思路和方法。莱菔硫烷是一种可以食用的异硫氰酸盐,主要存在于花菜、西兰花以及甘蓝等十字花科植物中,日常食用西兰花(200 mg/d)可以有效地减少自发性高血压大鼠的高血压水平,炎性反应及氧化应激损伤。相关报道指出莱菔硫烷可以诱导多种组织细胞HO-1的表达,而HO-1除了分解血红素外,其代谢产物CO和胆绿素等在体内具有重要的生物学效应,包括抗氧化、抑制炎性反应等,激活HO-1相关的信号通路,促进HO-1的表达对多种肺损伤具有保护作用[11-12]。目前HO-1和COX-2之间的具体作用机制尚未完全明确,有研究表明HO-1有可能是通过MAPKs和Nrf2XIANG相关的信号通路来抑制COX-2的表达[13],HO-1也可通过促进抗炎因子的表达来减轻炎性反应,例如IL-10,这样莱菔硫烷可能通过调控HO-1与COX-2通路起到减轻肺组织损伤的作用。
综上所述,本研究结果证实了莱菔硫烷可上调HO-1的表达量,而HO-1可能通过抑制COX-2、TNF-α、IL-1β表达而对APALI起到一定的保护作用,为临床治疗APALI提供了新的靶点和治疗思路,值得进一步深入研究。
[1]Bhatia M,Brady M,Shokuhi S,et al.Inflammatory mediators in acute pancreatitis[J].J pathol,2000,190(2):117-125.
[2]Silva A,Weber A,Bain M,et al.COX-2 is not required for the development of murine chronic pancreatitis[J].Am J Physiol Gastrointest Liver Physiol,2011,300(6):968-975.
[3]O′Brien G,Shields CJ,Winter DC,et al.Cyclooxygenase-2 plays a central role in the genesis of pancreatitis and associated lung injury[J].Hepatobiliary Pancreat Dis Int,2005,4(1):126-129.
[4]Willis D,Moore A,Frederick R,et al.Heme oxygenase:a novel target for the modulation of inflammatory response[J].Nature medicine,1996,2(1):87-93.
[5]Luan ZG,Zhang J,Yin XH,et al.Ethyl pyruvate significantly inhibits tumour necrosis factor-α,interleukin-1β and high mobility group box 1 releasing and attenuates sodium taurocholate-induced severe acute pancreatitis associated with acute lung injury[J].Clin Exp Immunol,2013,172(3):417-426.
[6]Ali-Fehmi R,Semaan A,Sethi S,et al.Molecular typing of epithelial ovarian carcinomas using inflammatory markers[J].Cancer,2011,117(2):301-309.
[7]Ranganathan PV,Jayakumar C,Mohamed R,et al.Netrin-1 regulates the inflammatory response of neutrophils and macrophages,and suppresses ischemic acute kidney injury by inhibiting COX-2-mediated PGE2 production[J].Kidney international,2013,83(6):1087-1098.
[8]Robertson J,Cedergreen J,Nonas S.Lung-specific Cox2 inhibition attenuates ventilator-induced lung injury[J].Am J Respir Crit Care Med,2012,185(16):5454-5458.
[9]Ni YF,Kuai JK,Lu ZF,et al.Glycyrrhizin treatment is associated with attenuation of lipopolysaccharide-induced acute lung injury by inhibiting cyclooxygenase-2 and inducible nitric oxide synthase expression[J].J Surg Res,2011,165(1):29-35.
[10]Ethridge RT,Chung DH,Slogoff M,et al.Cyclooxygenase-2 gene disruption attenuates the severity of acute pancreatitis and pancreatitis-associated lung injury[J].Gastroenterology,2002,123(4):1311-1322.
[11]Ping Z,Jiao W,Zhong Z.Sevoflurane pretreatment prevents lipopolysaccharide (LPS)-induced acute lung injury in rats through up-regulated heme oxygenase-1 (HO-1) expression[J].Afri J Pharmacy Pharmacol,2011,5(15):1765-1772.
[12]Hsu JT,Yeh HC,Chen TH,et al.Role of Akt/HO-1 pathway in estrogen-mediated attenuation of trauma-hemorrhage-induced lung injury[J].J Surg Res,2013,182(2):319-325.
[13]Gómez-Hurtado I,Zapater P,Bellot P,et al.Interleukin-10-mediated heme oxygenase 1-induced underlying mechanism in inflammatory down-regulation by norfloxacin in cirrhosis[J].Hepatology,2011,53(3):935-944.
Effects of sulforaphane on expression of HO-1 and COX in lung tissue of severe acute pancreatitis rat
KongWen-ji
(DepartmentofPharmacy,ThirdAffiliatedHospitalofQiqihaerMedicalCollege,Qiqihaer,Heilongjiang161002,China)
Objective To study the effects of sulforaphane on the levels of HO-1 and COX-2 in the lung tissue of severe acute pancreatitis(SAP) rat model.Methods Seventy-two rats were randomly divided into three groups:control group(N group),SAP model group(SAP group) and sulforaphane group,24 cases in each group.The lung injury evaluation,wet-to-dry(W/D) ratio,levels of TNF and IL-1β protein and expression of HO-1 and COX-2 mRNA were measured at 3,6,12 h after operation.Results Compared with the N group,the levels of every indexes in the SAP group were higher (P<0.05).In the comparison with the SAP group,the pathological scores,W/D ratio,levels of TNF and IL-1β protein and expression of COX-2 mRNA were lower in the sulforaphane group,while expression of HO-1 mRNA was higher(P<0.05).The expression amounts of HO-1 mRNA showed the significantly negative correlation with the expression levels of TNF and IL-1β protein and expression of COX-2 mRNA(P<0.05).Conclusion Sulforaphane can reduce the lung injury by increasing the expression amount of HO-1 in lung,which may be related with inhibiting the expression of COX.
severe acute pancreatitis; sulforaphane; HO-1; COX
孔文基,女,本科,主管药师,主要从事药学研究。
10.3969/j.issn.1672-9455.2015.14.034
A
1672-9455(2015)14-2056-03
2015-01-25
2015-03-15)

