Graves 病患者131 I、甲巯咪唑治疗前后外周血Th17 细胞及IL-17 水平的变化
郭泽华 于世鹏 班 博 (山东大学,济南 250100)
Graves 病(Graves' disease,GD)是甲状腺功能亢进症中最常见的一种,约占所有甲亢的85%,属于自身免疫性疾病,具体发病机制尚未明确。目前大量研究表明免疫因素在其发病过程中起着关键作用,以Th2 细胞介导的体液免疫占主导地位[1]。而近年研究[2]发现一类不同于Th1、Th2 细胞的CD4+T 细胞的新分支Th17 细胞,主要分泌白介素(Interleukin,IL)-17 等相关细胞因子。IL-17 作为重要的炎性介质,可与IL-6、TNF-α、IFN-γ 等细胞因子发挥协同效应,放大靶器官免疫反应并增强炎症性破坏作用[3]。Th17 细胞及其细胞因子参与多种自身免疫性疾病的发生过程,影响自身免疫性抗体产生[4]。本实验通过动态检测GD 患者治疗前后外周血中Th17 淋巴细胞比例及血清IL-17 水平,探讨Th17 细胞在GD 中的变化及其意义。
1 材料与方法
1.1 研究对象131I 治疗组(131I therapy group):初诊GD 患者31 例,男性9 例,女性22 例,年龄(36.42±9.95)岁,病程(4.87±5.1)月,均采用131I治疗;甲巯咪唑(MMI)治疗组(MMI therapy group):初诊GD 患者30 例,男性8 例,女性22 例,年龄(36.10±9.67)岁,病程(5.14±3.2)月,采用甲巯咪唑治疗。以上两组年龄、性别、病程无统计学差异(P >0.05)。以上对象均按2007 年《中国甲状腺疾病诊治指南》[5]的Graves 病诊断标准进行筛选(浸润性突眼除外),并除外合并其他自身免疫性或炎症性疾病、皮质类固醇或免疫抑制剂的使用者。正常对照组(Normal control group,NC group):选择同期30 名性别、年龄相匹配且无新近感染、自身免疫疾病的家族史的健康体检者。
1.2 试剂和仪器 异硫氰酸荧光素(FITC)标记的鼠抗人CD4 抗体、藻红蛋白(PE)标记的鼠抗人IL-17A 抗体及其相匹配的同型对照均购自美国BD 公司;佛波酯(PMA)和Ionomyein 购自美国Enzo Life-Sciences 公司;莫能霉素、固定剂、破膜剂购自美国eBioscience 公司;RPMI1640 培养液及胎牛血清购自Hyclone 公司;IL-17 ELISA 试剂盒购自R&D 公司;流式细胞仪为美国BD 公司FACS CantoTM型。
1.3 方法
1.3.1 治疗方法 甲巯咪唑治疗方案:MMI 治疗组结合患者的年龄、病情、病程、甲功三项结果均给予甲巯咪唑(50~100 g/8 h)口服治疗,并根据其病程进展予适当加减治疗剂量。131I 治疗方案:131I 治疗组均自愿选择放射性131I 治疗,131I 剂量(uCi)=甲状腺重量(g)×每克甲状腺组织131I 给予剂量(uCi/g)/24 h 摄碘率(%)[6],结合患者的年龄、病情、病程等个体情况适当加减剂量,选择4~5 mCi 放射性131I 剂一次性口服治疗。研究分别在治疗前(T0)、治疗后1 个月(T1)、3 个月(T3)进行相关指标的测定。
1.3.2 标本收集和外周血单个核细胞的分离 所有对象均于清晨空腹时采集静脉血8 ml,其中3 ml予2 500 r/min 离心5 min,取血清冻存于 -80℃,用于检测IL-17 水平;另5 ml 采用人淋巴细胞分离液(Ficoll)密度梯度离心法分离出外周血单个核细胞(PBMC),用RPMI1640 培养液(含10%胎牛血清0.1 mg/ml 链霉素和100 U/ml 青霉素)调整细胞浓度至2 ×106ml 个,用于流式细胞学检测。所有标本均在4 h 内处理。
1.3.3 Th17 细胞检测 ①淋巴细胞的刺激培养:将调整好浓度的PBMC 悬液接种于24 孔培养板,加入PMA 25 ng/ml,Ionomyein 1.25 g/ml,莫能霉素1.7 g/ml,在37℃5% CO2细胞培养箱中培养6~8 h;②细胞膜表面染色:收集细胞,加入20 μl CD4-FITC 单抗,室温避光孵育30 min PBS 洗涤;③固定破膜:加入固定剂100 μl,室温避光反应20 min,PBS洗涤,再加入破膜剂100 μl,室温避光反应20 min,PBS 洗涤;④细胞内染色:将细胞平均分为测定管和对照管,测定管中加入IL17A-PE 20 μl,对照管中加入相应的同型对照抗体,混匀后4℃避光反应30 min,PBS 洗涤2 次。上流式细胞仪检测,用CellsQuest 软件获取分析数据。
1.4 统计学处理 应用SPSS17.0 统计软件进行分析,计量资料采用±s 表示,两组间比较根据方差是否齐性采用t 或t'检验;GD 治疗前及治疗后1 个月、3 个月Th17 细胞/CD4+T 细胞、血清IL-17 水平比较采用单因素重复测量的方差分析,P <0.05 为差异有统计学意义。
2 结果
2.1 甲状腺指标比较 GD 患者治疗前(T0 组)与正常对照组相比,T0 组游离三碘甲腺原氨酸(FT3)、游离甲状腺素(FT4)、甲状腺过氧化物酶抗体(TPOAb)、甲状腺球蛋白抗体(TGAb)和促甲状腺素受体抗体(TRAb)阳性率显著高于正常对照组,促甲状腺激素水平(TSH)明显低于正常对照组(P <0.01),131I 治疗组与MMI 治疗组相比(P >0.05)。见表1。
2.2 Th17 细胞、IL-17 治疗前后比较131I 治疗组、MMI 治疗组治疗前(T0)外周血Th17 细胞/CD4+T 细胞百分率及IL-17 水平,无明显统计学差异(P >0.05),两组均明显高于正常对照组(P<0.01)。治疗前后(T0、T1、T3 组)之间比较采用单因素重复测量的方差分析:131I 治疗组外周血Th17 细胞/CD4+T 细胞百分率及IL-17 水平在T0、T1、T3 组中水平逐渐下降(P <0.01),F 值分别为131.350、326.206(P=0.000);MMI 治疗组变化无统计学差异(P >0.05)。T3 组与NC 比较(P <0.01),见图1、表2。
2.3 相关性分析 采用Spearman 分析双变量相关性:外周血Th17 细胞比例与血清IL-17 水平呈正相关(r=0.758,P <0.05);Th17 细胞比例、IL-17 水平与GD 患者血清甲状腺相关抗体呈正相关。见表3。
表1 各组甲状腺指标比较(±s)Tab.1 Thyroid hormones and autoantibodies of different groups(±s)

表1 各组甲状腺指标比较(±s)Tab.1 Thyroid hormones and autoantibodies of different groups(±s)
Note:1)vs NC,P <0.01;2)131I therapy group vs MMI therapy group,P >0.05.
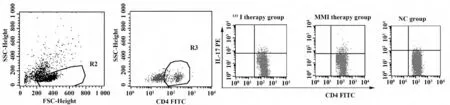
图1 Th17 细胞流式细胞仪散点图Fig.1 Typical dot plots of flow cytometric analysis of Th17 cells
表2 治疗前后各组Th17 细胞、IL-17 的比较(±s)Tab.2 Comparison of mean values of Th17,IL-17 among T0,T1,T3 and NC group (±s)

表2 治疗前后各组Th17 细胞、IL-17 的比较(±s)Tab.2 Comparison of mean values of Th17,IL-17 among T0,T1,T3 and NC group (±s)
Note:1)T0,T1,T3general linear model-repeated measures in 131I therapy group,P <0.01;2)T0,T3 vs NC t-test,P <0.01.
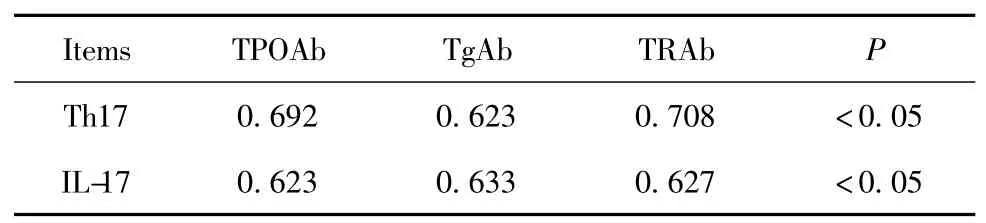
表3 Th17 细胞、IL-17 与甲状腺相关抗体相关性Tab.3 Correlation between Th17 cells,IL-17 and thyroid autoantibodies
3 讨论
Graves 病(GD)是由促甲状腺激素受体刺激性抗体(TSAb)过度刺激甲状腺组织,导致甲状腺功能亢进和甲状腺肿大的一种特异器官自身免疫性疾病[7,8]。其病因及发病机制复杂,既往认为Th1 细胞在GD 发病早期起主要作用,Th2 细胞在GD 晚期起作用[9]。随着一种新型CD4+T 细胞——Th17细胞的发现和对其研究的深入,Th17 细胞及其相关细胞因子与GD 的关系受到关注,推测其可能参与GD 的发病,弥补了Th1/Th2 介导效应机制的不足。
3.1 Th17 细胞及其相关细胞因子IL-17 可能参与了GD 的发病 Th17 细胞是一种新型的CD4+效应细胞,具有独立的分化和调节机制。Th17 细胞通过释放细胞因子IL-17、IL-17F 和IL-22,吸引炎症趋化因子和致炎因子聚集到正常细胞周围[10],IL-17可诱导前炎性细胞因子、趋化因子和基质金属蛋白酶的表达,引起炎性细胞浸润和组织损伤。且IL-17 可与其他致炎信号分子发生协同作用,增加致炎效应。
近年发现Th17 细胞及IL-17 在自身免疫性疾病中发挥重要调节作用,如系统性红斑狼疮(SLE)[11]、银屑病[12]、类风湿关节炎[13]等。Nanba等[14]发现,GD 患者的Th17 细胞的比例明显高于正常对照组,且难治性GD 组的Th17 细胞比例明显高于GD 缓解组。而Kim[15]、Peng[16]等国内外相关研究结果显示,Th17 细胞及IL-17 水平在GD 组中明显升高。与以上研究结果一致,本实验结果显示131I 治疗组、MMI 治疗组GD 患者治疗前(T0)外周血Th17 细胞/CD4+T 细胞百分率及IL-17 水平明显高于正常对照组(P <0.01)。提示Th17 细胞可能在GD 发病中起重要作用。通过比较研究不同遗传背景下NOD-H2 (h4)的鼠模型中,只有IL-17(+/ +)发生了Graves 病,Horie 等[17]进一步证明了Th17 细胞在GD 发病机制中起一定的作用。
3.2131I、MMI 治疗GD 对Th17 细胞、IL-17 可能产生不同影响 临床GD 治疗方法为放射性131I 治疗和口服药物治疗,常用口服药物为甲巯咪唑和丙硫氧嘧啶,因丙硫氧嘧啶有较明显副作用故对于一般GD 治疗临床多选用MMI。既往研究表明,131I、MMI对GD 患者具有一定的治疗甲状腺功能亢进作用之外的免疫调节作用,可调节细胞因子水平[18-20]。马学芹[21]等对经131I 治疗的初发GD 不同时间IL-17A、IL-17F 的测定,发现此二因子在131I 治疗后水平下降,与治疗前相比具有统计学意义。本实验结果提示131I 治疗组治疗前后(T0、T1、T3)甲状腺激素水平亦呈下降趋势,且Th17 细胞/CD4+T 细胞百分率及IL-17 水平均明显下降(P <0.01),与Nanba、马学芹等研究结果相符,表明131I 治疗可通过影响Th17 细胞从而起到治疗GD 的作用。目前对131I 治疗对免疫系统影响的机制研究较少,尚未提出一定的概论,考虑Th17 细胞、IL-17 的水平下降一方面与131I 释放β 射线破坏甲状腺组织,使甲状腺相关抗原耗竭,甲状腺内活性T 淋巴细胞及相关细胞因子清除有关,另一方面甲状腺功能紊乱的纠正可减少对免疫的损伤。Klatka 等[22]通过对比初发GD 组和经MMI 治疗后病情缓解组患者外周血中Th17 细胞比例及绝对计数(P <0.05),提示MMI 对GD 患者Th17 细胞有一定的调节作用。采用单因素重复测量的方差分析:本实验MMI 治疗组外周血Th17细胞/CD4+T 细胞百分率及IL-17 水平,在治疗前后无明显统计学差异(P >0.05),与Figueroa-Vega等[10]研究得出甲巯咪唑无法抑制Th17 细胞分泌细胞因子观点一致。但和Klatka 等研究结果存在一定差异,可能与病人基因背景、病情严重程度、疾病阶段不同等相关。以上结果显示两种治疗方式对GD 的Th17 细胞、IL-17 可产生不同影响。国内外对131I、MMI 治疗与免疫系统的关系研究仍较少,此方向尚待深入探讨。
综上所述,本研究通过比较两种治疗方案GD患者外周血中Th17 细胞、IL-17 的变化,反映出Th17 细胞及其相关因子可能参与了GD 的发病过程,并为放射性131I 可能对Th17 细胞及IL-17 产生一定作用提供了依据。但本研究存在样本量较小等局限,对于Th17 细胞如何在GD 发病机制中起作用,以及两种治疗方法是否可直接调节免疫系统治疗GD,仍需进一步研究。
[1]Phenekos C,Vryonidou A,Grilzapis AD,et al.Th1 and Th2 serum cytokine profiles character-ize patients with Hashimoto's thyroiditis(Th1)and Graves' disease(Th2)[J].Neuroimmunomodulation,2004,11(4):209-213.
[2]Wilson NJ,Boniface K,Chan JR,et al.Development,cytokine profile and function of human interleukin 17-producing helper T cells[J].Nat Immunol,2007,8(9):950-957.
[3]Kolls JK,Lindén A.Interleukin-17 family members and inflamation[J].Immunity,2004,21(4):467-476.
[4]Ano S,Morishima Y,Ishii Y,et al.Transcription factors GATA -3 and RORγt are important for determining the phenotype of allergic airway inflammation in a murine model of asthma[J].J Immunol,2013,190(3):1056-1065.
[5]中华医学会内分泌学分会《中国甲状腺疾病诊治指南》编写组.中国甲状腺疾病诊治指南--甲状腺功能亢进症[J].中华内科杂志,2007,46(10):876-882.
[6]谭 建.131I 治疗Graves 甲状腺功能亢进症专家共识解读[J].国际内分泌代谢杂志,2012,32(2):73-75.
[7]Rees Smith B,McLachlan SM,Furmaniak J.Autoantibodies to the thyrotropin receptor[J].Endocr Rev,1988,9(1):106-121.
[8]Rapoport B,Chazenbalk GD,Jaume JC,et al.The thyrotropin(TSH)receptor:interaction with TSH and autoantibodies[J].Endocr Rev,1998,19(6):673-716.
[9]Borgogni E,Sarchielli E,Sottili M,et al.Elocalcitol inhibits inflammatory responses in human thyroid cells and T cells[J].Endocrinology,2008,149(7):3626-3634.
[10]Figueroa-Vega N,Alfonso-Pérez M,Benedicto I,et al.Increased circulating proinflammatory cytokines and Th17 lymphocytes in Hashimoto's thyroiditis[J].J Clin Endocrinol Metab,2010,95(2):953 -962.
[11]Cheng F,Guo Z,Xu H,et al.Decreased plasma IL22 levels,but not increased IL17 and IL23 levels,correlate with disease activity in patients with systemic lupus erythematosus[J].Ann Rheum Dis,2009,68(4):604-606.
[12]Nakajima K.Critical role of the interleukin-23/T-helper17 cell axis in the pathogenesis of psoriasis[J].J Dermatol,2012,39(3):219 -224.
[13]Zhang L,Li JM,Liu XG,et al .Elevated Th22 cells correlated with Th17 cells in patients with rheumatoid arthritis[J].J Clin Immunol,2011,31(4):606-614.
[14]Nanba T,Watanabe M,Inoue N,et al.Increases of the Th1/Th2 cell ratio in severe Hashimoto's disease and in the proportion of Th17 cells in intractable Graves'disease[J].Thyroid,2009,19(5):495-501.
[15]Kim SE,Yoon JS,Kim KH,et al.Increased serum interleukin-17 in Graves' ophthalmopathy[J].Graefes Arch Clin Exp Ophthalmol,2012,250(10):1521-1526.
[16]Peng D,Xu B,Wang Y,et al.A high frequency of circulating th22 and th17 cells in patients with new onset graves' disease[J].PLoS One,2013,8(7):e68446.
[17]Horie I,Abiru N,Saitoh O,et al.Distinct role of T helper Type 17 immune response for Graves' hyperthyroidism in mice with different genetic backgrounds[J].Autoimmunity,2011,44 (2):159-165.
[18]Pedro AB,Romaldini JH,Takei K.Changes of serum cytokines in hyperthyroid Graves' disease patients at diagnosis and during methimazole treatment[J].Neuroimmunomodulation,2011,18(1):45-51.
[19]Crescioli C,Cosmi L,Borgogni E,et al.Methimazole inhibits CXC chemokine ligand 10 secretion in human thyrocytes[J].J Endocrinol,2007,195(1):145-155.
[20]Antonelli A,Rotondi M,Fallahi P,et al.Iodine-131given for therapeutic purposes modulates differently interferon-gamma -inducible alpha-chemokine CXCL10 serum levels in patients with active Graves' disease or toxic nodular goiter[J].J Clin Endocrinol Metab,2007,92(4):1485-1490.
[21]马学芹,于世鹏.初发Graves 病患者131I 治疗前后IL-23/Th17 轴相关因子水平的变化及意义[J].中国免疫学杂志,2013,29(7):733-735.
[22]Klatka M,Grywalska E,Partyka M,et al.Th17 and Treg cells in adolescents with Graves' disease.Impact of treatment with methimazole on these cell subsets[J].Autoimmunity,2014,47(3):201-211.

