改良PAS染色法在急性肝损伤中的应用
张 风 陶艳艳,2 陈高峰,2
(1 上海中医药大学附属曙光医院·肝病研究所,上海,201203; 2 肝肾疾病病证教育部重点实验室,上海,201203)
改良PAS染色法在急性肝损伤中的应用
张 风1陶艳艳1,2陈高峰1,2
(1 上海中医药大学附属曙光医院·肝病研究所,上海,201203; 2 肝肾疾病病证教育部重点实验室,上海,201203)
目的:观察改良肝脏糖原PAS染色法,并观察肝脏糖原染色在急性肝损伤中的应用。方法:复制CCl4急性肝损伤模型,首次100% CCl43 mL/kg皮下注射,此后50% CCl4橄榄油溶液2 mL/kg每周2次共4次皮下注射,诱导大鼠急性肝损伤模型。计算大鼠肝体比;HE染色观察肝组织炎症病理;试剂盒检测血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBil)、白蛋白(Alb)。肝脏常规PAS染色与改良PAS染色观察肝糖原染色。结果:与正常组相比,模型组ALT、AST活性与TBil含量明显升高(P<0.05),Alb含量明显降低(P<0.05);HE染色示,模型组肝小叶结构排列紊乱,肝细胞脂肪变、气球样变明显。常规PAS染色,正常组肝组织PAS染色阳性占肝脏面积为32.38%±5.50%;与正常组相比,模型组肝组织PAS阳性染色明显减少(P<0.01),占肝脏面积为8.60%±3.34%。改良PAS染色提示,正常组肝脏可见大量PAS阳性染色,占肝脏面积为75.50%±9.02%;与正常组相比,模型组肝组织PAS阳性染色明显减少(P<0.01),占肝脏面积为17.61%±3.53%。在空白对照组与模型肝组织中,肝糖原改良PAS染色阳性率明显高于常规PAS染色法(P<0.01)。改良PAS染色肝糖原阳性染色面积更真实反映急性肝损伤程度。结论:改良肝脏糖原PAS染色法有助于急性肝损伤程度评估。
肝糖原;急性肝损伤;PAS染色法;改良
肝脏是机体代谢的主要器官,对糖的存储、分布和调节起重要作用。血中葡萄糖可自由通过肝细胞,口服葡萄糖后约60%被摄取,进人肝细胞后经葡萄糖激酶迅速被磷酸化为6-磷酸-葡萄糖(G-6-P),并进一步经糖原合成酶合成为糖原贮存[1]。在肝脏,当机体需要时,便可分解成葡萄糖,转化为能量;当肝细胞发生弥漫性严重损害时,肝糖原合成障碍及贮存减少,主要表现为磷酸戊糖途径及糖醇解途径相对增强;糖有氧氧化及三羧酸循环运转不佳,肝中葡萄糖-6-磷酸酶活性增加,使肝糖原迅速分解为6-磷酸-葡萄糖,并在限速酶糖原磷酸化酶催化下,生成葡萄糖补充血糖,导致肝糖原含量明显下降。在评价肝损伤程度时,肝糖原为常规检测项目,糖原的含量能说明肝损伤程度[2]。肝脏糖原测定有蒽酮法[3]、氧化酶法[4]、PAS染色法[5],近期我们采用糖原染液试剂,改良肝组织固定方法,成功原位检测肝组织糖原表达位置与水平,用于急性肝损伤的评估。
1 材料
1.1 动物 Wistar大鼠20只,雄性,SPF级,体重160~170 g,购自北京维通利华实验动物有限公司,许可证号SCXK(京)2012-0001,饲养于上海中医药大学实验动物中心,设施许可证号:SYXK(沪)2009-0069,所有动物均自由饮食。
1.2 主要试剂 四氯化碳(Carbon Tetrachloride,CCl4),化学纯,批号20140325;橄榄油,化学纯,批号F20110402,均购自国药集团;丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBil)、白蛋白(Alb)购自上海科华生物。肝糖原过碘酸希夫染色(Periodic Acid-schiff,PAS染色)试剂盒糖原染液试剂盒(批号20140925),购自南京建成生物工程研究所。
2 方法
2.1 模型制备 CCl4急性肝损伤模型参照经典造模法[6-9]并改进。本实验染毒5次,即第1、4、7、10、13天上午9点各1次。首次皮下注射100% CCl43 mL/kg大鼠体重,此后50% CCl4橄榄油溶液2 mL/kg大鼠体重。正常组大鼠皮下注射相同容积的橄榄油溶液。
2.2 分组 Wistar大鼠20只,按照完全随机分组的原则,分为正常组8只,模型组12只。
2.3 肝系数与血清肝功能 实验第14天晚禁食,第15天早晨9点杀鼠。肝系数:杀鼠时称量体重、肝重,计算肝重(g)占体重(g)的百分比。腹主动脉取血,分离血清,测定:1)丙氨酸氨基转移酶(ALT);2)天门冬氨酸氨基转移酶(AST);3)总胆红素(TBil);4)白蛋白(Alb),检测方法均参照试剂盒说明书。
2.4 肝组织病理学观察 实验第15天杀检时肉眼大体观察记录,取肝右叶相同部位组织常规10%用中性福尔马林液固定,石蜡包埋,作HE染色,光镜下观察肝脏组织病理病变。同时取肝右叶相同部位组织制作冰冻切片和Carnoy液固定,用于肝糖原染色。根据CCl4急性肝损伤模型的肝组织病理病变特点,参考非乙醇性脂肪性肝病诊疗指南(2010年修订版)[10],常规进行肝细胞脂肪变与气球样变积分:1)肝细胞脂肪变:0分(<5%);1分(5%~33%);2分(34%~66%);3分(>66%)。2)肝细胞气球样变:0分,无;1分,少见;2分,多见。
2.5 肝糖原染色 试剂盒常规肝糖原过碘酸希夫(Periodic acid-schiff,PAS)染色:试剂A:主要由1%过碘酸组成。试剂B:主要由碱性品红、偏重亚硫酸钠、活性碳等组成。试剂C:主要由苏木素、乙醇、甘油等组成。乙醇-醋酸-氯仿固定液(卡诺固定液,Carnoy fixative)配方:纯乙醇3份+冰醋酸1份。常规PAS操作步骤:1)肝组织Carnoy液固定,常规脱水包埋;2)石蜡切片脱蜡入蒸馏水;3)自来水冲洗2~3 min,再用蒸馏水浸洗2次;4)置于试剂A中,室温放置5~8 min,一般不宜超过10 min;5)自来水冲洗1次,再用蒸馏水浸洗2次;6)样本放入试剂B,置于室温阴暗处,浸染10~20 min;7)自来水冲洗10 min;8)样本置于试剂C中,染核1~2 min;9)自来水冲洗10~15 min后,更换双蒸水清洗,使其返蓝;10)逐级常规乙醇脱水;11)二甲苯透明;12)中性树胶封固。
改良肝糖原染色:1)肝组织冰冻切片(8 μm);2)置于试剂A中,室温放置5~8 min(一般不宜超过10 min);3)自来水冲洗1次,再用蒸馏水浸洗2次;4)样本放入试剂B,置于室温阴暗处,浸染10~20 min;5)自来水冲洗10 min;6)样本置于试剂C中,染核1~2 min;7)自来水冲洗10~15 min后,更换双蒸水清洗,使其返蓝;8)逐级常规乙醇脱水;9)二甲苯透明;10)中性树胶封固。
肝糖原面积分析:采用DP71软件(奥林巴斯公司,日本)拍摄图片,用奥林巴斯显微镜图像分析软件Image-Pro Plus IPP 6.1进行肝组织糖原面积半定量分析。
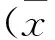
3 结果
3.1 CCl4急性肝损伤模型大鼠肝脏系数与血清肝功能的变化 由表1可知,与正常组比较,CCl4染毒后模型组体重明显降低(P<0.01),肝体比增加(P>0.01)。血清肝功能结果显示,与正常组相比,模型组的ALT与AST活性明显升高(P<0.01),TBil含量明显增加(P<0.01),Alb含量明显降低(P<0.01),出现明显的肝功能损害,提示CCl4染毒成功诱导大鼠急性肝损伤模型(表1)。
3.2 CCl4急性肝损伤模型大鼠肝脏组织病理学的变化 HE染色示,正常组大鼠肝组织肝小叶结构正常、排列整齐、无出血、无肝细胞变性、坏死,未见脂肪沉积及炎症细胞浸润;模型组大鼠肝小叶结构排列紊乱,肝细胞脂肪变、气球样变明显加重。Ridit分析结果显示,与正常组相比,模型组肝细胞脂肪变与气球样变化明显加重(P<0.01)。(图1,表2)

表1 大鼠CCl4急性肝损伤模型肝脏系数与血清肝功能的影响±s)
注:*P<0.05,**P<0.01vs正常组,#P<0.05,##P<0.01vs.模型组。

表2 大鼠CCl4急性肝损伤肝细胞脂肪变
注:与正常组相比,*P<0.05,**P<0.01。

表3 大鼠CCl4急性肝损伤常规PAS染色
注:与正常组相比,*P<0.05,**P<0.01;与正常组相比,aP<0.01;与模型组相比,bP<0.01。
3.3 CCl4急性肝损伤模型大鼠肝组织糖原染色的变化 常规肝糖原染色结果,正常组肝细胞胞质及胞核内可见中等量玫瑰红色粗大颗粒(PAS染色阳性),应用Image-Pro Plus:IPP 6.1半定量分析肝组织糖原含量占肝脏面积为32.38%±5.50%;与正常组相比,模型组肝细胞胞质及胞核内玫瑰红色粗大颗粒明显减少(P<0.01),占肝脏面积为8.60%±3.34%。改良肝糖原染色提示,正常组肝细胞胞质及胞核内可见大量玫瑰红色粗大颗粒(PAS染色阳性),占肝脏面积为75.50%±9.02%;与正常组相比,模型组肝细胞胞质及胞核内玫瑰红色粗大颗粒明显减少(P<0.01),占肝脏面积为17.61%±3.53%。在正常肝组织与模型肝组织中,改良肝糖原染色法PAS染色阳性明显高于常规肝糖原染色法(P<0.01)。见表3与图1。

图1 大鼠CCl4急性肝损伤HE染色、 常规PAS染色与改良PAS染色
注:N正常组,M模型组;A:肝组织HE染色×200倍;B:肝组织常规PAS染色×200倍;C:肝组织改良PAS染色×200倍;D:肝细胞脂肪变积分分析;E:肝细胞气球样变积分分析;F:肝组织常规PAS染色与改良PAS染色半定量分析。与正常组相比,**P<0.01;与正常组相比,aP<0.01;与模型组相比,bP<0.01。
4 讨论
CCl4为急性肝损伤诱导[11],CCl4在肝内代谢裂解成三氯甲基CCl3-等自由基,这些自由基攻击肝细胞膜磷脂内不饱和脂肪酸碳链上的氢原子,消耗膜脂质中的不饱和脂肪酸,大量生成脂质过氧化物,导致肝细胞损伤[12]。本实验表明CCl4诱导大鼠急性肝损伤,表现为血清中ALT、AST活性以及T.Bil含量与正常组有显著性升高;血清中Alb含量与正常组明显降低。肝组织HE染色显示,模型组大鼠肝小叶结构排列紊乱,肝细胞脂肪变、气球样变明显加重。
如前所述,测定肝糖原的方法很多,其中蒽酮法受试剂、温度、方法稳定性差等因素的影响,结果重现性不好,而且使用试剂多,溶液配制和操作过程复杂。氧化酶法检测肝糖原含量的方法优于蒽酮法。其操作简便,结果稳定、重复性好,适合不同动物模型肝糖原含量的检测。但是若不用缓冲液调整水解液的pH值,直接用碱中和则往往会出现中和不足或过量的问题,很难掌握好中和点[13]。而且蒽酮法与氧化酶法均不适合肝糖原原位检测。PAS染色法[5]是目前采用较多的肝糖原原位染色检测,常规PAS染色法采用乙醇-醋酸-氯仿固定液(卡诺固定液),能较好地保存糖原,但有使糖原流动到细胞一侧甚至漏出的现象,一般认为是由于固定剂把细胞内的糖原推向固定剂对组织浸透的方向而造成[14],与本实验中常规PAS染色肝糖原偏向肝细胞一侧并减少的显示结果一致。近期我们采用糖原染液试剂盒,简化实验流程,肝组织不采用卡诺固定液固定直接冰冻切片,成功原位检测肝组织糖原表达位置与水平,肝糖原均匀分布于整个肝细胞,肝糖原阳性染色明显强于常规PAS染色。大鼠皮下注射CCl4后可使肝细胞产生化学性损伤,因此肝细胞对葡萄糖的摄取减少,肝糖原的合成亦相应减少。本研究结果提示CCl4染毒2周后大鼠体重明显减轻、ALT与AST活性明显升高,TBil含量明显增加,Alb含量明显降低,HE染色可见肝细胞脂肪变变、气球样变化明显,提示CCl4染毒成功诱导大鼠急性肝损伤。常规PAS染色与改良PAS染色均提示,模型组大鼠肝糖原面积较正常组大鼠明显减少。由于以往操作方法经常出现实验结果不理想,为此本实验取材于急性肝损伤的大鼠肝脏,参照常规PAS染色法,对实验中肝糖原染色方法的固定作了探索性的改进,即采用肝组织冰冻切片,无须卡诺固定液固定,大大节省实验流程与时间,同时,更好的保留肝组织糖原,本实验结果表明改良PAS染色法切实可行,肝糖原阳性染色面积更符合急性肝损伤的程度。
[1]戚什铎,王友赤.诊断学[M].4版,北京:人民卫生出版社,1995:406.
[2]陈文斌,陈永亮,卢灿荣,等.肝糖原贮备对热缺血再灌注大鼠肝细胞凋亡的影响[J].消化外科,2006,5(6):447-450.
[3]高珊,童英,熊晓燕,等.蒽酮法与试剂盒法测定糖原含量的比较研究[J].首都公共卫生,2011,5(1):38-40.
[4]柳占彪,张少卓,李玉红,等.应用氧化酶法对高糖高脂动物模型肝糖原含量的测定[J].中国比较医学杂志,2009,19(1):34-36.
[5]王媛,邓锋,肖咏丽,等.肝脏组织PAS染色方法的探讨[J].疾病预防控制通报,2012,27(1):5-6.
[6]龚峻梅,朴英杰,陈素云.急性CCl4肝损伤的研究进展[J].国外医学·生理、病理科学与临床分册,2002,22(3):308-310.
[7]陈雪龙.实验性肝损伤动物模型的研究进展[J].实验动物科学,2008,25(3):47-59.
[8]黄正明,杨新波,曹文斌,等.化学性及免疫性肝损伤模型的方法学研究[J].解放军药学学报,2005,21(1):42-46.
[9]雷扬,周爱民,郭涛,等.痰热清注射液对急性肝损伤大鼠的保护作用[J].中国中药杂志,2013,38(8):1226-1230.
[10]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[S].胃肠病学和肝病学杂志,2010,19(6):483-487.
[11]陈成伟.药物与中毒性肝病[M].上海:上海科学技术出版社,2002:11.
[12]汪涛,姜华,陆国才,等.四氯化碳肝脏毒性机制的研究进展[J].毒理学杂志,2007,21(4):338-339.
[13]柳占彪,张少卓,李玉红,等.应用氧化酶法对高糖高脂动物模型肝糖原含量的测定[J].中国比较医学杂志,2009,19(1):34-36.
[14]陈小萍,吴钦穗.PAS组织化学染色的几点体会[J].福建医药杂志,2006,28(6):178-179.
(2014-12-26收稿 责任编辑:洪志强)
Application of improved PAS staining in acute liver injury
Zhang Feng1, Tao Yanyan1,2, Chen Gaofeng1,2
(1InstituteofLiverDiseases,ShuguangHospitalAffiliatedtoShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China; 2KeyLaboratoryofLiverandKidneyDiseases(ShanghaiUniversityofTraditionalChineseMedicine),MinistryofEducation,Shanghai201203,China)
Objective:To study in situ staining of glycogen by modified Periodic acid-schiff (PAS) staining on evaluating acute hepatic injury induced by carbon tetrachloride (CCl4) in rats.Methods:Rats were randomly divided into 2 groups: normal group and model group. Except normal rats, all the other rats in model group were injected subcutaneously 100% CCl4 3mL/kg once, then 50% CCl4 2mL/kg two times a week for 4 times. All the rats were sacrificed on the 15th day. Liver body ratio of rats was calculated; The serum parameters of alanine aminotransferase (ALT), aspartate aminotransferase (AST), total bilirubin (TBil), albumin (Alb) were assayed. Hepatic inflammation was observed with HE staining. Hepatic glycogen was stained by routine PAS staining and improved PAS staining. Results:Compared with the normal group, the activities of ALT and AST and TBil content increased significantly (P< 0.05). Alb content was significantly decreased compared with the normal group (P<0.05). HE staining showed that serious structural damage, hepatic steatosis and ballooning degeneration were seen in model group. Routine PAS staining showed that PAS positive staining area accounted for 32.38%±5.50% in normal group. Compared with the normal group, PAS positive staining area decreased significantly (8.60%±3.34 %,P< 0.01).Improved PAS staining showed that PAS positive staining area accounted for 75 .50%±9.02 % in normal group. Compared with the normal group, Improved PAS positive staining area decreased significantly (17.61%±3.53%,P< 0.01). In normal group and model group, improved hepatic glycogen staining showed positive staining of PAS was significantly higher than that of routine hepatic glycogen staining (P<0.01). This suggests that the improved PAS staining of liver glycogen positive stained area more truly reflected the degree of acute liver injury.Conclusion:The improved of Periodic acid-schiff (PAS) staining method is helpful to improve the evaluation quality degree of acute hepatic injury.
Hepatic glycogen; Acute hepatic injury; Periodic acid-schiff (PAS); Improvement
国家自然科学基金项目(编号:81102701);上海中医药大学实验技术人才队伍建设资助计划[编号:上中医(2012)人字18号];上海市中医临床重点实验室(编号:14DZ2273200)
R-331
A
10.3969/j.issn.1673-7202.2015.02.007

