藏鸡Chemerin和ChemR23基因时序表达及其与肌内脂肪含量的相关性研究
林亚秋,徐亚欧,张润锋,张 明,左 斌,郑玉才
(1.西南民族大学生命科学与技术学院,成都 610041;2.湖北师范学院生命科学学院,黄石 435002)
藏鸡Chemerin和ChemR23基因时序表达及其与肌内脂肪含量的相关性研究
林亚秋1*,徐亚欧1,张润锋2,张 明1,左 斌1,郑玉才1
(1.西南民族大学生命科学与技术学院,成都 610041;2.湖北师范学院生命科学学院,黄石 435002)
本试验旨在阐明藏鸡Chemerin及其受体ChemR23基因的组织和时序表达谱,分析这两个基因mRNA表达水平对肌内脂肪沉积的影响。以孵化0~210日龄的藏鸡为材料,采用RT-PCR方法克隆Chemerin与ChemR23基因,利用荧光定量PCR(qPCR)技术检测两个基因在不同组织及不同发育阶段的表达情况,并将基因表达量与肌内脂肪含量进行相关分析。结果表明,Chemerin与ChemR23基因共同表达于藏鸡所有被检测的组织中,且Chemerin主要在肝、脂肪、肺和肾等组织中表达,而ChemR23在脂肪组织中的表达量最高(P<0.01)。Chemerin与ChemR23在不同发育阶段胸肌和脂肪组织中的表达无性别差异,均在孵化0日龄的胸肌中表达水平最高,在154日龄的皮下脂肪组织中表达水平最高。Chemerin与ChemR23基因在腿肌中的表达存在性别差异,Chemerin与ChemR23在119日龄母鸡腿肌中的表达水平极显著高于其他几个时期(P<0.01);但Chemerin在0和210日龄公鸡腿肌中的表达水平极显著高于其他几个时期(P<0.01),ChemR23在210日龄公鸡腿肌表达水平最高(P<0.01)。Chemerin与ChemR23 mRNA表达量与胸肌IMF含量呈正相关,Chemerin基因mRNA表达水平与腿肌IMF含量呈负相关,ChemR23基因mRNA表达水平与公鸡腿肌IMF含量呈负相关,与母鸡腿肌IMF含量呈正相关。研究结果提示,Chermerin及其受体ChemR23基因可能在藏鸡生长发育过程中对肌内脂肪沉积发挥重要作用,本研究结果为进一步阐明Chermerin及其受体ChemR23基因在藏鸡脂肪代谢中的生物学功能奠定基础。
藏鸡;Chemerin;ChemR23;发育性表达;肌内脂肪含量
随着生活水平的不断提高,人们对鸡肉品质的要求也越来越高。与哺乳动物脂肪沉积不同,禽类脂肪主要来源于肝合成或由肠消化吸收。肉鸡脂肪主要沉积在皮下、内脏(主要为腹脂、肠胃周围)以及肌肉等部位[1]。其中,肌内脂肪(Intramuscular fat,IMF)与肉的嫩度、多汁性以及风味密切相关,是影响肉品质风味的重要因素[2-4]。
动物IMF沉积主要受脂肪细胞分化和脂代谢关键基因表达的调控影响[5-10]。趋化素(Chemerin)基因是1997年首次在银屑病患者的皮肤中发现[11]、并于2007年确认的新的脂肪因子[12],在脂肪因子家族中具有独特的地位,参与脂肪细胞分化与脂代谢[13-14]。ChemR23(又叫CMKLR1)属于G蛋白偶联受体家族的一员,在动物体内广泛表达[15],是Chemerin的天然受体。除了ChemR23外,还发现Chemerin的另外两种孤核受体(Orphan receptor)GPR1和CCRL2[16-17],但CCRL2却不能介导Chemerin的信号转导,是Chemerin的非信号受体。体内的Chemerin主要是与其受体ChemR23结合而发挥作用[18-19]。正常或病理状态(如肥胖)下,Chemerin及其受体在白色脂肪组织的形成过程中发挥着十分重要的作用[20]。Chemerin基因可通过使脂肪细胞内的ERK1/2磷酸化,激活激素敏感脂酶(HSL)的生成来促进3T3-L1脂肪细胞脂解的作用[14]。对3T3-L1前脂肪细胞Chemerin或ChemR23基因表达进行干扰,导致脂肪细胞分化的部分抑制、脂质积累的减少和脂肪细胞分化标志基因PPARγ、adiponectin、perilipin等表达水平的降低[13]。J.Huang等克隆了猪Chemerin及其两个受体基因,指出Chemerin可能通过受体GPR1来调控脂代谢[21]。S.H.Song等分析了Chemerin及其受体ChemR23基因在牛不同组织的分布情况,结果表明,Chemerin及其受体ChemR23基因在牛的脂肪组织和脂肪细胞中高表达[22]。已有的研究主要集中在人、小鼠细胞系、猪和牛上,而Chemerin及其受体ChemR23基因在禽类,尤其在鸡中的表达特性及其与IMF沉积的关系尚未见报道。
藏鸡是我国青藏高原特有的鸡种,其肉质具有高蛋白低脂肪、人体必需氨基酸含量较高,肉质鲜嫩、并且具有腿肌率高、腹脂率低等特点[23],备受人们推崇。本研究以藏鸡为研究对象,分析Chemerin和ChemR23基因的组织表达谱及其在不同发育阶段的胸肌、腿肌和脂肪组织中的时序表达谱,并分析Chemerin和ChemR23基因在肌肉中的表达水平与IMF沉积的关系,为揭示Chemerin和ChemR23在藏鸡脂肪沉积和肉质形成中的生物学功能提供参考。
1 材料与方法
1.1 试验材料
1.1.1 藏鸡及样品的采集 本试验选择孵化0、81、119、154和210日龄的健康藏鸡,其来自成都益生康健农业有限公司的藏鸡养殖基地,位于四川省彭州市的新兴镇狮山村老虎崖。在屠宰之前每组禁食12 h,然后通过放血法屠宰,屠宰后迅速取其右侧胸肌、腿肌和皮下脂肪组织;并同时采集154日龄公母鸡的心、肝、脾、肺、肾、胸肌、腿肌及皮下脂肪等组织。采集的组织样品用锡箔纸包好,置于液氮内带回实验室,-80 ℃放置备用。用于测定肌内脂肪含量的样品去除结缔组织后带回实验室置于-20 ℃备用。0日龄的藏鸡未测定IMF含量。
1.1.2 主要试剂TaqDNA聚合酶和Revert Aid First Strand cDNA Synthesis Kit购自Thermo公司,Trizol、SYBR®Premix Ex Taq TM (2×)、pMD-19T载体购自TaKaRa公司,胶回收试剂盒购于Axygen公司,2 ×TaqPCR Master Mix与感受态细胞DH5α均购自天根生化科技(北京)有限公司。
1.2 试验方法
1.2.1 藏鸡Chemerin和ChemR23基因克隆测序 按照Trizol试剂盒使用指南提取藏鸡皮下脂肪组织总RNA,用紫外分光光度计和琼脂糖凝胶电泳检测总RNA质量。然后取1 μg总RNA进行反转录,以Oligo (dT) 为引物合成cDNA第一链。利用Primer Premier5.0软件,根据GenBank中预测的原鸡(Gallusgallus)Chemerin(NM_001277476)和ChemR23基因的序列(NM_001282407)设计PCR引物(表1)。PCR反应体系为2×LongTaqPCR Master Mix 12.5 μL、Primer F(10 μmol·L-1) 1.0 μL、Primer R(10 μmol·L-1) 1.0 μL、DNA 1.0 μL,ddH2O 9.5 μL。PCR反应条件:94 ℃预变性4 min;94 ℃ 30 s,60 ℃ 1 min,72 ℃ 1 min,39 个循环;72 ℃延伸10 min。用DNA回收试剂盒回收1%琼脂糖凝胶电泳检测后的目的条带,然后连接于PMD-19T载体,转化DH5α后筛选阳性克隆,送生工生物工程上海(股份)有限公司进行序列测定。
表1 克隆和荧光定量PCR引物
Table 1 Primers for cloning and quantitative real-time PCR(qPCR)

名称Name序列(5′⁃3′)Sequence退火温度/℃Tm产物长度/bpProductslength用途UtilizationChemerinChemerinF1:ATGAAGCTGCTGCTGGGCATR1:CTTCCCTTCACTGCACAGCG60.0601克隆ChemR23ChemR23F1:CATGGCGCTTTCCAATTTATR1:TGTTTGTATAAGACCAAGCCCA60.01275克隆ChemerinChemerinF2:GGAGAACAGGAGGAAGCCAGTCR2:TCAGCCTCGTCACGGTGCTT59.0141qPCRChemR23ChemR23F2:ACGCTCCGTGTTTGAGATTGR2:TCACTGAGAGCATTCACCAGC55.2150qPCRGAPDHGAPDHF:CTGCCCAGAACATCATCCCAR:TCCGTCAGGCAGCTCATAG62.0139内参
F.正义链引物;R.反义链引物;GAPDH.3-磷酸甘油醛脱氢酶
F.Forward primer;R.Reverse primer;GAPDH.Glyceraldehyde 3-phosphate dehydrogenase
1.2.2 藏鸡Chemerin和ChemR23基因序列分析 利用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)确定藏鸡Chemerin和ChemR23基因的开放阅读框位置;利用ExPASy(http://www.expasy.org/tools)分析推导蛋白质的等电点和分子量;利用SignalP 4.0(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽序列[24];利用clustalx1.83和DNAMAN软件进行序列比对。
1.2.3 藏鸡Chemerin和ChemR23基因组织表达谱 提取154日龄公鸡和母鸡(公母各3只,共6只)的心、肝、脾、肾、胸肌、腿肌和皮下脂肪总RNA,反转录成cDNA。采用qPCR检测Chemerin及ChemR23基因在藏鸡各组织中的表达差异(引物序列见表1)。PCR反应体系为20 μL:SYBR®Premix ExTaqTM (2×) PCR 10 μL,10 μmol·L-1上下游引物各0.5 μL,模板cDNA 1 μL,ddH2O 8 μL。PCR反应条件:95 ℃预变性1 min;95 ℃ 30 s,55.2~62.0 ℃ 30 s,45个循环。
1.2.4 藏鸡胸肌、腿肌和皮下脂肪中Chemerin和ChemR23基因时序表达谱 分别提取孵化0、81、119、154和210日龄的健康藏公鸡和母鸡(每个阶段公母各10只,共100只)胸肌、腿肌和皮下脂肪的总RNA,并取1 μg总RNA反转录成cDNA。利用qPCR 检测Chemerin和ChemR23在不同发育阶段藏鸡胸肌、腿肌和皮下脂肪的表达差异。反应体系及反应条件同1.2.3。
1.2.5 IMF的测定 采用索氏抽提法测定不同阶段藏鸡胸肌和腿肌(81~210日龄,每个阶段公母各15只,共120只)中的IMF含量,按照公式计算IMF含量:
式中,x表示浸提前样品干重,y表示浸提后的样品干重。
1.2.6 数据统计分析 数据用“平均值±标准差”表示,基因组织差异定量分析结果以心的Ct值为对照来计算,不同发育阶段以孵化0日龄为对照,结果用2-ΔΔCt方法进行统计分析[25]。最终结果以SPSS 18.0软件中的One-way ANOVA进行显著性检验分析,基因的表达量与IMF含量的相关用Bivariate Correlations 进行分析。当P<0.05 时,表示差异显著,当P<0.01 时,表示差异极显著。
2 结 果
2.1 藏鸡骨骼肌IMF含量测定
如图1所示,公鸡胸肌IMF随着日龄增加而呈上升趋势,但各个阶段无显著差异(P>0.05);119日龄公鸡腿肌IMF含量极显著高于其他各个阶段(P<0.01)。154和210日龄母鸡胸肌IMF含量极显著高于其81和119日龄两个阶段(P<0.01);154和210日龄母鸡腿肌IMF含量极显著高于81日龄(P<0.01),显著高于119日龄(P<0.05)。

IMF在孵化0天没有测定(表示为0)。IMFbr-male.公鸡胸肌肌内脂肪含量;IMFbr-female.母鸡胸肌肌内脂肪含量;IMFth-male.公鸡腿肌肌内脂肪含量;IMFth-female.母鸡腿肌肌内脂肪含量;每个性状n=15.同一性别同一组织不同阶段大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),相同字母表示无显著差异(P>0.05)IMF could not be measured at 0 day (all shown as 0).IMFbr-male.IMF content of breast muscle of male;IMFbr-female.IMF content of breast muscle of female;IMFth-male.IMF content of thigh muscle of male;IMFth-female.IMF content of thigh muscle of female.n=15 for each trait.Different capital letters show significant differences(P<0.01),different small letters show obvious differences (P<0.05),no obvious difference is indicated by the same letter (P>0.05),comparing the IMF contents of the tissues from the chicken with same sex but different ages图1 藏鸡胸肌和腿肌IMF含量Fig.1 IMF in breast and thigh muscle across ages of Tibetan chickens
2.2 藏鸡Chemerin和ChemR23基因克隆
本试验获得藏鸡Chemerin基因序列长601 bp(GenBank登录号为KP729054),其中ORF为489 bp,编码162个氨基酸,与原鸡(Gallusgallus)该基因的同源性为100%(图2A)。获得藏鸡ChemR23 基因序列长1 275 bp(GenBank登录号为KP729055),其中ORF为1 083 bp,编码360个氨基酸,与原鸡该基因相似序列的同源性为99%,有4个氨基酸发生突变(图2B)。Chemerin蛋白具有信号肽结构,信号肽切割位点在17~18氨基酸,该信号肽区域在1~17个氨基酸序列。ChemR23无信号肽结构。2.3 藏鸡Chemerin和ChemR23基因的组织表达谱
Chemerin基因在154日龄公鸡的肝中表达最高,极显著高于其他各个组织(P<0.01),其次在肺、肾、脂肪和脾组织中表达水平较高,均极显著高于其他各个组织(P<0.01);Chemerin基因在154日龄母鸡的脂肪组织中表达最高,极显著高于其他各组织(P<0.01),在肝、肺和肾中有较高水平的表达,均极显著高于心、脾、胸肌和腿肌中的表达水平(P<0.01)(图3A,3B)。
ChemR23基因在154日龄公鸡和母鸡的脂肪组织中表达最高,极显著高于其他各个组织的表达水平(P<0.01),在肺和脾组织的表达水平次之 (图3C,3D)。

序列比对采用clustalx1.83 和 DNAMAN软件来进行The alignment was performed with Sequence Alignment by clustalx1.83 and DNAMAN图2 藏鸡Chemerin (A) 及ChemR23 (B)推测的氨基酸序列与原鸡氨基酸序列比对Fig.2 Comparison of the predicted amino acid sequences of Tibetan chickens (A) Chemerin and (B) ChemR23 with Gallus gallus
2.4 藏鸡Chemerin和ChemR23基因的时序表达谱
本试验依据所研究鸡种的脂肪生长发育特点选择0~210日龄藏鸡的胸肌、腿肌和皮下脂肪组织,检测Chemerin和ChemR23基因的时序表达情况。结果指出,Chemerin基因在0日龄公鸡和母鸡胸肌中的表达水平极显著高于其他日龄(P<0.01)(图4A)。Chemerin基因在藏鸡腿肌中的表达存在性别差异,Chemerin基因在公鸡孵化0与210日龄的腿肌中的表达水平极显著高于其他3个时期的表达水平(P<0.01);Chemerin基因在119日龄的母鸡腿肌中的表达水平则最高,极显著高于其他几个时期(P<0.01)(图4B);Chemerin基因均在154日龄的公鸡和母鸡皮下脂肪中表达水平最高,极显著高于其他几个时期的表达水平(P<0.01)(图4C)。
ChemR23在公鸡和母鸡胸肌中的表达趋势一致,均在0日龄表达水平最高。在0日龄公鸡胸肌中ChemR23表达水平显著高于154和210日龄的表达水平(P<0.05),在0日龄母鸡胸肌的表达水平极显著高于其他日龄的表达水平(P<0.01)(图4D)。ChemR23在藏鸡公鸡和母鸡腿肌中的表达规律却不同。ChemR23在210日龄的公鸡腿肌中表达水平极显著高于其他日龄的表达水平(P<0.01),在119日龄母鸡腿肌中的表达水平极显著高于其他日龄(P<0.01)(图4E);ChemR23基因在154日龄公鸡和母鸡皮下脂肪中表达水平最高,在154日龄公鸡脂肪组织中表达水平极著高于其他日龄(P<0.01),在154日龄母鸡脂肪组织中表达水平高于81和119日龄,极显著高于0和210日龄(P<0.01)(图4F)。

A、B表示荧光定量检测Chemerin基因在藏鸡各组织中的表达水平;C、D表示荧光定量检测ChemR23基因在藏鸡各组织中的表达水平。GAPDH作为内参。数据用“平均值±标准差”表示(n=3)。不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),相同字母表示无显著差异(P>0.05)The mRNA expression levels of Chemerin (A,B) and ChemR23(C,D) were quantitated in various tissues by qRT-PCR and normalized using GAPDH.Data were presented “mean ±SD” (n=3 for each mean).Different capital letters show significant differences (P<0.01),different small letters show significant differences (P<0.05),no obvious difference is indicated by the same letter (P>0.05)图3 藏鸡Chemerin及ChemR23的组织分布Fig.3 Tissue expression of Chemerin and ChemR23 in Tibetan chickens
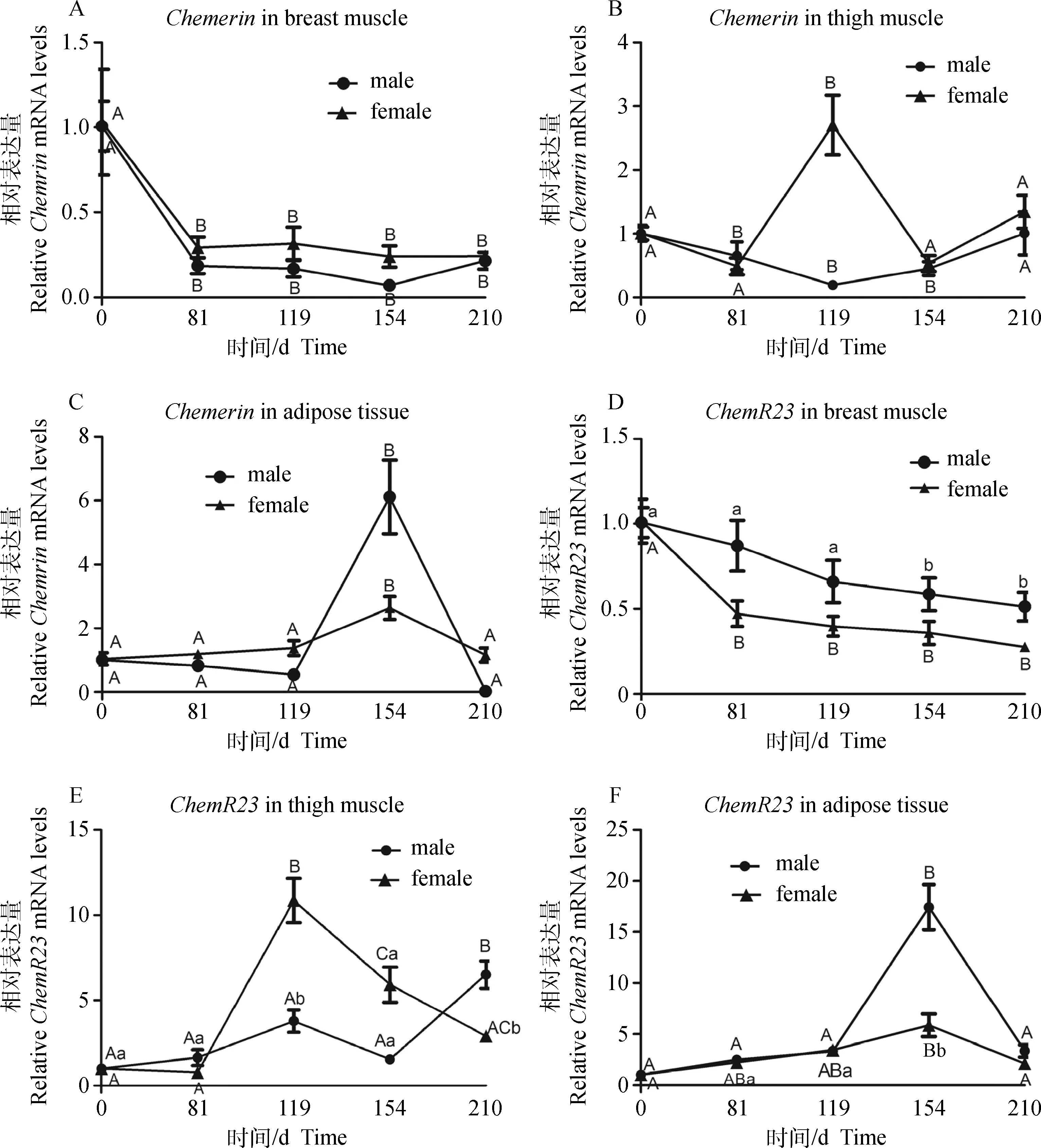
A、B、C表示荧光定量检测Chemerin基因在藏鸡胸肌、腿肌和脂肪组织中的表达水平,D、E、F表示荧光定量检测ChemR23基因在藏鸡胸肌、腿肌和脂肪组织中的表达水平。GAPDH作为内参。数据用“平均值±标准差”表示(n=10)。同一性别同一组织不同阶段大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),相同字母表示无显著差异(P>0.05)The mRNA expression levels of Chemerin in breast muscle,thigh muscle and adipose tissue(A,B,C) and ChemR23 in breast muscle,thigh muscle and adipose tissue(D,E,F) were quantitated in various tissues by qRT-PCR and normalized using GAPDH.Data were presented” mean ±SD”(n=10 for each mean).Different capital letters show significant differences(P<0.01),different small letters show obvious differences (P<0.05),no obvious difference is indicated by the same letter (P>0.05),comparison were the IMF contents of the tissues from the chicken with same sex but different age图4 Chemerin及ChemR23在不同发育阶段藏鸡3种组织中的表达水平Fig.4 Chemerin and ChemR23 mRNA expression in 3 tissues of Tibetan chickens at different ages
2.5 藏鸡不同肌肉组织Chemerin和ChemR23基因mRNA表达水平与IMF含量的相关性
藏鸡不同生长发育阶段不同部位肌肉组织基因表达水平(每个阶段公母各10只)与IMF含量(每个阶段公母各15只)的相关分析结果表明,Chemerin和ChemR23基因在藏鸡胸肌各个阶段的表达水平与相对应的IMF含量呈不同程度的正相关,相关系数见表2。由表2可见,Chemerin和ChemR23基因mRNA表达水平与胸肌IMF含量的相关性无性别差异,均呈不同程度正相关,且在公鸡上相关性达到显著水平相关系数分别为0.347和0.336(P<0.05),在母鸡的相关系数分别为0.031和0.173;Chemerin和ChemR23基因mRNA表达水平与公鸡腿肌的IMF含量均呈负相关,相关系数分别为-0.055和-0.052;Chemerin基因mRNA表达水平与母鸡腿肌IMF含量呈负相关,相关系数为-0.031,ChemR23基因mRNA表达水平与母鸡腿肌IMF含量呈正相关,相关系数为0.118。
3 讨 论
Chemerin是脂肪因子(Adipokines)的成员之一,在维持机体平衡中具有多重的重要作用,包括肥胖、糖尿病、代谢综合征、胰岛素抵抗、心血管疾病等[12,19,26-30]。关于Chemerin和ChemR23的研究主要集中在啮齿动物和哺乳动物上,在禽类中少有报道。为了揭示Chemerin基因在禽类脂肪沉积中的作用,本试验克隆获得藏鸡Chemerin及其受体ChemR23的基因序列,发现藏鸡的Chemerin及ChemR23推测的氨基酸序列与NCBI上登录的原鸡氨基酸序列同源性分别为100%和99%,说明同源性极高。并且利用软件预测发现Chemerin蛋白具有信号肽结构,但其受体ChemR23则无信号肽序列。
为了阐明Chemerin及其受体ChemR23基因在藏鸡脂肪沉积中的作用,本试验检测了其在藏鸡各组织中的表达情况。结果发现,Chemerin及其受体基因在藏鸡中的表达谱与其他动物存在一些相似及不同之处。Chemerin在人体的多种组织广泛表达,其中主要表达于白色脂肪组织、肝和肺[31]。在小鼠中,Chemerin基因在白色脂肪组织、肝和胎盘表达最高,卵巢次之,其他组织中的表达约低于肝的5%[32]。Chemerin基因主要在猪的肝、脂肪组织和肾组织中表达,在肌肉中未检测到表达[21];ChemR23基因主要表达在猪脾、皮下和附睾的白色脂肪组织,在胃和肺中表达水平较低[21]。ChemR23在啮齿类动物肺中表达水平很高[12,14],这与本试验结果相似。Chemerin基因主要在牛脂肪、肝和肾中高表达,ChemR23则广泛表达于脑、脑垂体、胃、心、肝、肺、肾、骨骼肌和脂肪等组织中[22]。本研究发现,Chemerin及其受体ChemR23基因广泛表达于藏鸡包括胸肌和腿肌的各个组织中,其中Chemerin主要在藏鸡的脂肪、肝、肺和肾中表达,ChemR23主要在脂肪组织中表达,在肺和脾中也存在较高水平的表达;Chemerin及其受体ChemR23基因在藏鸡的不同组织中表达存在差异的原因推测可能是在某些组织中Chemerin基因发挥作用是通过其他两个受体来实现的。综合多项研究结果推测,Chemerin与ChemR23基因的组织表达具有物种特异性。
表2 藏鸡Chemerin和ChemR23基因的表达水平与IMF含量的相关性分析
Table 2 The correlation ofChemerinandChemR23 gene expressions and IMF content in muscles of different parts in Tibetan chickens

部位Differentpart性别SexChemerin基因mRNAChemerinmRNAexpressionChemR23基因mRNAChemR23mRNAexpression胸肌Breastmuscle公鸡r=0.347∗(P=0.028)r=0.336∗(P=0.030)母鸡r=0.031(P=0.434)r=0.173(P=0.172)腿肌Thighmuscle公鸡r=-0.055(P=0.386)r=-0.052(P=0.390)母鸡r=-0.031(P=0.433)r=0.118(P=0.264)
从本试验组织表达谱结果发现,Chemerin及受体ChemR23基因在藏鸡皮下脂肪组织中均存在较高水平的表达,推测可能在皮下脂肪细胞分化中具有重要调控作用。因此阐明Chemerin及受体ChemR23基因在皮下脂肪的时序表达谱具有重要意义,结果指出Chemerin及受体ChemR23基因在不同发育阶段藏公鸡和母鸡的皮下脂肪组织中的表达趋势一致,具有协同关系,推测Chemerin在藏鸡脂肪细胞分化中的作用是通过其受体ChemR23来实现的,且在154日龄时分化水平达到最高。研究指出,随着小鼠胚胎成纤维细胞(3T3-L1) 分化为成熟脂肪细胞,Chemerin表达显著升高,主要在成熟脂肪细胞中表达[12,32]。关于ChemR23基因在脂肪细胞中的表达却有不同的报道,K.Bozaoglu等指出,随着3T3-L1前脂肪细胞的分化,ChemR23表达水平下调[12];而S.G.Roh等指出,随着人脂肪细胞和3T3-L1细胞分化的进行,ChemR23表达水平与Chemerin基因表达水平一致,均明显增加[14],这与本试验结果一致。
前人研究指出,肥胖患者的脂肪组织中Chemerin分泌量显著高于非肥胖者脂肪组织分泌的量[27],而且Chemerin基因及受体ChemR23基因可能在女性肥胖中发挥重要作用[33],非肥胖个体中Chemerin基因变异与内脏脂肪含量的升高显著相关[34],推测该基因作用可能促进脂肪沉积,但其是否参与动物IMF沉积尚不清楚。因此为了阐明Chemerin及受体ChemR23基因与藏鸡IMF沉积的关系,本试验将它们在不同发育阶段藏鸡胸肌和腿肌中的mRNA表达水平与IMF含量进行了相关分析,结果表明,Chemerin及其受体ChemR23基因在胸肌和腿肌中的mRNA表达水平与IMF含量具有一定相关性,并且在公鸡中的相关性显著,在母鸡中的相关性不显著,提示其在藏鸡IMF沉积中具有性别特异性。但Chermerin及其受体ChemR23对藏鸡IMF沉积的具体作用及机制需进一步试验验证。
4 结 论
本研究克隆得到藏鸡Chemerin及受体ChemR23基因序列,均包含完整的开放阅读框,GenBank登录号分别为KP729054和KP729055。Chemerin与ChemR23广泛表达于154日龄藏鸡各个组织中,其中Chemerin基因主要在肝、脂肪、肺和肾中有较高水平的表达,ChemR23基因主要在脂肪、肺和脾组织中表达。Chemerin和ChemR23在不同发育阶段藏鸡胸肌和脂肪组织中的表达无性别差异,但在不同发育阶段藏鸡腿肌中的表达却存在性别差异。不同部位Chemerin与ChemR23基因mRNA表达量与IMF含量呈不同程度的相关性。本试验为进一步研究Chemerin与ChemR23基因在藏鸡IMF沉积中的调控作用提供重要的基础理论数据。
[1] CAHANER A,NITSAN Z,NIR I.Weight and fat content of adipose and nonadipose tissues in broilers selected for or against abdominal adipose tissue[J].PoultSci,1986,65:215-222.
[2] WOOD J D.Effects of carcass fatness and sex on the composition and quality of pigmeat[C].Brisbane Australia:34th International Congress of Meat Science and Technology,1988:562-564.
[3] GEAY Y,BAUCHART D,HOCQUETTE J F,et al.Effect of nutritional factors on biochemical,structural and metabolic characteristics of muscles in ruminants[J].ReprodNutrDev,2001,41:1-26.
[4] GONDRET F,LEBRET B.Feeding intensity and dietary protein level affect adipocyte cellularity and lipogenic capacity of muscle homogenates in growing pigs,without modification of the expression of sterol regulatory element binding protein[J].JAnimSci,2002,80:3184-3193.
[5] GERBENS F,VERBURG F J,VAN MOERKERK H T,et al.Associations of heart and adipocyte fatty acid-binding protein gene expression with intramuscular fat content in pigs[J].JAnimSci,2001,79:347-354.
[6] HUANG Z G,XIONG L,LIU Z S,et al.The developmental changes and effect on IMF content of H-FABP and PPARγ mRNA expression in sheep muscle[J].ActaGeneticaSinica,2006,33:507-514.
[7] KAKUMA T,LEE Y,HIGA M,et al.Leptin,troglitazone,and the expressing of sterol regulatory element binding proteins in liver and pancreatic islets[J].PNAS,2000,97:8536-8541.
[8] CHEN J,YANG X J,XIA D,et al.Sterol regulatory element binding transcription factor 1 expression and genetic polymorphism significantly affect intramuscular fat deposition in the longissimus muscle of Erhualian and Sutai pigs[J].JAnimSci,2008,86:57-63.
[9] YE Y,LIN S,MU H,et al.Analysis of differentially expressed genes and signaling pathways related to intramuscular fat deposition in skeletal muscle of sex-linked dwarf chickens[J].BioMedResInt,2014,2014:724274.
[10] SHU J T,ZHANG M,SHAN Y J,et al.Analysis of the genetic effects of CAPN1 gene polymorphisms on chicken meat tenderness[J].GenetMolRes,2015,14:1393-1403.
[11] NAGPAL S,PATEL S,JACOBE H,et al.Tazarotene-induced gene 2(TIG2),a novel retinoid-responsive gene in skin[J] .JInvestDernatol,1997,109:91-95.
[12] BOZAOGLU K,BOLTON K,MCM ILLAN J,et al,Chemerin is a novel adipokine associated.with obesity and metabolic syndrome[J].Endocrinology,2007,148(10):4687-4694.
[13] TAKAHASHI M,TAKAHASHI Y,TAKAHASHI K,et al.Chemerin enhances insulin signaling and potentiates insulin - stimu lated glucose uptake in 3T3-L1 adipocytes[J] .FEBSLett,2008,582:573-578.
[14] ROH S G,SONG S H,CHOI K C,et al.Chemerin-a new adipokine that modulates adipogenesis via its own receptor[J].BiochemBiophysResCommun,2007,362:1013-1018.
[15] KAUR J,ADYA R,TAN B K,et al.Identification of Chemerin receptor(ChemR23) in human endothelial cells:Chemerin-induced endothelial angiogenesis[J].BiochemBiophysResCommun,2010,391:1762-1768.

[17] BARNEA G,STRAPPS W,HERRADA G,et al.The genetic design of signaling cascades to record receptor activation[J].PNAS,2008,105:64-69.
[18] MEDER W,WENDLAND M,BUSMANN A,et al.Characterization of human circulating TIG2 as a ligand for the orphan receptor ChemR23[J].FEBSLett,2003,555:495-499.
[19] WITTAMER V,BONDUE B,GUILLABERT A,et al.Neutrophil-mediated maturation of Chemerin:a link between innate and adaptive immunity[J].JImmunol,2005,175:487-493.
[20] ZABEL B A,ZUNIGA L,OHYAMA T,et al.Chemoattractants,extracellular proteases,and the integrated host defenseresponse[J].ExpHematol,2006,34:1021-1032.
[21] HUANG J,ZHANG J,LEI T,et al.Cloning of porcine Chemerin,ChemR23 and GPR1 and their,involvement in regulation of lipogenesis[J].BMBReports,2010,43:491-498.
[22] SONG S H,FUKUIB K,NAKAJIMAC K,et al.Cloning,expression analysis,and regulatory mechanisms of bovine Chemerin and Chemerin receptor[J].DomestAnimEndocrinol,2010,39:97-105.
[23] 强巴央宗,张 浩,商 鹏,等.藏鸡屠宰性能及肉质特性[J].中国农业大学学报,2008,13:47-50. CHAMBA Y Z,ZHANG H,SHANG P,et al.Carcass characteristics and meat quality of Tibetan chicken[J].JournalofChinaAgriculturalUniversity,2008,13:47-50.(in Chinese)
[24] PETERSEN T N,BRUNAK S,HEIJNE G,et al.SignalP 4.0:discriminating signal peptides from transmembrane regions[J].NatMethods,2011,8:785-786.[25] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod[J].Methods, 2001,25:402-408.
[26] WEIGERT J,NEUMEIER M,WANNINGER J,et al.Systemic Chemerin is related to inflammation rather than obesity in type 2 diabetes[J].ClinEndocrinol(Oxf),2010,72:342-348.
[27] SELL H,LAURENCIKIENE J,TAUBE A,et al.Chemerin is a noveladipocyte-derived factor inducing insulin resistance in primaryhuman skeletal muscle cells[J].Diabetes,2009,58:2731-2740.
[28] FATIMA S S,REHMAN R,BAIG M,et al.New roles of the multidimensional adipokine:Chemerin[J].Peptides,2014,62:15-20.
[29] KORT D H,KOSTOLIAS A,SULLIVAN C,et al.Chemerin as a marker of body fat and insulin resistance in women with polycystic ovary syndrome[J].GynecolEndocrinol,2015,31:152-155.
[30] WARGENT E T,ZAIBI M S,O'DOWD J F,et al.Evidence from studies in rodents and in isolated adipocytes that agonists of the chemerin receptor CMKLR1 may be beneficial in the treatment of type 2 diabetes[J].PeerJ,2015,3:e753.
[31] ZABEL B A,SILVERIO A M,BUTCHER E C.Chemokine-like receptor 1 expression and Chemerin-distinguish plasmacytoid from myeloid dendritic cells in human blood[J].JImmunol,2005,174:244-251.
[32] GORALSKI K B,MCCARTHY T C,HANNIMAN E A,et al.Chemerin:a novel adipokine that regulates adipogeneis and adipocyte metabolism[J].JBiolChem,2007,282:28175-28188.
[33] LI X M,JI H,LI C J,et al.Chemerin expression in Chinese pregnant women with and without gestational diabetes mellitus[J].AnnEndocrinol,2015,76:19-24.[34] MÜSSIG K,STAIGER H,MACHICAO F,et al.RARRES2,encoding the novel adipokine Chemerin,is a genetic determinant ofdisproportionate regional body fat distribution:a comparative magnetic resonance imaging study[J].Metabolism,2009,58:519-524.
(编辑 郭云雁)
Association Analysis of Sequential Expression ofChemerinandChemR23 with Intramuscular Fat Contents in Tibetan Chicken
LIN Ya-qiu1*,XU Ya-ou1,ZHANG Run-feng2,ZHANG Ming1,ZUO Bin1,ZHENG Yu-cai1
(1.CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China;2.CollegeofLifeSciences,HubeiNormalUniversity,Huangshi435002,China)
This study aimed to clarify the tissue and sequential expression profiles ofChemerinandChemR23 genes in Tibetan chicken,and to investigate the impacts of the 2 genes expressions on intramuscular fat (IMF) deposition.In this study,Tibetan chicken (0-210 day) was used as experimental animals and the RT-PCR method were employed to amplify theChemerinandChemR23 genes.Their relative expression was measured by fluorescent quantitative PCR in various tissues and at different developmental stages.The correlation analysis was performed between gene expression and IMF content.The results indicated that expression ofChemerinandChemR23 was detected broadly in different tissues.Chemerinwas mostly expressed in liver,adipose tissue,lung and kidney of Tibetan chicken, whileChemR23 was expressed in adipose tissue at significantly higher levels than in other tissues (P<0.01).The highest levels were in breast muscle at day 0 and in adipose tissue at day 154,but the expression patterns of the 2 genes in breast muscle and adipose tissue at different developmental stages were not correlated with gender.However,their expression patterns in the thigh muscle were correlated with gender.In female thigh muscle,the relative expression levels of both genes were significantly higher at day 119 than other periods (P<0.01),but in male thigh muscle,the relative expression level ofChemeringenes were significantly higher at day 0 and 210 than other periods (P<0.01).The peak expression ofChemR23 presented at day 210 in male thigh muscle.The expression ofChemerinandChemR23 mRNA was positively correlated with IMF content in breast muscle,whereasChemerinexpression was negatively correlated with IMF content in thigh muscle.Interestingly,ChemR23 expression was negatively and positively correlated with IMF content of male and female thigh muscle,respectively.The results suggest thatChemerinandChemR23 genes may play critical roles in IMF deposition during growth and development of Tibetan chicken,which will help us to understand the biological functions ofChemerinandChemR23 genes in fat metabolism of Tibetan chicken.
Tibetan chicken;Chemerin;ChemR23;developmental expression;IMF content
10.11843/j.issn.0366-6964.2015.08.003
2015-03-23
四川应用基础项目(2013JY0044);四川省畜禽育种攻关项目(2011NZ0099-6)
林亚秋(1976-),女,内蒙古海拉尔人,博士,主要从事动物遗传育种研究
*通信作者:林亚秋,副教授,E-mail:linyq1999@163.com
S831.2
A
0366-6964(2015)08-1290-10

