牦牛乳腺上皮细胞体外培养及鉴定
陈亚冰,符 梅,兰道亮,林宝山,黄 偲,李 键*
(1.西南民族大学生命科学与技术学院,成都 610041; 2.西南民族大学青藏高原研究院,成都 610041)
牦牛乳腺上皮细胞体外培养及鉴定
陈亚冰1,符 梅1,兰道亮2,林宝山1,黄 偲1,李 键2*
(1.西南民族大学生命科学与技术学院,成都 610041; 2.西南民族大学青藏高原研究院,成都 610041)
本研究旨在建立牦牛乳腺上皮细胞系,并对建立的细胞系生物学特性进行鉴定,采用组织块种植法,分离培养乳腺上皮细胞;通过胰酶消化法纯化细胞;利用免疫荧光及Western blot技术对其进行鉴定;脂质体介导法将绿色荧光蛋白基因转染进乳腺上皮细胞中,荧光显微镜下检测绿色荧光蛋白基因表达;金黄色葡萄球菌侵染牦牛乳腺上皮细胞,流式细胞仪(AnnexinV/PI 双染法)检测乳腺上皮细胞的凋亡,RT-PCR检测感染细胞中抗菌肽以及凋亡因子表达。结果表明,分离纯化获得牦牛乳腺上皮细胞,细胞角蛋白18表达呈阳性,波形蛋白表达呈阴性,证明培养的细胞是上皮细胞并且没有成纤维细胞污染;β-酪蛋白表达呈阳性,说明建立的乳腺上皮细胞具有一定的泌乳功能;荧光显微镜能够检测到绿色荧光蛋白表达,表明EGFP基因成功导入了乳腺上皮细胞;金黄色葡萄球菌感染牦牛乳腺上皮细胞3 h后, Annexin V/PI 双染法检测发现感染组细胞凋亡率明显升高,差异显著(P<0.05);感染细胞中TAP(P<0.01)、BNBD5(P<0.01)及BAX(P<0.01)表达量明显增高,BCL-2(P<0.05)表达量降低。综上表明,本研究成功建立了一株稳定的牦牛乳腺上皮细胞系,该细胞系能够作为研究牦牛乳腺发育及分化的体外研究模型。
牦牛;乳腺上皮细胞;培养;鉴定
保留乳腺特异性功能的乳腺上皮细胞系可以作为研究乳腺发育、分化以及乳腺生物反应器的理想模型[1-4]。牦牛(Bosgrunniens)是主要分布于海拔3 000 m以上青藏高原及其周边高寒地区的物种,牦牛在藏区人民的日常生活中扮演着重要角色。与奶牛相比,牦牛年产奶量仅250 kg左右,但牦牛奶品质较高,干物质占到17.31%~18.40%。选择性育种及现代饲养技术虽然能够有助于提高牦牛的产奶量,但这种产量的增加是有限的。探究牦牛特殊泌乳机制能够为提高牦牛泌乳量提供理论基础,而牦牛乳腺上皮细胞系的建立可为研究牦牛泌乳调控机制提供理想的体外模型。在人[5]、鼠[6]、羊[7-8]、奶牛[9-10]、水牛[11-12]均已建立乳腺上皮细胞系,所建立的乳腺上皮细胞既可以用于研究乳蛋白基因表达及乳汁分泌机制,又可以作为研究干乳期细胞凋亡及乳腺退化的宝贵材料,同时还可以作为乳腺特异性表达载体的检测系统,并用于评价乳腺特异性表达载体的有效及合理性[13]。由于物种的差异性,针对某种物种的乳腺上皮细胞生物学特性的研究并不能完全适用于其他物种,因此,牦牛乳腺上皮细胞系的建立对于研究牦牛乳腺生物学具有重要作用,也可以为构建基因组文库、体细胞克隆及基因遗传多样性等研究提供理想生物学材料。
1 材料与方法
1.1 材料
乳腺组织采自成都市青白江屠宰场屠宰的泌乳后期健康牦牛。
1.2 主要试剂
EGFP-N1载体购自Promega公司;甘露醇培养基购自青岛拓扑生物公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自BD公司;FBS及胰酶购自GIBCO公司;Hochest 33342染料购自碧云天生物技术有限公司;DMEM/F12及青链霉素双抗购自Hyclone公司;氢化可的松、胰岛素、转铁蛋白、L-谷氨酰胺、EGF及孕酮购自Sigma公司;Trizol 购自Invitrogen 公司;cDNA反转录试剂盒购自Ferments 公司。
1.3 乳腺上皮细胞的分离培养及鉴定
剪取牦牛乳腺组织,切取少量乳腺组织块,置于含有100 μg·mL-1青霉素、100 μg·mL-1链霉素的DPBS中,于冰盒中迅速带回实验室。在超净工作台中去除脂肪及结缔组织,用DPBS反复冲洗3~5遍,直到洗干净为止。在含有微量培养液的培养皿中,将乳腺组织尽量剪成大小为1 mm3的组织块。将组织块接种到培养皿上,将培养皿置于37℃、体积分数为5% 的CO2培养箱中倒置培养4 h左右,尽量让细胞贴壁,然后加入适量培养液,放回培养箱中培养。培养基每隔2 d 更换1次,待细胞基本长满培养皿底壁,吸去原培养基,用DPBS清洗细胞3次,加入0.25%的胰酶,采用差时胰酶消化法分离纯化获得乳腺上皮细胞。
1.4 免疫荧光染色鉴别角蛋白18(Cytokeratin 18)及波形蛋白(Vimentin)
细胞免疫荧光染色鉴定细胞是否表达角蛋白18(上皮细胞标记蛋白)、波形蛋白(成纤维细胞标记蛋白),从而验证细胞是上皮细胞并检验是否被成纤维细胞污染。消化传代的上皮细胞按每孔5×104个细胞接种于24孔板,待细胞铺满80%~90%时,吸去培养液,用DPBS洗涤2次; 4%多聚甲醛室温固定30 min,DPBS冲洗细胞3次;用0.5%的Triton-100 通透处理细胞5 min,DPBS洗3次;1% BSA封闭 20 min,去除封闭液,甩干;加适量一抗,4 ℃过夜孵育;吸去一抗,DPBS冲洗3次,加入 FITC标记二抗,作用1 h,DPBS冲洗3次;Hochest33342避光孵育10 min,荧光显微镜下观察结果。
1.5 Western-blot 检测β-酪蛋白的表达
牦牛乳腺上皮细胞长到80%~90%丰度时,分成2组分别培养:一组加入诱导培养基(90% DMEM/F12+10% FBS+5 μg·mL-1胰岛素+5 μg·mL-1孕酮+5 ng·mL-1表皮生长因子+1 μg·mL-1孕酮+5 μg·mL-1ITS+1 μg·mL-1氢化可的松+1 00 μg·mL-1青、链霉素 );另一组只加入正常的生长培养基(90% DMEM/F12+10% FBS+1 00 μg·mL-1青、链霉素)。细胞培养后,根据Qiagen公司的蛋白质提取试剂盒说明书分别提取诱导组及非诱导组乳腺上皮细胞总蛋白质,提取总蛋白,Western blot检测酪蛋白的表达,另外提取乳腺组织、成纤维细胞总蛋白分别作为阳性、阴性对照组。
1.6 EGFP-N1转染牦牛乳腺上皮细胞
转染前24 h,将牦牛乳腺上皮细胞以5×104个·mL-1密度接种于24孔板,每孔加入500 μL培养基(含血清及无抗生素),待细胞长到80%汇合时,备用。转染前2 h,细胞换液,加入无血清无双抗DMEM培养基;将3 μL脂质体加入到50 μL DMEM/F12中稀释,温和混匀,室温作用5 min;将 1 μg质粒加入到50 μL DMEM/F12中稀释,室温作用5 min;混合稀释的质粒和脂质体,室温静置20 min,形成DNA-脂质体混合物;将混合液加到24孔板中,4 h后换用完全培养基继续培养;24 h后在荧光显微镜下观察绿色荧光蛋白的表达情况,加入G418对转染的细胞进行筛选。
1.7 金黄色葡萄球菌侵染牦牛乳腺上皮细胞
金黄色葡萄球菌(ATCC29525)于甘露醇培养基中划线并37 ℃过夜培养,挑取单菌落于甘露醇肉汤培养基中扩大培养12 h,3 000 r·min-1,离心5 min收集菌体,收集的菌体用DMEM/F12重悬。将重悬的菌体以MOI=100∶1的比例接种于生长至85% 的乳腺上皮细胞中侵染3 h,同时设置以不被菌体感染细胞作为对照组。
1.7.1 金黄色葡萄球菌诱导牦牛乳腺上皮细胞凋亡检测 采用 AnnexinV-FITC/PI双染法检测细胞凋亡,具体流程:侵染试验完成后,收集上清至 15 mL 离心管中;胰蛋白酶消化贴壁细胞成单个细胞悬液;1 000 r·min-1离心 3 min,收集消化的细胞并与上清中的细胞合并。调整细胞密度达到1×106个·mL-1,取100 μL细胞悬液,分别加入5 μL Annexin V-FITC 和 5 μL PI,室温下避光孵育 15 min,1 h 内流式细胞仪检测细胞凋亡。
1.7.2 定量PCR检测抗菌肽及凋亡因子表达 细胞侵染3 h后移除培养液,DPBS洗2次,向培养皿中加入Trizol提取细胞总RNA,反转录获得的cDNA于-20 ℃保存备用。采用荧光定量PCR检测抗菌肽、凋亡因子在细胞中的表达量。定量引物序列见表1,其中定量PCR反应体系为15 μL:SYBR Premix Ex TaqTM II 7.5 μL,上、下游引物各0.5 μL,模板1 μL,dH2O 5.5 μL。PCR扩增程序:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸20 s,39个循环,添加熔解曲线;每个组织样品进行3个重复,GAPDH基因被选用作为内参基因。
表1TAP、BNBD5、BAX及BCL-2基因定量引物序列
Table 1 RT-PCR primers used in this study forTAP,BNBD5,BAX,andBCL-2 genes

基因Genes引物序列(5'-3')Sequencesofprimers退火温度/℃Theannealingtemperature扩增片段长度/bpLengthofamplifiedfragmentTAPCTCCATCACCTGCTCCTCGGCCCAACACAGGTGCCAA58.5160BNBD5GCCAGCATGAGGCTCCATCTTGCCAGGGCACGAGATCG58143BAXTGGACATTGGACTTCCTTCGTGAGCACTCCAGCCACAAAG58100BCL-2AGGGACGGGGTGAACTGGCATACAGCTCCACAAGG60193GAPDHGCTGGTGCTGAGTAGTTGGTGTCTTCTGGGTGGCAGTGATGG60220
荧光定量结果采用相对定量的2-△△CT法进行数据分析,并用Spass 18.0软件进行数据处理。
2 结 果
2.1 牦牛乳腺上皮细胞培养及鉴定
2.1.1 牦牛乳腺上皮细胞的分离培养 组织块接种7 d后,可见有成纤维细胞从组织块中游离出来(图1A),继续培养10 d以后,有上皮细胞长出来(图1B)。胰酶差时消化获得成纤维细胞及乳腺上皮细胞,获得的成纤维细胞成扁纤维状结构(图1C),纯化后的上皮细胞呈多种形态,当细胞密度比较低的时候,乳腺上皮细胞呈岛屿状生长(图1D),细胞长到汇集到80%时呈现鹅卵石形(图1E),此时不传代,让细胞继续生长到单层细胞铺满时会看到细胞呈现不规则多角形(图1F)。当培养基加入诱导因子后,乳腺上皮细胞周边会出现乳滴(图1G),乳滴不断向外分泌形成维管状(图1H)。该细胞能够连续传代60代以上,并且细胞形态没有发生变化,经液氮泠冻保存复苏后的细胞仍保持正常细胞形态(图1I)。
2.1.2 Western blot检测牦牛乳腺上皮细胞的乳蛋白表达 采用Western blot技术探测β-酪蛋白表达,结果显示,建立的牦牛乳腺上皮系具有合成牛奶蛋白的能力,另外,培养基中添加的诱导因子能够增强乳腺上皮细胞分泌乳蛋白能力(图2)。
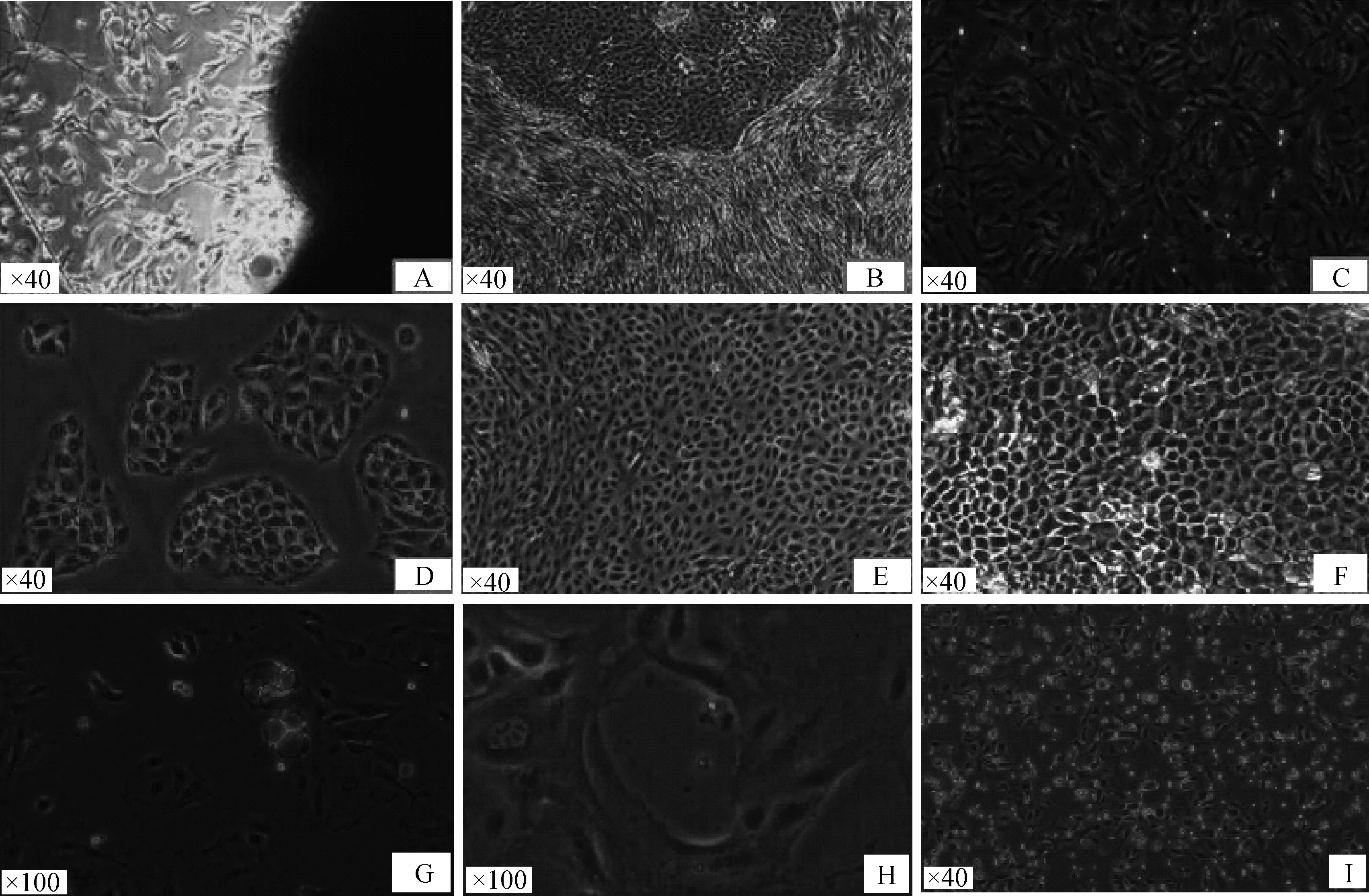
A.组织块周围游离出成纤维细胞;B.乳腺上皮细胞长出;C.纯化后的成纤维细胞;D.上皮细胞呈现岛状;E.上皮细胞呈现鹅卵石形;F.上皮细胞呈不规则多角形;G.乳腺上皮细胞分泌出乳滴;H.腔状结构出现;I:复苏细胞A.Fibroblasts elongated from tissues;B.Growth of mammary epithelial cells;C.Purification of fibroblasts;D.Yak mammary epithelial cells formed islands;E.Oval morphology of yak mammary epithelial cells;F.Irregular polygon morphology of yak mammary epithelial cells;G.Yak mammary epithelial cells contained milk drops;H.Tubular structure;I.Morphology of resuscitated yak mammary epithelial cells图1 牦牛乳腺上皮细胞的各种形态Fig.1 The morphology of yak mammary epithelial cells
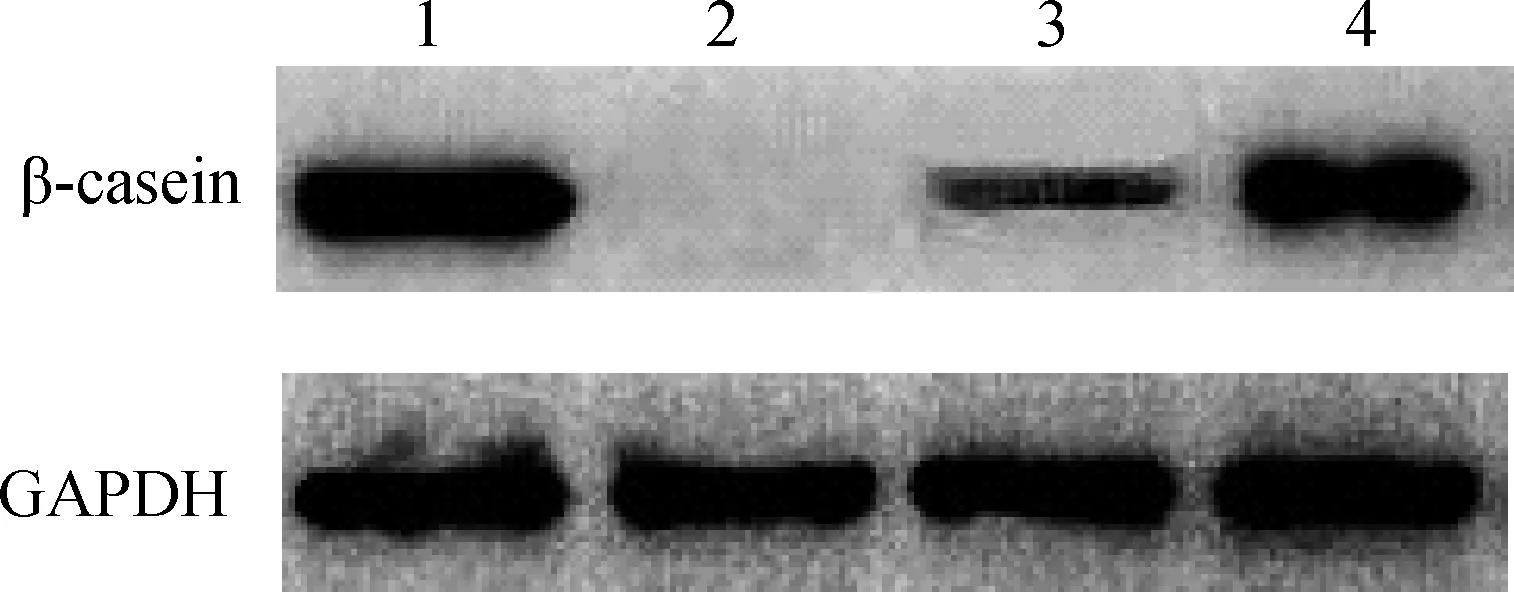
1.牦牛乳腺组织;2.成纤维细胞;3.牦牛乳腺上皮细胞(基础培养基);4.牦牛乳腺上皮细胞(诱导培养基)1.Mammary gland tissue of yak;2.Fibroblasts;3.Yak mammary epithelial cells cultured in basmal medium;4.Yak mammary epithelial cells cultured in induction medium图2 Western blot鉴定β-casein表达Fig.2 The identification of β-casein by Western blot
2.1.3 牦牛乳腺上皮细胞的免疫荧光鉴定 应用细胞免疫荧光染色的方法检测了乳腺上皮细胞Cytokeratin 18及Vimentin蛋白表达,倒置荧光显微镜观察结果,结果显示该细胞表达Cytokeratin 18蛋白(图3),Vimentin蛋白呈阴性(图3),进一步在蛋白水平上验证培养的细胞是乳腺上皮细胞,并没有成纤维细胞污染。
2.2 EGFP-N1转染牦牛乳腺上皮细胞
牦牛乳腺上皮细胞转染EGFP-N1 12 h后,可见部分细胞发绿色荧光,分布较散,且荧光比较弱(图4A)。24 h后阳性细胞明显增多,低倍镜下看到转染效率有30%左右,经G418筛选(600 μg·mL-1),第3 天大量细胞开始死亡,10 d后可看到有单克隆细胞产生(图4B),大约14 d,未转染的细胞在G418作用下全部死亡,此时G418浓度减半(300 μg·mL-1)继续筛选培养,待细胞铺满单层后扩大培养(图4C)。
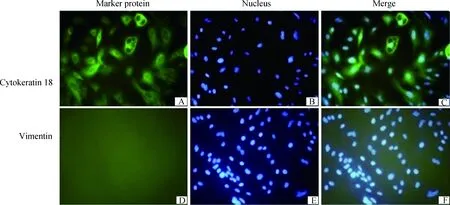
A.Cytokeratin 18蛋白免疫荧光图;B.细胞核免疫荧光图;C.Cytokeratin 18蛋白与细胞核免疫图合并;D.Vimentin蛋白免疫荧光图;E.细胞核免疫荧光图;F.Vimentin蛋白与细胞核免疫图合并A.Fluorecent image of cells incubated with anti-cytokeratin 18 antibody;B.Fluorecent image of cell nucleus;C.Mergence of fluorescent images of cytokeratin 18 and cell nucleus;D.Fluorecent image of cells incubated with vimentin antibody;E.Fluorecent image of cell nucleus;F.Mergence of fluorescent images of vimentin and cell nucleus图3 免疫荧光鉴定角蛋白8及角蛋白18 400×Fig.3 The immunofluorescence assay of cytokeratin 8 and cytokeratin 18 400×
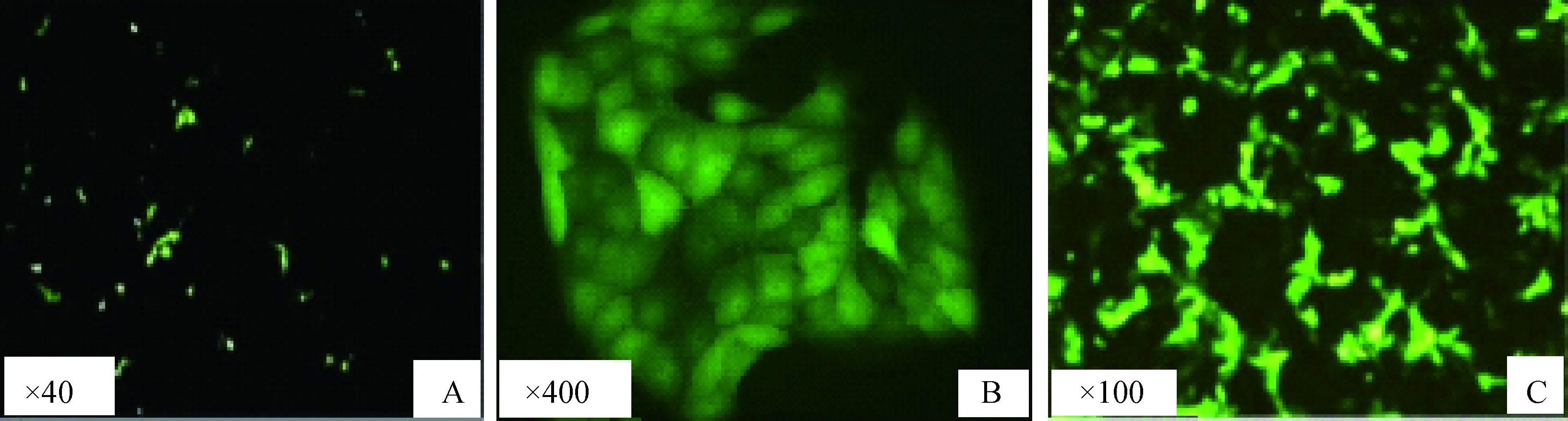
A.阳性细胞表达绿色荧光蛋白;B.G418筛选后阳性单克隆细胞;C.铺满平板阳性细胞A.Positive cell expressing the EGFP;B.The positive monoclonal cells after G418 screening;C.The positive cells overspreading the plate图4 绿色荧光蛋白在牦牛上皮细胞系中表达Fig.4 The expression of EGFP in yak mammary epithelial cell
2.3 金黄色葡萄球菌诱导牦牛乳腺上皮细胞的凋亡检测
2.3.1 普通光学显微镜下观察侵染后细胞凋亡情况 金黄色葡萄球菌侵染牦牛乳腺上皮细胞3 h后,显微镜下可看到对照组细胞形态完好,细胞与细胞之间的连接紧密;ATCC29525感染的上皮细胞有脱落现象,且细胞与细胞之间的连接松散,细胞有皱缩的趋势,但细胞膜完整。
2.3.2 流式细胞仪检测乳腺上皮细胞凋亡结果 为了进一步证明金黄色葡萄球菌可以诱导乳腺上皮细胞凋亡,采用流式细胞仪(AnnexinV/PI双染法)检测细胞凋亡情况。碘化丙啶(Propidium iodide,PI)是一种核酸染料,它不能透过正常细胞或早期凋亡细胞的完整的细胞膜,但对凋亡中晚期的细胞和坏死细胞,PI能够透过细胞膜而使细胞核染红。因此活细胞不被染色,早期凋亡的细胞仅被Annexin-FITC染色,晚期凋亡细胞可被Annexin/PI双染色。在双变量流式细胞仪的散点图上,左下象限显示活细胞,右下象限为早期凋亡细胞,右上象限是凋亡晚期细胞和坏死细胞。结果显示(图5),与对照组相比,金黄色葡萄球菌感染后的上皮细胞在早期凋亡率和晚期凋亡率均明显高于对照组,凋亡率差异显著(P<0.05)。

B1.坏死细胞;B2.继发性坏死细胞;B3.活细胞;B4.早期凋亡细胞B1.Necrotic cells;B2.Secondary necrotic cells;B3.Viable cells;B4.Early apoptotic cells图5 AnnexinV/PI 双染法分析细胞凋亡Fig.5 Analysis of apoptosis cell by AnnexinV/PI
2.3.3 抗菌肽及凋亡因子基因表达量检测分析
采用荧光定量PCR技术检测金黄色葡萄球菌感染乳腺上皮细胞前后抗菌TAP、BNBD5基因及凋亡因子BAX、BCL-2基因表达量变化。结果显示(图6),感染组细胞BNBD5及TAP基因表达量高于对照组(P<0.01);感染组细胞BAX基因表达量高于对照组(P<0.01),而BCL-2基因表达量低于对照组(P<0.05)。

CG.对照组;S.aureus treated.金黄色葡萄球菌侵染组;*.P<0.05;**.P<0.01CG.Control group;S.aureus treated.The cells infected by S.aureus;*.P<0.05;**.P<0.01图6 目的基因RT-PCR定量结果Fig.6 The relative expression of related genes
3 讨 论
3.1 牦牛乳腺上皮细胞的培养及鉴定
有泌乳功能的乳腺上皮细胞系不仅可以用来研究乳蛋白基因表达及泌乳机制,还可通过转基因技术改变乳汁的成分,获得具有生物活性成分的重要外源产物[13],但通过乳腺生物反应器生产能达到商品化生产所需的为数不多。因此,本研究建立正常乳腺上皮细胞培养体系,为进一步研究上皮细胞的增殖和分化以及乳腺生物反应器提供合适的细胞平台。
动物细胞原代培养主要有两种方法,一是组织块培养法,即从贴壁的组织块周围长出细胞,此种方法耗时长,但容易得到较纯的乳腺上皮细胞,已被证明适用于乳腺上皮细胞的原代培养;二是胶原酶消化法收集单细胞悬液,此种方法获得乳腺上皮细胞的时间短,但上皮细胞与成纤维细胞夹杂生长,不利于乳腺上皮细胞的纯化[14-15]。因此,本研究采用组织块培养法培养牦牛乳腺上皮细胞。细胞角蛋白18是上皮细胞的特异性标记蛋白,波形蛋白是成纤维细胞特异标记蛋白,细胞免疫荧光结果显示纯化的细胞为牦牛乳腺上皮细胞。在体外,一些激素已被证明能影响乳腺上皮细胞的增殖及诱导乳腺上皮细胞分泌乳汁。表皮生长因子(EGF)对细胞具有很强的促分裂活性和促生长作用[16],胰岛素能增加乳腺上皮细胞的贴壁率和伸展[16],氢化可的松对维持乳腺上皮细胞的生长也是必需的[17]。本研究选用含10%的胎牛血清、5 μg·mL-1的胰岛素、5 μg·mL-1EGF、1 μg·mL-1氢化可的松、100 μg·mL-1青链霉素的DMEM-F12培养液,细胞活力旺盛,生长良好,能够传至60代以上,说明此培养液适合乳腺上皮细胞的生长。β-酪蛋白的合成与分泌是功能性乳腺上皮细胞体外成功的标志,Western blot检测发现培养的乳腺上皮细胞能够分泌酪蛋白,证明培养的牦牛乳腺上皮细胞具有分泌乳汁能力。
3.2 牦牛乳腺上皮细胞转染EGFP-N1
小鼠曾被选作构建乳腺特异性表达载体的模式动物,但小鼠乳腺上皮细胞分泌的乳汁量有限,而牛与羊分泌的乳汁量较多,因此,牛羊乳腺上皮细胞可被选作乳腺生物反应器[18-19]。本研究采用EGFP-N1质粒转染牦牛乳腺上皮细胞检测转染效率,转染效率达到30%,说明牦牛乳腺上皮细胞具有整合外源基因的能力,可作为表达外源基因的生物反应器。
3.3 金黄色葡萄球菌感染牦牛乳腺上皮细胞的凋亡
金黄色葡萄球菌是引起奶牛乳房炎的主要致病菌,奶牛乳房炎可导致牛奶质量、产量下降从而造成严重的经济损失。目前,由金黄色葡萄球菌感染引起的牛乳房炎的致病机制尚不清楚,因此对发病机理的研究将是解决上述问题关键。本研究发现金黄色葡萄球菌感染牦牛乳房上皮细胞能够诱导细胞表达抗菌肽TAP及BNBD5,这与前人研究结果一致[20-21]。BAX和BCL-2分别作为凋亡因子及抗凋亡因子,其相对表达量调控细胞对凋亡刺激不同反应,即诱导或抑制凋亡。结果显示,金黄色葡萄球菌感染牦牛乳腺上皮细胞后,BAX基因表达升高,BCL-2基因表达量降低。流式细胞仪检测感染前后细胞凋亡情况,结果显示感染后的细胞具有较高的凋亡率。崔新洁等[22]采用金黄色葡萄球菌感染了牛乳腺上皮细胞,感染后的牛乳腺上皮细胞呈现了细胞核皱缩,染色质边缘化和细胞浆内空泡增多等典型凋亡特征,研究并证明了金黄色葡萄球菌能够诱导牛乳腺上皮细胞凋亡,并推测凋亡通路可能涉及 Caspase 3 和 Caspase 8 参与的外源性凋亡途径[22-23]。本研究建立的乳房上皮细胞能够用于金黄色葡萄球菌侵染研究,为下一步研究牦牛乳房炎提供了一个良好的体外研究模型。
4 结 论
本研究成功建立了一株稳定的牦牛乳房上皮细胞系,该细胞系保留了乳房上皮细胞系的典型细胞特征,暗示了该细胞系能够作为研究牦牛乳腺发育及分化的体外研究模型。
[1] SUN Y L,LIN C S,CHOU Y C.Establishment and characterization of a spontaneously immortalized porcine mammary epithelial cell line [J].CellBiolInt,2006,30(12):970-976.
[2] SHI H,LUO J,WANG W,et al.Establishment and characterization of a dairy goat mammary epithelial cell line with human telomerase(hT-MECs) [J].AnimSciJ,2014,85(7):735-743.
[3] TONG H L,LI Q Z,GAO X J,et al.Establishment and characterization of a lactating dairy goat mammary gland epithelial cell line [J].InvitroCellDevBiolAnim,2012,48(3):149-155.
[4] ZHAO K,LIU H Y,ZHOU M M,et al.Establishment and characterization of a lactating bovine mammary epithelial cell model for the study of milk synthesis [J].CellBiolInt,2010,34(7):717-721.
[5] GAFFNEV E V,POLANOWSKI F,BLACKBURN S E,et al.Cultures of normal human mammary cells [J].CellDiffer,1976,5(2):69-81.
[6] YANG J,RICHARDS J,GUZMAN R,et al.Sustained growth in primary culture of normal mammary epithelial cells embedded in collagen gels [J].ProcNatlAcadSciUSA,1980,77(4):2088-2092.
[7] PANTSCHENKO A G,WOODCOCK-MITCHELL J,BUSHMICH S L,et al.Establishment and characterization of a caprine mammary epithelial cell line(CMEC) [J].InvitroCellDevBiolAnim,2000,36(1):26-37.
[8] KE M W,HSU J T,JIANG Y N,et al.Characterization of hTERT-immortalized caprine mammary epithelial cells [J].ReprodDomestAnim,2012,47(4):553-561.
[9] HU H,WANG J,BU D,et al.Invitroculture and characterization of a mammary epithelial cell line from Chinese Holstein dairy cow [J].PLoSONE,2009,4(11):e7636.
[10] JEDRZEJCZAK M,SZATKOWSKA I.Bovine mammary epithelial cell cultures for the study of mammary gland functions [J].InvitroCellDevBiolAnim,2014,50:389-398.
[11] ANAND V,DOGRA N,SINGH S,et al.Establishment and characterization of a buffalo(Bubalusbubalis) mammary epithelial cell line [J].PLoSONE,2012,7(7):e40469.
[12] KAUSHIK R,SINGH K P,KUMARI A,et al.Isolation,characterization,and EGFP expression in the buffalo(Bubalusbubalis) mammary gland epithelial cell line[J].InvitroCellDevBiolAnim,2013,49(1):1-7.
[13] WHEELER T T,CALLAGHAN M R,DAVIS S R,et al.Milk protein synthesis,gene expression,and hormonal responsiveness in primary cultures of mammary cells from lactating sheep [J].ExpCellRes,1995,217(2):346-354.
[14] 王 桢,罗 军,王 伟,等.奶山羊乳腺上皮细胞的分离、培养及鉴定 [J].生物工程学报,2010,26(8):1123-1127. WANG Z,LUO J,WANG W,et al.Characterization and culture of isolated primary dairy goat mammary gland epithelial cells[J].ChineseJournalofBiotechnology,2010,26(8):1123-1127.(in Chinese)
[15] 陈建晖,佟慧丽,李庆章,等.奶牛乳腺上皮细胞系的建立 [J].畜牧兽医学报,2009,40(5):743-747. CHEN J H,TONG H L,LI Q Z,et al.Establishment of dairy cow mammary gland epithelial cell line [J].ActaVeterinariaetZootechnicaSinica,2009,40(5):743-747.(in Chinese)
[16] AKERS R M.Major advances associated with hormone and growth factor regulation of mammary growth and lactation in dairy cows [J].JDairySci,2006,89(4):1222-1234.
[17] PUISSANT C,ATTAL J,HOUDEBINE L M.The hormonal control of ovine beta-lactoglobulin gene in cultured ewe mammary explants [J].ReprodNutrDev,1990,30(2):245-251.
[18] WHEELER M B,WALTERS E M.Transgenic technology and applications in swine [J].Theriogenology,2001,56(8):1345-1369.
[19] KUMURA H,TANAKA A,ABO Y,et al.Primary culture of porcine mammary epithelial cells as a model system for evaluation of milk protein expression [J].BiosciBiotechnolBiochem,2001,65(9):2098-2101.
[20] YANG Z T,FU Y H,LIU B,et al.Farrerol regulates antimicrobial peptide expression and reduces Staphylococcus aureus internalization into bovine mammary epithelial cells[J].MicrobPathog,2013,65:1-6.
[21] WEI Z K,FU Y H,ZHOU E S,et al.Effects of niacin on Staphylococcus aureus internalization into bovine mammary epithelial cells by modulating NF-kB activation[J].MicrobPathog,2014,(71-72):62-67.
[22] 崔新洁,胡庆亮,李奕平,等.金黄色葡萄球菌诱导牛原代乳腺上皮细胞的凋亡[J].中国农业科学,2013,46(15):3212-3219. CUI X J,HU Q L,LI Y P,et al.The apoptosis of bovine primary mammary epithelial cells induced byStaphylococcusaureus[J].ScientiaAgriculturaSinica,2013,46(15):3212-3219.(in Chinese)
[23] HU Q,CUI X,TAO L,et al.Staphylococcusaureusinduces apoptosis in primary bovine mammary epithelial cells through Fas-FADD death receptor-linked caspase-8 signaling[J].DNACellBiol,2014,33(6):388-397.
(编辑 程金华)
Culture and Identification of Yak Mammary Epithelial Cells
CHEN Ya-bing1,FU Mei1,LAN Dao-liang2,LIN Bao-shan1,HUANG Cai1,LI Jian2*
(1.CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China; 2.CollegeofTibetanPlateauResearch,SouthwestUniversityforNationalities,Chengdu610041,China)
The present study was carried out to establish yak mammary epithelial cell (YMEC) line and identify its biological characteristic,which was separated using tissue explants method,purified by selective trypsinization,characterized by immunofluorescence and Western blot assay.TransfectingEGFP-N1 gene into cells using lipofection to examine whether foreign genes could be transfected into YMECs,fluorescence microscope was used to detect the expression ofEGFPgene.Lastly,flow cytometry was used to evaluate the apoptosis level of cells with Annexin V/PI double staining and RT-PCR was used to examine gene expression of antibacterial peptide and apoptosis factors to determine the effect ofStaphylococcusaureusinfection on YMECs.Immunofluorescence assay results proved established cell line could express cytokeratin 18 rather than vimentin,indicating no fibroblast existing in epithelial cells.Positive expression of β-casein in YMECs demonstrated cultured cells could synthesize and secrete mammary- specific milk protein.Moreover,we detected EGFP protein in transfected YMECs by fluorescence microscope,showingEGFPgene was successfully transfected into the YMECs.After YMECs were challenged with forStaphylococcusaureusfor 3 h,the apoptosis level of mammary epithelial cells was significantly up-regulated(P<0.05).Furthermore,the expression ofTAP(P<0.01),BNBD5(P<0.01)andBAX(P<0.01)genes increased; whereas that ofBCL-2 gene decreased(P<0.05).To conclude,we successfully established a stable yak mammary epithelial cell line,which can be used as a useful modelinvitrofor study of yak mammary gland development and differentiation.
yak;mammary epithelial cells;culture;characterization
10.11843/j.issn.0366-6964.2015.01.009
2014-07-31
国家公益行业(农业)科研专项(201203009)
陈亚冰(1989-),男,河南许昌人,硕士生,主要从事动物免疫机制研究,E-mail: xccyb 916@163.com
*通信作者:李 键,教授,博士,主要从事牦牛育种研究,E-mail: lijian@swun.cn
S823.8+5;S813
A
0366-6964(2015)01-0069-08

