长江口外浮游植物死亡释放溶解有机质的降解及其溶氧消耗*
高小丰 吴 莹 朱卓毅
(华东师范大学河口海岸学国家重点实验室 上海 200062)
溶解有机碳(dissolved organic carbon, DOC)是海洋中主要的有机碳储库, 其来源、迁移、转化和循环等过程是全球碳循环的关键部分(Hedges, 1992)。浮游植物光合作用现场生产的光合溶解有机碳(photosynthetically produced dissolved organic carbon,PDOC)约为10—12Gt (刘诚刚等, 2010), 是海洋中溶解有机碳的主要来源。浮游植物生长期间分泌及死亡后自溶释放的溶解有机质中, 含有大量较高活性的碳水化合物和氨基酸(Cherrieret al, 1996; Amonet al,2001; Meonet al, 2001)。这些溶解态的有机质因其较高的活性及生物可利用性, 绝大部分被微生物利用降解进入更高营养级重新参与碳循环, 但目前对于这一降解消耗的过程仍知之甚少。
长江口是我国入海通量最大、受人类活动影响最为强烈的河口。近几十年赤潮和低氧现象频发(叶属峰等, 2003; Weietal, 2007), 低氧问题总体呈恶化趋势(Wang, 2009; Zhuet al, 2011; 刘海霞等, 2012), 严重影响了当地生态系统。对于长江口低氧现象, 很多研究者都认同有机质在底部的耗氧是导致该现象的重要原因(Liet al, 2002; Weiet al, 2007; Hetlandet al, 2008; 王丹等, 2009), 目前针对颗粒态有机质降解耗氧情况已有部分研究(朱卓毅等, 2013), 但对于溶解态有机质降解耗氧情况的研究还较少。本文针对浮游植物死亡后释放的新鲜溶解态有机质, 研究其在模拟的密闭黑暗的海底环境中的降解情况以及耗氧过程, 从而评估浮游植物死亡释放溶解有机质的降解在低氧形成中的作用。
1 材料与方法
1.1 采样站位及实验设计
现场采样及溶解有机质降解培养实验于2013年8月在东方红 2号科考船上进行。采样站位为 A2、C3、M2站位(图 1)。在选定站位进行浮游植物拖网,采集的水样即刻用200μm筛绢过滤以除去浮游动物,获得的初步滤液立即放在–20°C的冰箱中冷冻24h以上。之后在室温条件下解冻并用 GF/F膜过滤, 获得高浓度的溶解有机质溶液。同时在相应站位采集底层海水, GF/C膜过滤获得引菌液, 并以此来稀释上述冷冻后的高浓度溶解有机质溶液。将两者混合均匀后分装到 BOD 瓶(磨口塞玻璃瓶, 约 60mL, 可液封)中,铝箔包裹遮光后置于表层循环海水培养箱中进行培养。前2天密集采样, 后面逐渐隔天采样至体系中溶氧低于1μmol/L为止, 因此培养时间不尽相同。每次从单独瓶中采样, 包括溶解氧(dissolved oxygen,DO)、过滤获得 DOC、总溶解态碳水化合物(total carbohydrate, TCHO)、异养细菌样品。实验过程中使用的玻璃瓶均在 2mol/L盐酸中浸泡三天以上, 用Milli-Q水洗净后, 在洁净实验台(紫外灯开启)吹干。
在M2、C3站位各进行一组培养。在A2站位进行三组培养, 较高浓度培养记为 A2-HC (high concentration), 较低浓度培养记为 A2-LC (low concentration), 并在后者选取部分样品添加 HgCl2作对照组, 记为A2-LC-HgCl2。HgCl2可杀死微生物, 对照目的在于观察异养细菌在有机质降解过程中的作用。对于 A2分较高和较低浓度组, 是由相同体积的底层海水稀释不同体积的高浓度冷冻溶解有机质滤液而获得。此三站位的培养方案均相同。但在A2-HC组培养中, 第40h后体系中的溶解氧浓度已趋于零, 为了进一步获得有机质降解和溶解氧的关系, 向该体系的剩余BOD瓶中增加补充空气的操作。具体: 用50mL的灭菌针筒及灭菌软管向BOD瓶中充入相同次数的空气, 充气后溶氧水平达到初始浓度的50%左右。
本实验方案通过 BOD瓶液封, 铝箔包裹遮光,用以营造一个密闭黑暗的模型, 最大程度模拟夏季层化后的底层海水环境, 目的是研究浮游植物死亡后沉降到海底释放出溶解有机质的降解耗氧过程。培养过程中通过拖网来富集浮游植物, 冷冻使浮游植物释放出有机质, 两个操作的结合促使获得高浓度、高活性的溶解态有机质, 为研究溶解有机质的降解及其经历的有氧到低氧甚至缺氧的过程提供保障。
图1 降解培养实验站位示意图Fig.1 Location of sampling stations
1.2 测样方法
溶解氧采用《海洋调查规范——海水化学要素调查》中的碘量法测定(海水化学要素调查, 2007), 平行滴定两次, 相对标准偏差为0.16%—0.29%。水样经过滤后获得DOC, TCHO样品, –20°C冷冻保存直至测定。DOC测定采用高温催化氧化法(Sugimuraet al,1988), 使用TOC-L CPH溶解有机碳分析仪(岛津)进行测定, 3—5次平行注射, 相对标准偏差<2% (鲍红艳, 2013)。TCHO测定采用TPTZ法(Myklestadet al,1997), 使用型号为Cary100紫外-可见分光光度计进行分析, 平行测定 3—6次, 检出限为2.4μmol/L C, 相对标准偏差为 5%—10%。FCM 样品采用多聚甲醛固定,混匀后在暗处静止 15min, 保存于液氮中, 采用型号为BD FACScalibur流式细胞仪进行测定分析, 每个样品测定三次求取平均值, 具体方法见文献(潘洛安, 2005)。
2 结果
2.1 冷冻过程对DOC释放的影响
8月, 长江口外浮游植物主要由甲藻和硅藻组成,且硅藻占主要优势(郭术津等, 2011; 赵冉等, 2009)。在 2011年夏季东海相应低氧区调查发现, 以中肋骨条藻和海链藻为优势种, 硅藻门浮游植物丰度为129.728×103cell/L, 丰度比值为 99.26%, 总浮游植物丰度明显高于非低氧区(赵其彪等, 2015)。
本文所选三个站位的浮游生物现场通过显微镜观测, 发现均以硅藻为主, 尤其是 A2站位, 硅藻丰度达到90%以上; C3站位硅藻约占到60%, 甲藻的种类较为丰富。此三站位的浮游植物不尽相同。
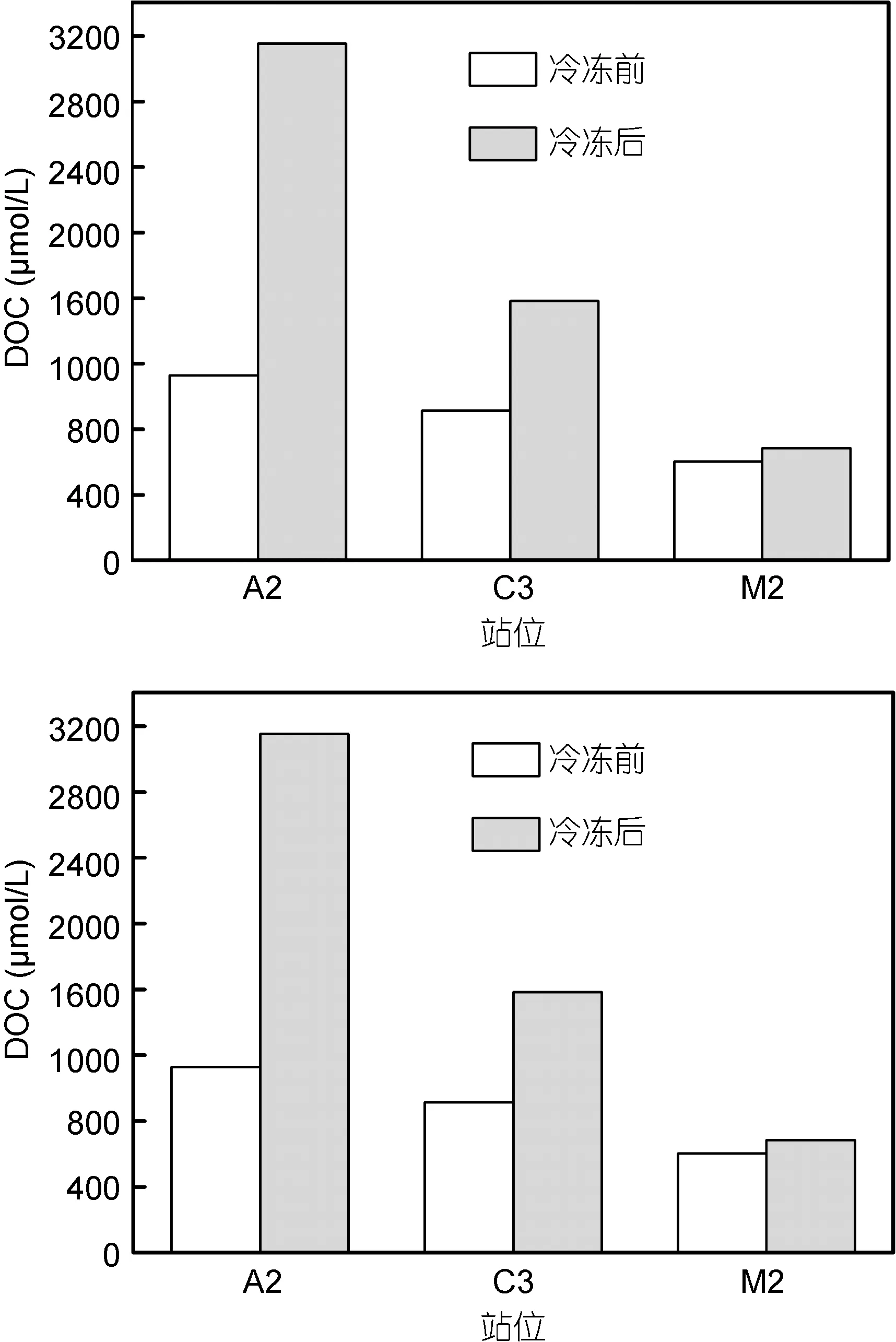
图2 各站位浮游植物拖网液冷冻前后DOC含量变化Fig.2 Variation in DOC of phytoplankton trawl samples from three stations in pre- and post-freezing tests
从图2可知, 各站浮游植物拖网液经过200μm筛绢过滤冷冻后, DOC浓度较冷冻前都有不同程度的释放。而不同站位 DOC释放程度并不一致, 可以看到A2站位冷冻后DOC含量增加了1.8倍, 而M2站位只增加了 0.14倍, 这可能与水域中浮游植物的丰度以及所处的生长时期有关。冷冻前后DOC浓度的变化说明拖网和冷冻起到了富集并促使浮游植物释放出溶解有机质的作用。
这些冷冻液经过滤稀释后构成本培养实验的基质, 其主要来源于拖网时浮游植物现场释放的PDOC,转移、过滤、冷冻等致使浮游植物死亡破碎后释放的DOC, 包括单糖、多糖、氨基酸以及脂类等多种成分。不同浮游植物, 以及浮游植物处在的不同生长时期所释放出的溶解有机质的组成、含量及活性均有较大的差异(Biddandaet al, 1997)。由此本文所选取的三个培养站位所获得的溶解有机质组分会有一定的差异。
2.2 溶解有机质的降解
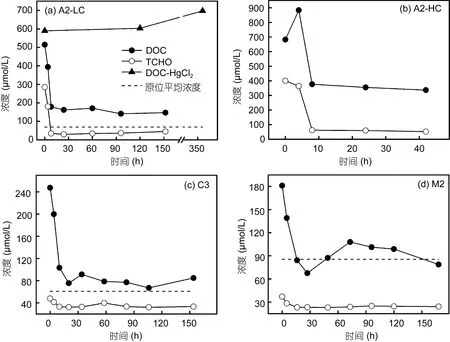
图3 各组DOC和TCHO的降解变化Fig.3 Variations of DOC and TCHO in the incubation experiment
从图3看出, 各组DOC均出现明显下降。在培养初期降解迅速, 之后降解速率明显下降并趋缓, 且略有波动。从 A2-LC-HgCl2组对比可发现, 添加HgCl2后, DOC浓度并没有降低, 反而略有上升。结合表 1, 培养过程中各组细菌出现明显的增长, 并达到不同的峰值, 说明本培养体系中异养细菌在有机质降解中起到了主要作用。在微生物环中, 细菌大量摄取溶解有机质来满足种群生物量的递增, 形成以异养细菌为主的二次生产力, 并被微型游生物摄食重新进入碳循环(Fuhrmanet al, 1980; Azamet al,1983)。但在本培养体系中, 因为基质经过滤已去除微型浮游生物, 从而使得微生物环在本培养体系不能完整存在。异养细菌在生长周期结束、病毒、环境改变等因素作用下死亡, 表1中观测到各组培养细菌丰度达到峰值后开始明显下降。并观测到A2-LC-HgCl2及C3组在培养后期DOC出现一定程度的增加, 可能与后期细菌死亡破碎释放溶解有机质有关。
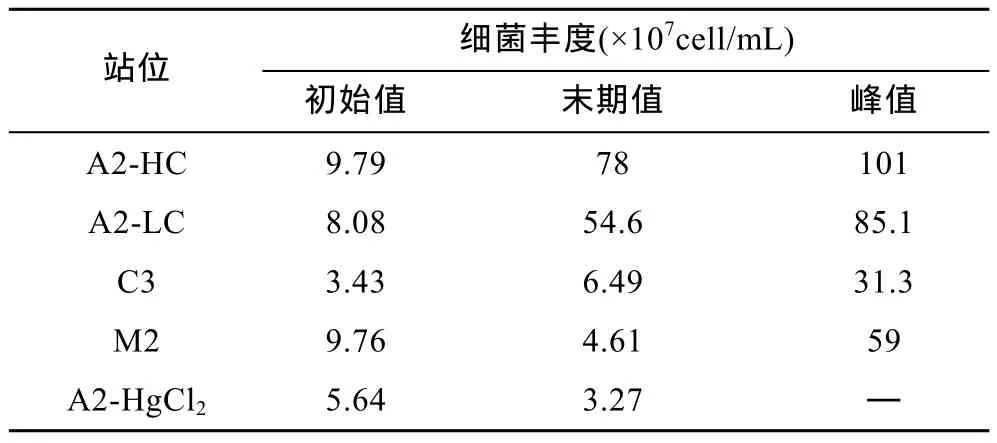
表1 各组培养细菌丰度的变化Tab.1 Initial, final and peak values of bacteria density in all the experimental groups
图 3中总溶解态碳水化合物(TCHO)同样出现降解, 但因各组含量不同, 降解量相差较大。在A2-HC和A2-LC组, 培养开始时多糖约占总糖含量的49%,培养结束时约87%的多糖被降解, TCHO与DOC的比值从培养初始的50%下降到小于20%。表明A2两组溶解有机质具有较高的活性。M2和 C3组中多糖在培养开始时仅占总糖含量的约20%, TCHO的含量和比值均较低, 因此各有机质降解量和降解速率相对A2组都较小。
溶解态碳水化合物是溶解有机质中重要的组成部分, 其中的多糖属于胶体, 很多是透明胞外聚合颗粒物(transparent exopolymer particles, TEP)的前体(Verdugoet al, 2004; 孙军, 2005)。溶解态多糖在本培养体系中的含量及变化表明, 可能存在很小一部分难以利用的溶解态多糖向 TEP的转化。因本文培养基质均经过滤, 溶解态有机质是本文研究重点, 其向TEP的转化应很少且仅是推测, 需要进一步的研究来验证。
在A2-HC组中, 培养开始的8h内DOC降解迅速, 降解量超过 300μmol/L, 占到 DOC 总降解量的85%以上, 之后 DOC的降解量大幅降低, 降解速率明显下降。此时体系中的DO含量已被消耗殆尽。为了进一步研究DO对溶解有机质降解的限制和两者的关系, 向该组的后续体系通入空气补充氧气。
DOC的降解在充气前已进入一个平台, 降解速率为 1.02μmol/(L·h), 充入氧气后, DOC 出现了明显的降解(图4), 降解速率上升为16.32μmol/(L·h), 即降解速率增大了约16倍, 氧气对DOC降解的限制可见一斑。此后, DOC降解并伴随着氧气的继续消耗, 两者速率同步减慢, 同时细菌丰度开始上升。在氧气消耗至零后, DOC浓度降解达到一个新的平台, 细菌丰度快速下降。DOC浓度在重新充气末期出现增加, 细菌丰度从高点下降幅度约6.3×108cell/mL (图4)。根据活体细菌丰度与细菌生物量之间的转化关系(Leeet al, 1987), 在一定程度上估算本体系中死亡细菌生物量约在数百微摩尔碳上。由此, 推测培养后期观测到DOC浓度上升现象或许与细菌死亡释放有关。
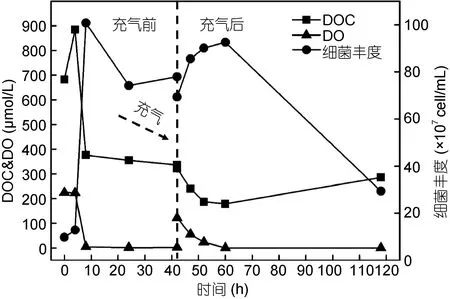
图4 A2-HC组充气前后各参数变化Fig.4 Variations of DO, DOC, bacteria in Group A2-HC in preand post-air-addition tests
2.3 DO的消耗
从图 5看出, 各组培养体系中 DO随时间的推移出现明显的下降, 并且初期降解迅速, 尤其在高浓度的A2-HC组、A2-LC组, DO在8h内基本被消耗至接近零。在M2和C3组培养中, DO消耗同样先快后慢, 逐渐到低氧, 最终达到缺氧的状态, 且培养后期达到的低氧状态与缺氧区的溶氧水平较为一致。
3 讨论
3.1 DOC的降解速率
有机质降解一般随时间以指数形式下降, 用以下方程(Lønborget al, 2009)对各组培养体系DOC的降解过程进行拟合:
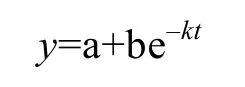

图5 各组DO的消耗情况Fig.5 Variation of DO in the incubation experiment
其中t代表时间,y代表t时刻体系中DOC的浓度, a代表培养末期未降解的DOC的浓度, b代表培养过程中降解掉的 DOC,k是降解速率常数, 此处记为k(DOC)。各组DOC的降解过程与拟合方程吻合度较好(表 2), 且 DOC的初始浓度越高, 降解速率越快, 这与Hopkinson和Lønborg的结论一致(Hopkinsonet al,1997; Lønborget al, 2009)。对本文各组培养拟合的k(DOC)值与其初始DOC浓度进行进一步线性分析, 发现两者具有较好的正相关性(R2=0.79)。说明体系中溶解有机质浓度越大, 其降解速率常数k(DOC)越大。
充气实验中, 补充氧气后 DOC有较大幅度的降解, 说明极低的溶氧水平是 DOC继续降解的主要限制因素。但其降解速率并未因补充溶氧而恢复到较高水平, 充气后初始速率为16.32 μmol/(L·h), 相比于培养初始的53.94μmol/(L·h)下降了69%, DOC降解速率常数k(DOC)也下降了43%。DOC活性同样是影响溶解有机质降解的关键因素(Manninoet al, 2000), 充气时TCHO/DOC比值由培养初始的56%下降至20%。由此可得, DOC的降解速率k(DOC)不仅受限于DOC浓度和细菌丰度, 同样受溶氧水平的抑制以及 DOC活性的影响。
各组培养体系中 DOC的降解量记做 ΔDOC, 以ΔDOC与初始 DOC的比值作为各组 DOC的降解程度。计算出各组培养的DOC降解程度都达到51%以上, 高于 Lønborg等在 Loch Greran培养中的29%(Lønborget al, 2009), 以及Kirchman等在北大西洋春季赤潮中的42%(Kirchmanet al, 1991)。本文短时间培养过程中表现的较高降解程度均反映出浮游植物死亡后释放出的新鲜有机质具有较高的活性。
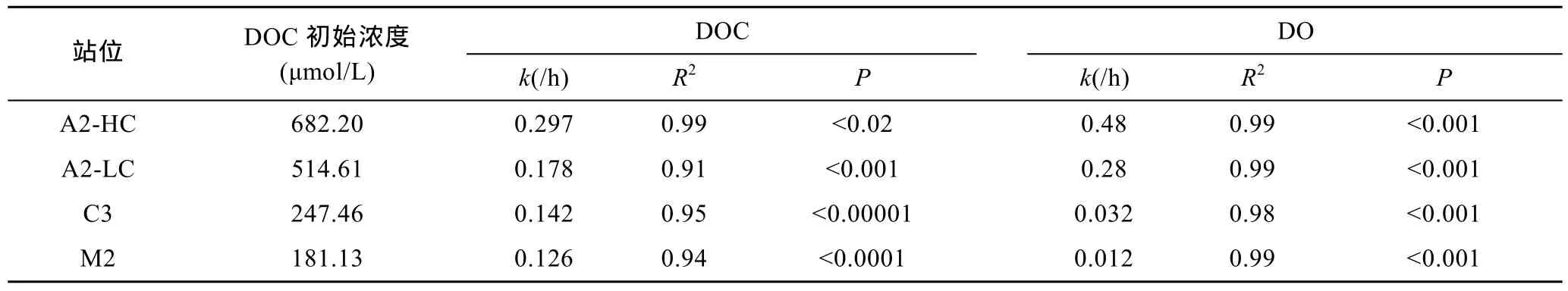
表2 DOC和DO按指数方程降解拟合结果Tab.2 Results of exponential equation fitting to DOC and DO data in the incubation experiment
3.2 DO的消耗速率
以方程y=y0e–kt对 DO 消耗的数据进行拟合。t代表时间,y代表t时刻体系中DO的浓度,y0代表初始DO浓度,k是降解速率常数, 此处记为k(DO)。拟合方程与降解过程具有较好的拟合度(表 2)。进一步分析得出, DOC浓度越高, DO的消耗速率越快, 即降解速率常数k(DO)越大。为进一步探讨两者之间的关系,以k(DO)对DOC初始浓度作图(图6)。通过对数据的拟合, 可以看到k(DO)与初始 DOC有较好的指数关系,随DOC浓度降低,k(DO)也逐渐降低。
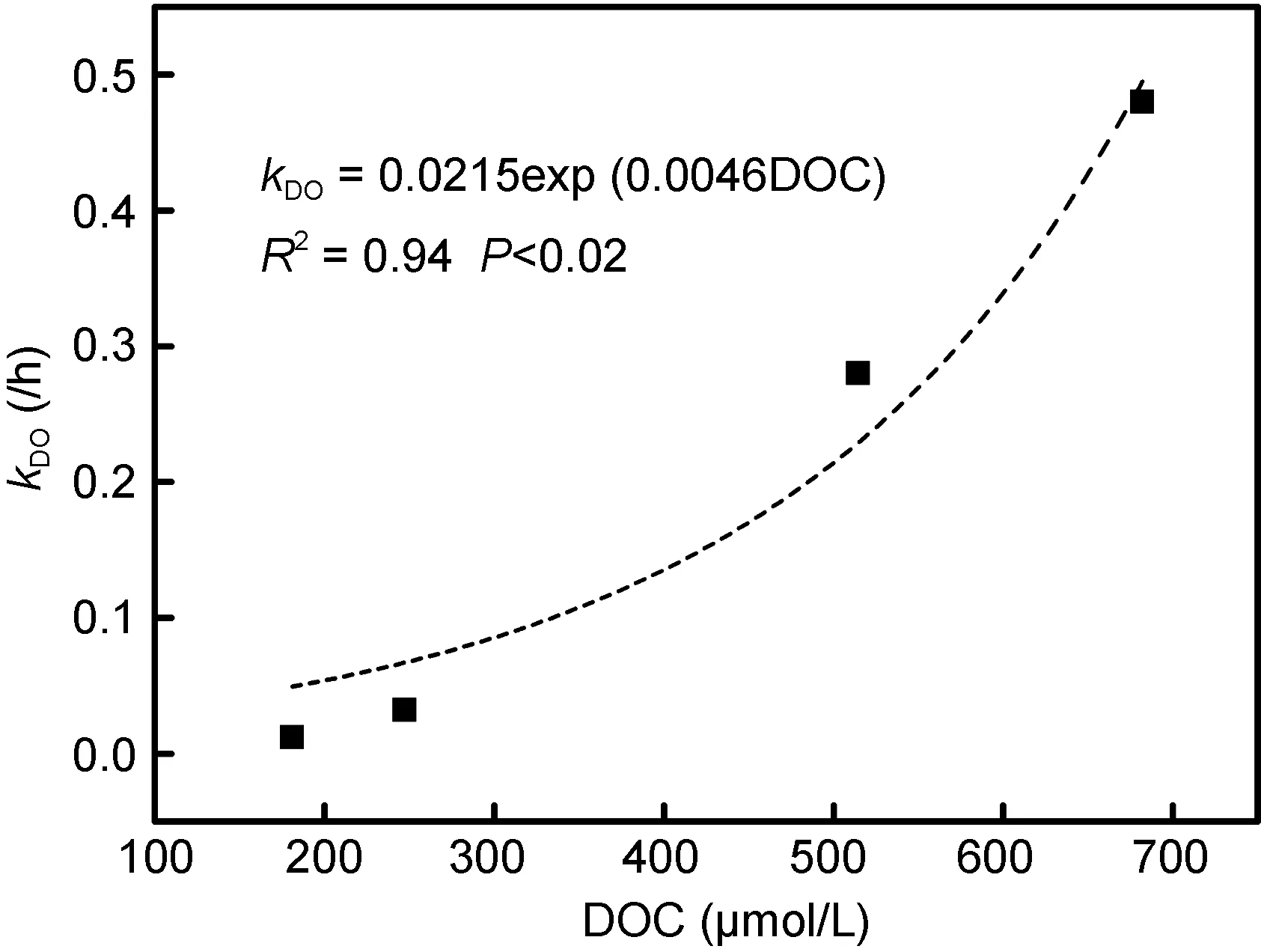
图6 各组k(DO)与初始DOC的关系Fig.6 Relationship between k(DO) and initial DOC concentration
东海近岸夏季 DOC浓度约在 85—120μmol/L(Hunget al, 2003), 根据图6拟合的方程推算出DO降解速率常数k(DO)的值约为0.0318—0.0373/h。以此降解速率, 并根据长江口外的溶氧水平, 推算出溶氧消耗至缺氧状态所需时间约为天到周际。王亚(2011)在研究长江口水流输运时间中发现洪季(5—10月)时,水流由徐六泾到长江口门(122.5°E)需要 16天, 底层水体的停留时间更长。培养的三个站位紧邻长江口,表层水体盐度最高为31, 仍受长江冲淡水的影响, 因此本文研究站位同样具有较长的水体停留时间。较长的水体停留时间为浮游植物释放的溶解有机质的降解提供较稳定的环境, 同时也有足够长的时间孕育低氧, 甚至缺氧状态的形成。
本培养体系中浮游植物以硅藻为主, 硅藻在死亡后, 会释放出黏性物质到细胞壁外, 使硅藻粘附在一起形成絮团增加沉降速度, 一天可沉降十几米到几十米(Passow, 1991)。水华期间, 大量的硅藻死亡后很快沉降至底层, 细胞逐渐破碎, 由此向底层在短时间内输入了大量较高活性的有机质, 包括溶解有机质。有机质在细菌的作用下快速分解, 消耗氧气。在A2培养站位, 水深 34.3m, 表层氧气含量为10.98mg/L, 在第二个采样层次(10m水深), 溶氧含量急剧降低至缺氧状态(1.86mg/L), 推测溶氧在不到10m的深度就已经达到缺氧状态。这也从侧面说明新鲜有机质对溶氧消耗贡献是不容忽视的。
刘诚刚(2012)在研究长江口外初级生产力和低氧关系时发现, 2006年7—8月的SeaWIFs遥感叶绿素a的影像表示, 8月下旬观测到大面积的底层缺氧区与半月前爆发的大范围水华区非常一致; 1999年同样在爆发水华20天后的相同区域观测到大面积底层低氧区。这一结果间接证明, 浮游植物所产生的有机质降解过程对氧气的快速消耗, 是导致低氧现象的重要因素。
本文通过研究浓缩浮游植物死亡后产生的新鲜溶解态有机质在密闭黑暗环境下的降解过程, 来认识其对低氧的贡献。在实际海域很难观测到如此高的含量。实际水体中存在浮游动物对浮游植物的摄食、溶解有机质的光降解过程以及颗粒态有机质的降解耗氧过程, 而且夏季台风事件对层化有扰动从而由上而下补充底层氧气, 使得对实际海域溶解有机质的降解以及其对低氧的消耗贡献估算比较困难。本文的初步研究仅能从一侧面提供较为理想状态下浮游植物释放的较高活性的溶解有机质对氧气的快速消耗情况, 部分揭示了新鲜溶解有机质对低氧促成的贡献。
4 结论
(1) 充气实验表明, 浮游植物死亡后释放的新鲜溶解有机质的降解速率受溶氧水平, DOC的浓度、活性, 以及细胞丰度等影响。
(2) 本培养体系中, DOC和 DO均呈指数降解,且体系中 DOC浓度越高, 其降解速率越快, 降解常数k越大。通过k(DO)与初始DOC浓度的指数关系, 推算出长江口外水体消耗至缺氧状态所需要时间尺度约为天到周。
(3) 本文培养结果表明, 浮游植物死亡后释放的溶解有机质因其较高的活性, 在其降解过程中快速消耗氧气, 对于长江口低氧的产生具有重要的推动作用。
致谢 成文过程中得到华东师范大学李英在样品测试方面的支持, 王晓娜、 张安余、张淼、王福强的修改意见, 以及中国科学院海洋研究所徐剑虹、李海波在现场采样中提供的帮助, 谨致谢忱。
王 丹, 孙 军, 周 锋等, 2009. 2006 年 6 月长江口低氧区及邻近水域浮游植物. 海洋与湖沼, 39(6): 619—627
王 亚, 2011. 长江河口水流输运时间的研究. 上海: 华东师范大学博士学位论文
朱卓毅, 张 经, 吴 莹等, 2013. 长江口外颗粒有机碳及光合色素在不同溶氧水平下早期降解速率研究. 海洋与湖沼, 44(1): 1—8
刘诚刚, 2012. 中国近海浮游植物光合溶解有机碳生产研究.青岛: 中国海洋大学博士学位论文
刘诚刚, 宁修仁, 郝 锵等, 2010. 海洋浮游植物溶解有机碳释放研究进展. 地球科学进展, 25(2): 123—132
刘海霞, 李道季, 高 磊等, 2012. 长江口夏季低氧区形成及加剧的成因分析. 海洋科学进展, 30(2): 186—197
孙 军, 2005. 海洋中的凝集网与透明胞外聚合颗粒物. 生态学报, 25(5): 1191—1198
叶属峰, 黄秀清. 2003. 东海赤潮及其监视监测. 海洋环境科学, 22(2): 10—14
赵 冉, 白 洁, 孙 军等, 2009. 2006年夏季长江口及其邻近水域浮游植物群集. 海洋湖沼通报, (2): 88—96
赵其彪, 孙 军, 李 丹等, 2015. 东海低氧区及邻近水域浮游植物的季节变化. 生态学报, 35(7): 2366—2379
郭术津, 田 伟, 戴民汉等, 2011. 2009年夏季东海浮游植物群集. 海洋科学进展, 29(4): 474—486
鲍红艳, 2013. 溶解态和颗粒态陆源有机质在典型河流和河口的来源、迁移和转化. 上海: 华东师范大学博士学位论文
潘洛安, 2005. 东海陆架及南海北部锋区微生物群落结构初探.上海: 华东师范大学硕士学位论文
中华人民共和国国家标准海洋调查规范: 第4部分: 海水化学要素观测. 2007. GB17378.4
Amon R M W, Fitznar H-P, Benner R, 2001. Linkages among the bioreactivity, chemical composition, and diagenetic state of marine dissolved organic matter. Limnology and Oceanography, 46(2): 287—297
Azam F, Fenchel T, Field J Get al, 1983. The ecological role of water-column microbes in the sea. Marine ecology progress series. Marine Ecology-Progress Series, 10(3): 257—263
Biddanda B, Benner R, 1997. Carbon, nitrogen, and carbohydrate fluxes during the production of particulate and dissolved organic matter by marine phytoplankton. Limnology and Oceanography, 42(3): 506—518
Cherrier J, Bauer J E, Druffel E R M, 1996. Utilization and turnover of labile dissolved organic matter by bacterial heterotrophs in eastern North Pacific surface waters. Marine Ecology Progress Series, 139(1—3): 267—279
Fuhrman J A, Azam F, 1980. Bacterioplankton secondary production estimates for coastal waters of British Columbia,Antarctica, and California. Applied and Environmental Microbiology, 39(6): 1085—1095
Hedges J I, 1992. Global biogeochemical cycles: progress and problems. Marine Chemistry, 39(1—3): 67—93
Hetland R D, DiMarco S F, 2008. How does the character of oxygen demand control the structure of hypoxia on the Texas–Louisiana continental shelf?. Journal of Marine Systems, 70(1—2): 49—62
Hopkinson C S, Fry B, Nolin A L, 1997. Stoichiometry of dissolved organic matter dynamics on the continental shelf of the northeastern U.S.A. Continental Shelf Research, 17(5):473—489
Hung J-J, Chen C-H, Gong G-Cet al, 2003. Distributions,stoichiometric patterns and cross-shelf exports of dissolved organic matter in the East China Sea. Deep Sea Research Part II: Topical Studies in Oceanography, 50(6—7):1127—1145
Kirchman D L, Suzuki Y, Garside Cet al, 1991. High turnover rates of dissolved organic carbon during a spring phytoplankton bloom. Nature, 352(6336): 612—614
Lee S, Fuhrman J A, 1987. Relationships between biovolume and biomass of naturally derived marine bacterioplankton.Applied and Environmental Microbiology, 53(6):1298—1303
Li D J, Zhang J, Huang D Jet al, 2002. Oxygen depletion off the Changjiang (Yangtze River) estuary. Science in China Series D: Earth Sciences, 45(12): 1137—1146
Lønborg C, Davidson K, Álvarez-Salgado X Aet al, 2009.Bioavailability and bacterial degradation rates of dissolved organic matter in a temperate coastal area during an annual cycle. Marine Chemistry, 113(3—4): 219—226
Mannino A, Harvey H R, 2000. Biochemical composition of particles and dissolved organic matter along an estuarine gradient: Sources and implications for DOM reactivity.Limnology and Oceanography, 45(4): 775—788
Meon B, Kirchman D L, 2001. Dynamics and molecular composition of dissolved organic material during experimental phytoplankton blooms. Marine Chemistry,75(3): 185—199
Myklestad S M, Skånøy E, Hestmann S, 1997. A sensitive and rapid method for analysis of dissolved mono-and polysaccharides in seawater. Marine Chemistry, 56(3—4):279—286
Passow U, 1991. Species-specific sedimentation and sinking velocities of diatoms. Marine Biology, 108(3): 449—455
Sugimura Y, Suzuki Y, 1988. A high-temperature catalytic oxidation method for the determination of non-volatile dissolved organic carbon in seawater by direct injection of a liquid sample. Marine Chemistry, 24(2): 105—131
Verdugo P, Alldredge A L, Azam Fet al, 2004. The oceanic gel phase: a bridge in the DOM–POM continuum. Marine Chemistry, 92(1—4): 67—85
Wang B D, 2009. Hydromorphological mechanisms leading to hypoxia off the Changjiang estuary. Marine Environmental Research, 67(1): 53—58
Wei H, He Y C, Li Q Jet al, 2007. Summer hypoxia adjacent to the Changjiang Estuary. Journal of Marine Systems,67(3—4): 292—303
Zhu Z Y, Zhang J, Wu Yet al, 2011. Hypoxia off the Changjiang(Yangtze River) Estuary: oxygen depletion and organic matter decomposition. Marine Chemistry, 125(1—4): 108—116

